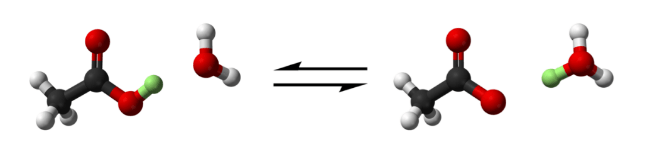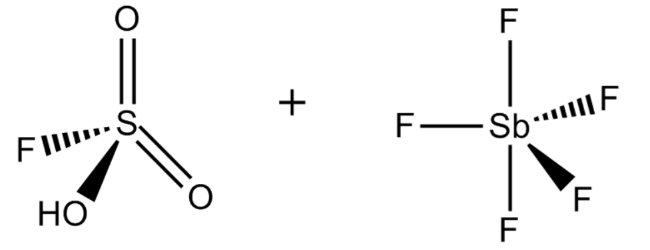какая кислота лучше всего растворяет органику
Удаление накипи и других отложений в системах отопления
В промышленности актуальная проблема – удаление накипи и других отложений в трубопроводах, системах отопления, котлах и другой аппаратуры.
Универсальной технологии для очистки промышленного оборудования не существует! Состав рабочего раствора зависит от состава отложений, материала из которого изготовлены системы оборудования, типа и технологических особенностей конструкции.
В пищевой промышленности добавляется «молочный камень» и другие специфические отложения.
Обычно состав раствора для очистки промышленного оборудования химическим методом подбирается специалистом при анализе образцов отложений.
При процессе химической очистки от отложений повсеместно требуется подогрев рабочего раствора.
Рассмотрим основные препараты для очистки трубопроводов и аппаратуры при удаление накипи:
Сульфаминовая кислота
Универсальное средство для чистки от ржавчины и накипи. Так же дезинфицирует и удаляет окалину.
Обладает более низкой коррозией металла, в сравнении с азотной и другими агрессивными кислотами.
Примерное описание рабочих растворов на основе Сульфаминовой кислоты:
Способы удаления:
— Молочный камень – водный раствор с концентрацией 1,5-2%, 70-75 о С, продолжительность использования 30-40 минут. Расход — не более 70 грамм на тонну молока.
— Пивной камень – водный раствор 0,5-1,5кг (1,5кг при слое более 3мм) на 10кг воды, температура применения 50-60 о С, время применения – 6-8 часов. После окончания тщательно промыть оборудование водой.
Удаление накипи для теплообменников (бытовых, в том числе радиаторов): раствор с концентрацией сульфаминовой кислоты 2-3%, 70-75 о С, время воздействия не более 7 ч. В раствор рекомендуется добавить ингибитор коррозии. По окончании тщательно промыть водой (или раствором соды).
Для агрегатов целлюлозно-бумажных производств – раствор с концентрацией 10%, 25-45°С, время примерно 2-5 часов (до снижения концентрации обрабатывающего раствора до минимума). Процесс можно осуществлять с рециркуляцией. Рабочий раствор повторно не применяется. Утилизация раствора – слив в промканализацию.
Щавелевая кислота
Хорошо очищает от ржавчины и накипи, не вступает в реакцию с краской.
Ортофосфорная кислота
Применяется для чистки от накипи и ржавчины. Является ингибитором коррозии – образует на поверхности металла защитную пленку, препятствующую дальнейшему образованию ржавчины.
Азотная кислота
Удаляет масляные образования, а так же состоящие из карбоната кальция.
Минусом является повышенная агрессивность к некоторым металлам (например меди).
Примерный состав для удаления карбоната кальция:
0,5% раствор при рабочей температуре 50-60°С, время воздействия 15 мин.
Тринатрийфосфат
Защищает от образования накипи и ржавчины. Обезжиривает поверхность. Является щелочным средством.
Эффективен для воды с содержанием карбоната кальция не более 6 мг-экв/л.
В промышленности применяется раствор с концентрацией 50-100 гр/л. Для удаления накипи – 3-10гр/л.
Натр едкий (каустическая сода)
Является щелочным средством. Применяется для удаления отложений накипи и коррозии.
Выпускается в жидком и сухом (порошок или гранулы) виде.
Необходимо использовать горячий раствор.
Отлично удаляет органические засоры.
Лимонная кислота
Наименее опасна для организма человека. Рекомендуется применять при температуре не ниже 90°С. По другим данным удаление накипи начинается уже от 60°С.
Трилон-Б
Не является окислителем. Переводит нерастворимые соли металлов в растворимые. Неоспоримый плюс – не разрушает пластиковые и резиновые детали (прокладки, соединения и прочие элементы).
Применяется водный раствор с концентрацией не более 80 гр/л.
– раствор 0,1/1% — 100 гр на литр
Соляная и серная кислоты
Агрессивные кислоты. Портят металл, обладают повышенной опасностью. Но и наиболее интенсивно растворяют отложения. Наиболее дешевые кислоты.
Серная кислота применяют для отложений в которых содержание кальция не более 10%. Так же серная кислота вызывает коррозию меди.
Для удаления карбонатных отложений используют соляную кислоту. Карбонатные отложения нельзя чистить серной кислотой – при взаимодействии отложения перейдут в ещё более труднорастворимые соединения группы сульфатов.
Образуют агрессивные растворы.
При разбавлении водой Бифторида аммония образуется фтористоводородная кислота.
Можно сразу использовать фтористоводородную кислоту.
Применяется при фосфатных и силикатных отложений, которые другими средствами удалить достаточно трудно. Может применяться самостоятельно или как дополнительный компонент рабочего раствора.
Дополнительные этапы:
На стадии обработки куски отложений отваливаются, поэтому вторая стадия – промывка водой обязательна. Причем скорость промывки должна быть достаточной для того, чтобы в изгибах труб не скапливались частицы отделенных отложений.
При обработке кислотами поверхность металла становиться более подвержена коррозии. Чтобы этого избежать производят дополнительную обработку щелочными растворами: Натр едкий, Сода кальцинированная, Тринатрийфосфат, водный раствор Аммиака.
В качестве ингибитора коррозии рекомендовано применять Триполифосфат натрия, Силикат натрия, Сульфат цинка, Бихромат калия и др.
Для Триполифосфата натрия при его использовании как ингибитора коррозии используют водный раствор с концентрацией 100мг/л. Раствор используется в течении нескольких дней. Скорость раствора не менее 0,3 м/с.
Для очистки поступающей воды от органических загрязнителей и отработанных (сточных) вод применяют Алюминий сернокислый, Железо(III) сернокислое 9-водное и другие материалы.
Чтобы приобрести эти товары позвоните нам по телефонам (495)133-02-40, (495)407-17-86 прямо сейчас!
Или напишите заявку на order@chimko.com
С перечнем товаров Вы можете ознакомиться в Каталоге продукции.
Каустическая сода: ее свойства и применение
Описание средства
Каустическая сода — сильная ядовитая щелочь. Если ее раствор попадет на кожу, то могут возникнуть ожоги, язвы. Она относится ко 2 классу опасности, поэтому при использовании необходимо соблюдать меры предосторожности:
Каустическая сода — продукт химического синтеза, в природе такого вещества не существует. Продается она в хозяйственных магазинах, отделах бытовой химии, расфасована в пластиковые банки или плотные полиэтиленовые мешки весом от 250 г до 30 кг.
Применение
У едкого натра очень широкий спектр применения в различных отраслях производства: текстильной, химической, пищевой, нефтяной и пр. Большая часть стиральных порошков, шампуней, моющих, чистящих средств содержит каустик. Его используют в производстве бумаги, вискозы, оливок, мороженого, какао, шоколада. В пищевой промышленности он известен как пищевая добавка Е524.
В быту основное назначение гидроксида натрия — борьба с жировыми и органическими загрязнениями. Его применяют для чистки канализации, обезжиривания поверхностей, в изготовлении мыла ручным способом, отбеливании и стирке белья, борьбе с садовыми вредителями, для санитарной обработки помещений.
Чистка канализации
Канализационные трубы имеют свойство засоряться: на их внутренней поверхности оседает жир, мыльная пена, органические остатки. Все это спрессовывается, уменьшая просвет трубы, вода плохо уходит, появляется неприятный запах из сливного отверстия. Причины могут быть как технические, так и эксплуатационные:
Перед работой желательно на несколько минут открыть горячую воду для того, чтобы канализационная система прогрелась, и загрязнения лучше поддавались обработке щелочью. Для очистки канализации от жировых и органических загрязнений с помощью каустической соды существует несколько методов:
Раствор гидроксида натрия используют в качестве профилактического средства 1 раз в 3 месяца для промывки труб от накопившихся частичек жира и органических загрязнений.
Чистка выгребных ям
В выгребные ямы на даче или в частном доме сливаются все нечистоты. Большая их часть имеет жидкую фракцию, которая уходит через земляные стенки, а густая скапливается на дне и по мере необходимости удаляется.
Очень часто стенки выгребных ям покрываются плотной органической пленкой, вода перестает уходить. В результате канализационные отходы быстро переполняют яму. Для растворения пленки и очистки земляных стенок используют каустическую соду. Количество ее берут из расчета 4 кг на 1 кубометр выгребной ямы. Предварительно растворив соду в воде, аккуратно выливают раствор едкой щелочи в яму. Эффект наступает через 2-3 дня. Пленка постепенно растворяется, уровень жидкости уменьшается, на дне остается илистый осадок.
Очистка загрязненных поверхностей
Каустическая сода применяется для чистки эмалированных раковин, поверхностей плит, сильнозагрязненной кухонной посуды от жира, копоти, нагара. Для этого нужно смешать ее с жидким моющим средством или со стиральным порошком, развести водой до консистенции пасты, нанести на поверхность. Через 20–30 минут смыть большим количеством воды.
Использовать каустическую соду на оцинкованных, алюминиевых и тефлоновых поверхностях нельзя. Их можно испортить.
Стирка белья
Раствор каустика используют для замачивания, ручной и машинной стирки хлопчатобумажного, льняного белья. При добавлении щелочи вода становится мягкой, пятна хорошо удаляются, особенно с кухонных полотенец. Раствор готовят следующим образом: в 5 л воды нужно развести 3 ст. л. NaOH. Замочить белье на 1–2 часа. После этого постирать обычным порошком.
При стирке белья в стиральной машине к порошку добавляют 2–3 ложки каустической соды. Пятна, даже застарелые, легко отстирываются. Перед стиркой белье желательно замочить, стирать при температуре 40–60°С.
Изделия из шелковых и шерстяных тканей стирать с помощью щелочи не рекомендуется, она может повредить их структуру.
Изготовление мыла
Способов изготовления домашнего мыла с помощью каустической соды множество. Необходимые ингредиенты:
1 л любого растительного масла;
300 мл дистиллированной воды;
эфирные ароматические масла;
порошки, настои различных трав.
Через 4-5 дней можно вынуть мыло из формочек, дать ему”дозреть” и подсохнуть. На это понадобится время (иногда несколько недель). Признаком готовности мыла считается появление на его поверхности белого порошкообразного налета.
Борьба с вредителями и болезнями растений
Гидроксид натрия применяют в борьбе с садовыми вредителями и болезнями растений, для обеззараживания овощехранилищ, амбаров, клеток для животных, теплиц.
Для обработки растений делают раствор: в 2 л воды добавляют 1 ложку каустика, тщательно размешивают, опрыскивают деревья и кустарники. Это помогает избавиться от тли, долгоносика, грибковых поражений: фитофтороза, мучнистой росы.
Для обеззараживания помещений используют 4%-ный раствор NaOH. Для этого берут 10 ст. л.соды растворяют в 5 л воды и несколько раз обрабатывают зараженные поверхности.
Краткий обзор органических растворителей
Данная статья представляет собой краткий обзор органических растворителей, которые нужны для очистки различных приборов, производства химических волокон, косметических, лекарственных и пищевых продуктов. Также они применяются для разбавления красок и лаков, мастик и полиролей. Органические разбавители используются для ремонта и покраски, очистки и обезжиривания, снятия старых покрытий, приготовления художественных красок.
Классификация
С точки зрения химии все органические разбавители можно разделить на:
— углеводородные различного типа;
— спирты разного типа;
— эфиры;
— кетоны;
— галогеносодержащие.
Органические растворители легколетучи, огнеопасны и взрывоопасны, вредны для человека и для окружающей среды, хотя и в разной степени, поэтому работать с ними следует с соблюдением противопожарной техники безопасности, в помещениях с хорошей вентиляцией и используя индивидуальные средства защиты (перчатки и маски). Хранить следует в герметично закрытых сосудах с соблюдением мер противопожарной безопасности.
Углеводородные растворители
Делятся на:
— алифатические (парафины и алканы);
— алициклические;
— ароматические;
— нефтяные;
— терпеновые.
Разбавители этого типа дешевы и доступны. Большей частью их получают из нефти и сопутствующих газов, реже — из каменного угля, древесины, сланцевого бензина.
— Алифатические углеводороды, в основном парафины и изопарафины, применяются в производстве красок и лаков. Особенно интересны изопарафины, которые благодаря малой токсичности используются при изготовлении хирургических нитей.
— Алициклические углеводороды применяют в производстве химических нитей, резин, полиграфических красок, для растворения каучуков и жиров.
— Ароматические углеводороды широко используются из-за высокой растворимости. К ним относятся, например, толуол, бензол, сольвент.
— К нефтяным растворителям относят группу веществ, объединенную общим названием «НЕФРАС». Это: уайт-спирит, бензиновые и некоторые другие растворители.
— Терпеновые углеводороды бывают природного и искусственного происхождения. Как правило, их получают из растительного сырья. К таким относятся, в частности, скипидар и пайнойль.
Спирты
Спиртовые разбавители: этанол, метанол, глицерин, этиленгликоль, изопропанол, бутанол и другие, используются в промышленности и быту миллионами тонн. Применяются в производстве красок и эмалей, для очистки, как составная часть аэрозолей, косметических, лекарственных средств и пищевых продуктов.
Растворители на основе эфиров
Делятся на простые и сложные. К простым относят одно- и двуатомные спирты и их соединения. Например, моноалкиловые эфиры этилен- и диэтиленгликоля.
Очень востребованы ацетаты — сложные эфиры уксусной кислоты. Эфиры других кислот стоят дороже и используются редко.
Кетоновые растворители
бывают алифатическими и циклическими. Алифатические слаботоксичны, отличаются высокой растворяющей способностью. К ним относятся ацетон, диизобутилкетон и др. В группу более токсичных циклических кетонов входят циклогексанон и его производные.
Галогеносодержащие растворители
Весьма востребованы промышленностью, несмотря на высокую токсичность и разрушающее воздействие на озоновый слой. Зато они обладают высокой растворяющей способностью и наименее пожароопасны среди всех органических растворителей. На основе галогеносодержащих соединений получают высококачественные растворители и обезжиривающие составы.
В нашем химическом интернет-магазине вы можете купить такие растворители как изопропиловый спирт, глицерин, этиленгликоль, циклогексанон, цена на который у нас невысокая, а также другие реактивы и широкий спектр товаров для лабораторий по доступным ценам. В ассортименте есть и средства защиты.
8 сильнейших кислот, известных нам
Что делает кислоту сильной или слабой? Чтобы ответить на этот вопрос, нам сначала нужно взглянуть на определение кислоты. Это химическое соединение, которое принимает электроны и / или отдает (диссоциирует) ионы водорода, также известные как протоны.
Следовательно, уровни кислотности кислоты зависят от ее способности диссоциировать ионы водорода, т.е. чем больше число ионов водорода, продуцируемых кислотой в растворе, тем более кислым он является. Теперь, прежде чем мы перейдем к списку сильнейших кислот на Земле, есть определенные термины и определения, с которыми вам необходимо ознакомиться.
Это подводит нас к другому связанному и важному показателю кислотности pKa. Это в основном отрицательный целочисленный логарифм Ka.
Чем сильнее кислота, тем ниже значения pKa.
Уксусная кислота отдает протон (в зеленом цвете) воде, чтобы произвести ион гидрония и ион ацетата. (Кислород в красном, водород в белом и углерод в черном)
Функция кислотности Гаммета: (H o) Всем нам известна шкала pH, которая обычно используется для измерения уровней кислотности или основности химических веществ, но когда речь идет о суперкислотах, она просто становится бесполезной, поскольку их уровни кислотности в миллион раз больше, чем серная и соляная кислоты.
Таким образом, чтобы измерить суперкислоты на основе их уровней кислотности, исследователи придумали функцию кислотности Гаммета. Первоначально он был предложен американским физическим химиком Луи Плаком Гаммет.
8. Серная кислота
Серная кислота (98%) на листе бумаги
Серная кислота или купорос не нуждаются в формальном введении. Он не имеет запаха, цвета и вызывает интенсивную экзотермическую реакцию при смешивании с водой. Серная кислота является важным химическим веществом, которое необходимо для многих отраслей промышленности, таких как сельское хозяйство, очистка сточных вод и нефтепереработка. Она также используется в кислотах аккумулятора и чистящих средствах.
Она также играет важную роль в изучении кислот в целом. Серная кислота служит базовым эталоном для сравнения уровней кислотности суперкислот или кислот. Хотя существует несколько способов получения серной кислоты, обычно используют контактный процесс и влажный процесс серной кислоты.
H 2 SO 4 может нанести значительный ущерб коже человека при прямом контакте. Это также очень разъедает многие металлы. Химическое вещество гораздо более агрессивно и опасно, когда присутствует в высокой концентрации, благодаря своим превосходным окислительным и дегидратирующим свойствам.
7. Соляная кислота
Подобно серной кислоте, соляная кислота также является важным химическим веществом, которое широко используется в лабораториях и различных отраслях промышленности. Соляная кислота была обнаружена где-то около 800 г. н.э. иранским ученым-эрудитом по имени Джабир ибн Хайян.
Те, кто задаются вопросом, почему соляная кислота сильнее серной кислоты, несмотря на то, что последняя является контрольной точкой для суперкислот, причина этого заключается в том, что серная кислота является дипротоновой кислотой, которая обычно не полностью диссоциирует.
Другими словами, HCl сильнее серной кислоты, поскольку ее ионы водорода (HCl) легко отделяются от хлорида по сравнению с сульфат-ионом из серной кислоты. Так или иначе, соляная кислота в основном используется в тяжелой промышленности для удаления ржавчины с железа и стали перед дальнейшей обработкой. Кроме того, это жизненно важный компонент в производстве органических (винилхлорид используется для ПВХ) и многих неорганических соединений.
6. Трифторметансульфоновая кислота
Трифликовая кислота используется во многих протонированиях и титрованиях (количественный анализ химического состава). Важная причина, по которой трифликовая кислота является предпочтительной в определенных случаях, заключается в том, что она не сульфонирует другие вещества, что характерно для хлорсульфоновой кислоты и серной кислоты.
Излишне говорить, что это чрезвычайно опасно. Любой контакт кожи с кислотой может вызвать серьезные ожоги и может привести к незначительному повреждению тканей. Это может также вызвать отек легких и судороги и другие критические условия при вдыхании.
5. Фторсульфоновая кислота
Фторосерная кислота или серно-фтористоводородная кислота (официальное название) является второй сильнейшей однокомпонентной кислотой, доступной сегодня. Это желтый на вид и, конечно, очень едкий / токсичный. HSO 3 F обычно получают путем взаимодействия фтористого водорода с триоксидом серы, и в сочетании с пентафторидом сурьмы он образует «волшебную кислоту», гораздо более сильную кислоту и протонирующий агент.
Кислота может быть использована для алкилирования углеводородов (с алкенами) и изомеризации алканов, а также для травления стекла (художественное стекло). Это обычный фторирующий агент в лабораториях.
4. Хлорная кислота
Хлорная кислота является одной из самых сильных кислот Бренстеда-Лоури, которые обладают сильными окислительными свойствами и обладают высокой коррозионной активностью. Традиционно ее получают обработкой перхлората натрия соляной кислотой (HCl), которая также создает хлорид натрия.
NaClO4 + HCl → NaCl + HClO4
В отличие от других кислот, хлорная кислота не подвержена гидролизу. Это также одна из самых регулируемых кислот в мире. Еще в 1947 году в Лос-Анджелесе, штат Калифорния, около 150 человек получили ранения и 17 человек погибли в результате химического взрыва, в котором содержалось почти 75% хлорной кислоты (по объему) и 25% ангидрида уксусной кислоты. Также было повреждено более 250 близлежащих зданий и транспортных средств.
Несмотря на взрывную природу, хлорная кислота широко используется и даже предпочтительна в некоторых типах синтеза. Это также важный компонент перхлората аммония, который используется в современном ракетном топливе.
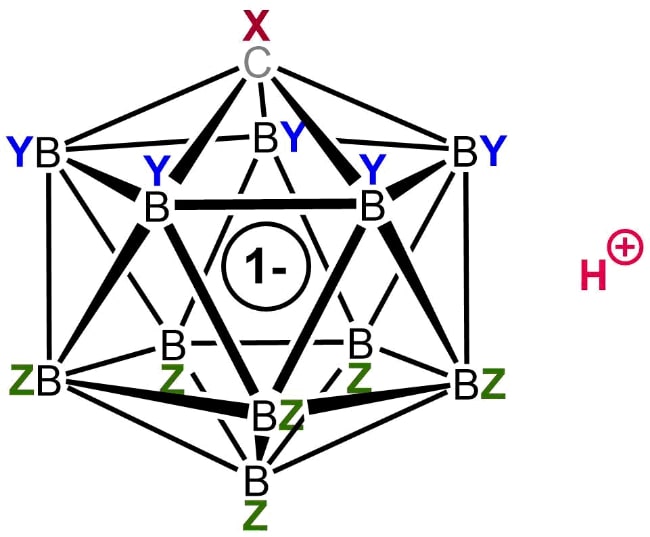
3. Фторированная карборановая кислота
Общая структура карбоновой кислоты
Одним из таких членов этой группы является фторированная карборановая кислота. Хотя о существовании такого химического вещества первоначально сообщалось в 2007 году, исследователи смогли в полной мере изучить его природу только в 2013 году. До его открытия корона сильнейшей кислоты Бренстеда перешла к сильно хлорированной версии этого семейства суперкислот.
Фторированный карборан является единственной известной кислотой, которая может протонировать (переносить ион водорода) диоксид углерода с образованием катионов, соединенных водородом. В отличие от этого, CO 2 не подвергается какой-либо заметной протонации при обработке другими суперкислотами, такими как магическая кислота и HF-SbF5.
2. Волшебная кислота
FSO 3 H · SbF 5, наиболее известный как магическая кислота, получают смешением фторсерной кислоты и пентафторида сурьмы в молярном соотношении 1: 1. Эта сверхкислотная система была впервые разработана в 1966 году исследователями из лаборатории Джорджа Олаха, Университета Case Western Reserve в Огайо.
Его довольно причудливое название было установлено после официального события в 1966 году, когда сотрудник лаборатории Олаха продемонстрировал протонирование углеводородов, в котором парафиновая свеча «волшебным образом» растворилась и превратилась в раствор трет-бутильного катиона после того, как она была помещена в то, что сейчас известно как волшебная кислота.
Хотя Волшебная кислота обычно используется для стабилизации ионов углерода в растворах, она имеет несколько других важных промышленных применений. Например, он может ускорить изомеризацию насыщенных углеводородов и даже протоната метана, ксенона и галогенов, которые все являются слабыми основаниями.
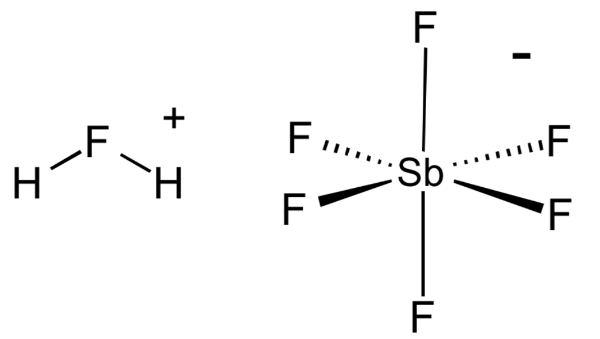
1. Фтороантимоновая кислота
Фторантимоновая кислота является, пожалуй, самой сильной из всех известных суперкислот, основанных на значениях функции кислотности Гаммета. Его получают путем смешивания фтористого водорода с пентафторидом сурьмы, как правило, в соотношении 2: 1. Эта реакция носит экзотермический характер.
Этот суперкислота имеет несколько важных применений в химическом машиностроении и нефтехимической промышленности. Например, его можно использовать для отделения метана и Н 2 от неопентана и изобутана (оба алкана) соответственно.
Неудивительно, что H 2 FSbF 6 чрезвычайно агрессивен и может подвергаться сильному гидролизу при контакте с водой. Как и большинство суперкислот, фторантимоновая кислота может питаться прямо через стекло, поэтому она должна храниться в контейнерах из политетрафторэтилена.
Теперь, большинство из вас, возможно, наткнулись на карбоновые кислоты (либо хлорированная карбоновая кислота, либо фторированная карборановая кислота), когда искали «самые сильные кислоты в мире». Ну, технически они верны, так как карбоновые кислоты являются самыми сильными известными однокомпонентными кислотами на Земле, гораздо более кислыми, чем подобные хлорной и трифликовой кислотам (фтороантимоновая кислота на самом деле является смешанной кислотой).