какая кислота называлась муриевой
Мурий
Му́рий (лат. murium от лат. mare — «море», через лат. muria — «морская вода, раствор соли, рассол») — несуществующий химический элемент. Гипотеза о существовании оксида мурия в конце XVIII века предшествовала открытию хлора.
Содержание
История
Гипотеза о существовании мурия
В 1772 году Джозефом Пристли действием серной кислоты на морскую соль был впервые получен газообразный хлороводород. По источнику происхождения новое вещество по предложению Лавуазье получило название муриевая кислота (acidum muriaticum), то есть «морская» или «соляная кислота».
В 1774 г. шведский химик Карл Вильгельм Шееле описал выделение неизвестного желто-зеленого газа при взаимодействии чёрной магнезии (magnesia nigra) с раствором муриевой кислоты:
Шееле отметил запах выделяющегося газа, схожий с запахом царской водки, его способность взаимодействовать с золотом и киноварью, а также его отбеливающие свойства. Шееле, в соответствии с господствовавшей в химии того времени теории флогистона, предположил, что чёрная магнезия забирает флогистон из муриевой кислоты, а выделяющийся газ получил название дефлогистированной соляной кислоты (Dephlogistierte Salzsaure, Acide marin déphlogistiqué).
В то же время Лавуазье предложил новую, антифлогистическую теорию кислот, согласно которой кислотные свойства вещества обусловлены входящим в их состав кислородом. Это ошибочное мнение поддержал К.-Л. Бертолле, который в 1785 году установил образование муриевой кислоты и кислорода на свету в водном растворе газа Шееле:
Бертолле предположил, что выделенный Шееле газ является оксидом неизвестного элемента, назвал его оксигенированной (то есть окисленной) муриевой или же оксимуриевой кислотой (Acide muriatique oxygene). Лавуазье включил особый муриевый радикал (radical muriatique) в новую классификацию элементов среди простых неметаллических тел, окисляющихся и образующих кислоты. Новый, ещё не полученный элемент был назван мурием (Murium, реже Muriaticum).
Таким образом, по мнению Бертолле и Лавуазье, оксигенированная муриевая кислота должна была представлять собой сложное вещество, в составе которого содержится элемент мурий в более окисленном состоянии по сравнению с мурием в соляной кислоте. Эта гипотеза, благодаря авторитету Лавуазье, вскоре сделалась общепринятой и просуществовала три десятилетия.
«Закрытие» мурия
В конце XVIII — начале XIX в. многие ученые стремились получить мурий в свободном состоянии с тем, чтобы определить его степень окисления в различных соединениях. В 1809 году Ж. Гей-Люссак и Л. Тенар предприняли безуспешную попытку выделить мурий в виде простого вещества, пропуская оксигенированную муриевую кислоту (то есть хлор) над углём в раскаленной фарфоровой трубке. Однако оба они были настолько сильными приверженцами идей Лавуазье, что посчитали результаты эксперимента скорее ошибочными, чем пригодными для создания новой концепции. В статье «О природе и свойствах муриевой и оксигенированной муриевой кислот» (1809) [2] они отмечали, что вопрос о наличии кислорода в составе оксигенированной муриевой кислоты остаётся открытым:
В то время существовали определенные экспериментальные трудности для доказательства элементарной природы хлора. Реакции хлора и его соединений, помимо этого, в большинстве случаев настолько хорошо объяснялись теорией мурия, что даже после работ Гей-Люссака и Дэви, Й.-Я. Берцелиус придерживался в 1815 году точки зрения на «муриевую» природу хлора. Мурий как элемент имел свой символ в виде латинской буквы M, соли хлора именовались муриатами. Окончательно мурий был исключен из числа химических элементов только к 1840-х годам, когда были открыты бром, иод и изучены бескислородные кислоты (синильная, плавиковая, роданистоводородная и др.). Но даже в 1865 году К. Шёнбейн ещё придерживался точки зрения о существовании мурия.
Мурий
Му́рий (лат. murium от лат. muria — «раствор соли, рассол») — несуществующий химический элемент. Гипотеза о существовании оксида мурия в конце XVIII века предшествовала открытию хлора.
Содержание
История
Гипотеза о существовании мурия
В 1772 году Джозефом Пристли действием серной кислоты на морскую соль был впервые получен газообразный хлороводород. По источнику происхождения новое вещество по предложению Лавуазье получило название муриевая кислота (acidum muriaticum), то есть «соляная кислота».
В 1774 г. шведский химик Карл Вильгельм Шееле описал выделение неизвестного желто-зеленого газа при взаимодействии чёрной магнезии (magnesia nigra) с раствором муриевой кислоты:
Шееле отметил запах выделяющегося газа, схожий с запахом царской водки, его способность взаимодействовать с золотом и киноварью, а также его отбеливающие свойства. Шееле, в соответствии с господствовавшей в химии того времени теории флогистона, предположил, что чёрная магнезия забирает флогистон из муриевой кислоты, а выделяющийся газ получил название дефлогистированной соляной кислоты (Dephlogistierte Salzsaure, Acide marin déphlogistiqué).
В то же время Лавуазье предложил новую, антифлогистическую теорию кислот, согласно которой кислотные свойства вещества обусловлены входящим в их состав кислородом. Это ошибочное мнение поддержал К.-Л. Бертолле, который в 1785 году установил образование муриевой кислоты и кислорода на свету в водном растворе газа Шееле:
Бертолле предположил, что выделенный Шееле газ является оксидом неизвестного элемента, назвал его оксигенированной (то есть окисленной) муриевой или же оксимуриевой кислотой (Acide muriatique oxygene). Лавуазье включил особый муриевый радикал (radical muriatique) в новую классификацию элементов среди простых неметаллических тел, окисляющихся и образующих кислоты. Новый, ещё не полученный элемент был назван мурием (Murium, реже Muriaticum).
Таким образом, по мнению Бертолле и Лавуазье, оксигенированная муриевая кислота должна была представлять собой сложное вещество, в составе которого содержится элемент мурий в более окисленном состоянии по сравнению с мурием в соляной кислоте. Эта гипотеза, благодаря авторитету Лавуазье, вскоре сделалась общепринятой и просуществовала три десятилетия.
«Закрытие» мурия
В конце XVIII — начале XIX в. многие ученые стремились получить мурий в свободном состоянии с тем, чтобы определить его степень окисления в различных соединениях. В 1809 году Ж. Гей-Люссак и Л. Тенар предприняли безуспешную попытку выделить мурий в виде простого вещества, пропуская оксигенированную муриевую кислоту (то есть хлор) над углём в раскаленной фарфоровой трубке. Однако оба они были настолько сильными приверженцами идей Лавуазье, что посчитали результаты эксперимента скорее ошибочными, чем пригодными для создания новой концепции. В статье «О природе и свойствах муриевой и оксигенированной муриевой кислот» (1809) [2] они отмечали, что вопрос о наличии кислорода в составе оксигенированной муриевой кислоты остаётся открытым:
— Ж. Гей-Люссак, Л. Тенар; перевод [elements.vanderkrogt.net/element.php?sym=Cl по цит.]
В то время существовали определенные экспериментальные трудности для доказательства элементарной природы хлора. Реакции хлора и его соединений, помимо этого, в большинстве случаев настолько хорошо объяснялись теорией мурия, что даже после работ Гей-Люссака и Дэви, Й.-Я. Берцелиус придерживался в 1815 году точки зрения на «муриевую» природу хлора. Мурий как элемент имел свой символ в виде латинской буквы M, соли хлора именовались муриатами. Окончательно мурий был исключен из числа химических элементов только к 1840-х годам, когда были открыты бром, иод и изучены бескислородные кислоты (синильная, плавиковая, роданистоводородная и др.). Но даже в 1865 году К. Шёнбейн ещё придерживался точки зрения о существовании мурия.
Какая кислота называлась муриевой
Слово «фтор» закрепилось в русском языке. Однако в западноевропейских языках утвердилось другое название этого элемента: fluorine в английском, fluor во французском и нидерландском, Fluor в немецком, flúor в испанском, fluoro в итальянском. Они происходят от названия минерала флюорита (плавикового шпата CaF2). В свою очередь, название этого минерала связано с лат. fluo – «течь», fluxus – «текучий, жидкий»: флюорит применяется в качестве флюса в металлургии. Немецкий врач и химик Андреас Либавий (ок. 1550–1616) в конце XVI века использовал для этого минерала название fluor mineralis. От корня fluo в русском языке произошли, помимо «флюса», такие термины, как «флюид», «флюорография», «флюороз», «флуоресценция» (иногда пишут «флюоресценция»). Последний термин также связан с минералом флюоритом, который ярко светится под действием ультрафиолета. Кстати, по‑украински «фтор» – Флуор! (По современной украинской химической номенклатуре названия элементов, в отличие от простых веществ, принято, как и на латыни, писать с прописной буквы.)
Хлор. По-гречески chloros – «желто-зеленый», именно такой цвет имеет этот газ. Тот же корень – в слове «хлорофилл» (от греч. chloros и phyllon – «лист»). Современное название этого газа придумал Г. Дэви, а до него хлор считался оксидом неизвестного элемента «мурия» (от лат. muria – «рассол»); соляная кислота называлась «муриевой». Изобретенный Дэви термин (chlorine) остался в английском языке, тогда как французский химик и физик Жозеф Луи Гей-Люссак (1779–1850) сократил его до chlore. В таком виде название и попало в другие языки, в том числе в русский. Неграмотные переводчики с английского иногда называют хлор «хлорином», хотя в русской химической терминологии хлорин – это либо частично гидрированный порфирин, либо поливинилхлоридное волокно (из него делают лечебное белье, легко электризующееся при трении).
Бром. По-гречески bromos – «зловонный». Удушающий запах брома похож на запах хлора. Бром – единственный неметаллический элемент, жидкий при обычных условиях. Предложение назвать его муридом (бром выделяли из содержащих этот элемент природных рассолов действием хлора) было отвергнуто, поскольку муриевой кислотой тогда называлась соляная (см. Хлор), а муриатами – ее соли (хлориды). Интересно, что первооткрывателем брома считается французский химик Антуан Жером Балар (1802–1876) – хотя студент Гейдельбергского университета Карл Левиг получил бром раньше, он не успел опубликовать сообщение о его свойствах. Бром был в руках и у знаменитого Юстуса Либиха, но он принял эту жидкость за известный хлорид иода ICl. В чистом виде хлорид иода – темно-красное твердое вещество, которое плавится при 27,2 °C, а с примесями – жидкое уже при комнатной температуре. Узнав об открытии Балара, ставшего знаменитым, раздосадованный Либих воскликнул: «Это не Балар открыл бром, а бром открыл Балара!» По другой версии, это произнес известный французский химик Шарль Фредерик Жерар (1816–1856), после того как его коллеге и другу, не менее известному химику-органику Огюсту Лорану (1807–1853), который претендовал на кафедру химии в парижском Коллеж‑де-Франс, предпочли Балара.
Осмий. По-гречески osme – «запах». Хотя сам металл не пахнет, довольно противным запахом, похожим на смесь запахов хлора и чеснока, обладает тетраоксид осмия OsO4. А врожденное или приобретенное отсутствие обоняния называется аносмией.
Иод. По-гречески ioeides – «фиолетовый». Такой цвет имеют пары этого элемента, а также его растворы в инертных растворителях (алканы, четыреххлористый углерод и др.). Следует пояснить разное написание этого элемента: «иод» и «йод». По-русски в химических текстах принято писать иод (символ элемента I), тогда как в медицинских и прочих текстах остается традиционное «немецкое» написание – «йод». Символ элемента I появился у нас сравнительно недавно. Так, в «Курсе общей химии» Б. В. Некрасова, опубликованном в 1962 году, читаем: «Латинское название Jodum, химический знак J». В тексте, в таблицах и в химических формулах используется символ элемента J, но одновременно везде написано только «иод». В последующих изданиях этого учебника (как и во всех остальных отечественных книгах по химии) символ J заменен на I. В опубликованной в 1924 году книге В. Герца «Очерк истории развития основных воззрений химии» написано «иод», «иодиды». Такое же правописание принято в «Курсе неорганической химии» Г. Реми издания 1963 года. Только, в отличие от учебника Некрасова, символ элемента I, а не J. В чем тут дело? История достаточно интересная, чтобы рассказать о ней подробнее.
Муравьиная кислота
| Муравьиная кислота | |
 | |
 | |
| Общие | |
|---|---|
| Систематическое наименование | Метановая кислота |
| Традиционные названия | Муравьиная кислота |
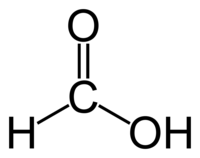
| Химическая формула | HCOOH |
| Эмпирическая формула | CH2O2 |
| Физические свойства | |
| Состояние (ст. усл.) | жидкость |
| Молярная масса | 46,025380 г/моль |
| Плотность | 1,2196 г/см³ |
| Динамическая вязкость (ст. усл.) | 0,16 Па·с (при 20 °C) |
| Термические свойства | |
| Температура плавления | 8,25 °C |
| Температура кипения | 100,7 °C |
| Температура вспышки | 60 °C |
| Температура самовоспламенения | 520 °C |
| Тройная точка | 281,40 K (8,25 °C), 2,2 кПа |
| Критическая точка | 588 K (315 °C), 5,81 МПа |
| Молярная теплоёмкость (ст. усл.) | 98,74 Дж/(моль·К) |
| Энтальпия образования (ст. усл.) | −409,19 кДж/моль |
| Давление пара | 120 мм. рт. ст. (16 кПа) при 50 °C |
| Химические свойства | |
| pKa | 3,75 |
| Оптические свойства | |
| Показатель преломления | 1,3714 |
| Структура | |
| Дипольный момент | 1,41 (газ) Д |
| Классификация | |
| Рег. номер CAS | 64-18-6 |
| SMILES | O=CO |
| Регистрационный номер EC | 200-579-1 |
| RTECS | LQ4900000 |
Муравьиная кислота (систематическое наименование: метановая кислота) — первый представитель в ряду насыщенных одноосновных карбоновых кислот. Зарегистрирована в качестве пищевой добавки под обозначением E236.
Содержание
Физические и термодинамические свойства
При нормальных условиях муравьиная кислота представляет собой бесцветную жидкость. Растворима в ацетоне, бензоле, глицерине, толуоле. Смешивается с водой, диэтиловым эфиром, этанолом.
Получение
Безопасность
Опасность муравьиной кислоты зависит от концентрации. Согласно классификации Европейского союза, концентрация до 10 % обладает раздражающим эффектом, больше 10 % — разъедающим.
При контакте с кожей 100%-ная жидкая муравьиная кислота вызывает сильные химические ожоги. Попадание даже небольшого её количества на кожу причиняет сильную боль, поражённый участок сначала белеет, как бы покрываясь инеем, потом становится похожим на воск, вокруг него появляется красная кайма. Кислота легко проникает через жировой слой кожи, поэтому промывание поражённого участка раствором соды необходимо произвести немедленно. Контакт с концентрированными парами муравьиной кислоты может привести к повреждению глаз и дыхательных путей. Случайное попадание внутрь даже разбавленных растворов вызывает явления тяжелого некротического гастроэнтерита.
Муравьиная кислота быстро перерабатывается и выводится организмом. Тем не менее, муравьиная кислота и формальдегид, образующиеся при отравлении метанолом, вызывают повреждение зрительного нерва и ведут к слепоте.
Химические свойства
Муравьиная кислота, кроме кислотных свойств, проявляет также некоторые свойства альдегидов, в частности, восстановительные. При этом она окисляется до углекислого газа. Например:
При нагревании с сильными водоотнимающими средствами (H2SO4 (конц.) или P4O10) разлагается на воду и моноксид углерода:
Нахождение в природе
В больших количествах муравьиная кислота образуется в качестве побочного продукта при жидкофазном окислении бутана и лёгкой бензиновой фракции в производстве уксусной кислоты. Муравьиную кислоту получают также гидролизом формамида (
35 % от общего мирового производства); процесс состоит из нескольких стадий: карбонилирование метанола, взаимодействие метилформиата с безводным NH3 и последующий гидролиз образовавшегося формамида 75%-ной H2SO4. Иногда используют прямой гидролиз метилформиата (реакцию проводят в избытке воды или в присутствии третичного амина), гидратацию СО в присутствии щёлочи (кислоту выделяют из соли действием H2SO4), дегидрогенизацию СН3ОН в паровой фазе в присутствии катализаторов, содержащих Cu, а также Zr, Zn, Cr, Mn, Mg и др. (метод не имеет промышленного значения).
Применение
В лабораториях используют разложение жидкой муравьиной кислоты под действием горячей концентрированной серной кислоты, либо пропуская муравьиную кислоту над оксидом фосфора P2O5, для получения монооксида углерода. Схема реакции:
Производные муравьиной кислоты
Соли и эфиры муравьиной кислоты называют формиатами. Важнейшим производным муравьиной кислоты является формальдегид (метаналь, муравьиный альдегид).
ОТКРЫТИЕ
соляной кислоты и хлора
С соляной кислотой мы, сами того не зная, сталкиваемся ежедневно. Соляная кислота, выделяющаяся в желудке, используется для процесса пищеварения. Под ее воздействием большинство бактерий, попавших в желудок с пищей, быстро погибает. При пониженной кислотности желудочного сока необходимо лечение.
Трудно сказать, кто и когда впервые получил соляную кислоту. Во всяком случае, нам известно, что уже в конце XV в. алхимик Василий Валентин и в XVI в. Андреас Либавий в усердных поисках чудодейственного жизненного эликсира прокаливали в своих странных для нас алхимических приборах поваренную соль с квасцами и купоросами и получили продукт, который описали под названием «кислого спирта». Это и была знакомая теперь нам соляная кислота, конечно, очень нечистая.
Для первых исследователей это было совершенно новое вещество, обладавшее свойствами, которые сильно поражали их воображение. Нюхая его, они задыхались и кашляли, «кислый спирт» дымил в воздухе. При пробовании на вкус, он обжигал язык и нёбо, металлы он разъедал, ткани разрушал.
В 1658 г. немецкий химик И.Р.Глаубер (1604–1670) нашел новый способ получения соляной кислоты, которую он назвал «соляным спиртом». Способ этот широко применяется до сих пор в лабораториях. Он нагревал поваренную соль с концентрированной серной кислотой и выделявшийся «дым» поглощал водой.
В 1772 г. английский химик Дж.Пристли (1733–1804) установил, что при действии серной кислоты на поваренную соль выделяется бесцветный газ, который может быть собран над ртутью, и что этот газ обладает чрезвычайно большой способностью растворяться в воде. Водный раствор этого газа получил название «соляной кислоты» (acidum muriaticum), а сам газ Пристли назвал «чистой газообразной соляной кислотой».
В 1774 г. шведский химик К.В.Шееле (1742–1786), исследуя действие соляной кислоты (которую он называл еще «соляным спиртом») на оксид марганца(IV), нашел, что он растворяется в соляной кислоте на холоде, образуя темно-коричневый раствор, из которого при нагревании выделяется газ желто-зеленого цвета, обладающий очень резким запахом, способностью разрушать растительные краски и действующий на все металлы, не исключая золота. Шееле, как последователь господствовавшей в то время флогистонной теории, считал, что смысл этой реакции заключается в том, что под действием оксида марганца(IV) из соляной кислоты уходит содержащийся в ней флогистон, благодаря чему соляная кислота превращается в желто-зеленый газ. Поэтому сам газ он назвал «дефлогистированной (т.е. лишенной флогистона. – П.К.) соляной кислотой».
Открытие «дефлогистированной соляной кислоты» произошло в то время, когда пробил последний час господства ложных представлений о существовании флогистона. Французский химик А.Л.Лавуазье (1743–1794) правильно понял и сумел убедительно доказать роль открытого уже ранее Пристли кислорода в процессах окисления, горения, ржавления и т.п.
Лавуазье считал, что всякая кислота представляет собой оксид неметалла и что, следовательно, необходимой составной частью всякой кислоты является кислород. Само название элемента уже отражало этот взгляд. Таким образом, серной кислотой Лавуазье и его современники называли то вещество, которое теперь нам известно как оксид серы(VI) (SO3).
Однако при попытках объяснить все известные тогда факты указанным образом вскоре стали возникать затруднения. Прежде всего бросалось в глаза, что если кислоты представляют собой вещества, непременной составной частью которых наряду с неметаллом является только кислород, то непонятно, почему при действии металлов из кислот обыкновенно выделяется водород. Этому было придумано такое объяснение. «Кислоты» (по-современному, кислотные оксиды) всегда удерживают около себя некоторое количество воды, подобно тому, как, например, соли серной кислоты в купоросах удерживают около себя кристаллизационную воду. При взаимодействии металла с «кислотой» эта вода подвергается быстрому разложению, ее водород выделяется, а кислород, соединяясь с металлом, образует его оксид, который сейчас же присоединяет к себе «кислоту» (т.е. оксид неметалла). В результате такой реакции образуется соль.
Не менее остроумно было построено и предположение относительно состава соляной кислоты, которая, как было уже в то время известно, не получается путем соединения какого-нибудь из известных неметаллов с кислородом. Суть тогдашних рассуждений сводилась к следующему. Соляная кислота, как и все остальные кислоты, должна представлять собой соединение кислорода с каким-то еще неизвестным элементом. Этот предполагаемый элемент, соединенный с кислородом и безводной соляной кислотой, был назван мурием по названию соляной кислоты (acidum muriaticum). Безводная соляная кислота, по тогдашним представлениям, – это оксид мурия.
Что же представлял собой с этой точки зрения желто-зеленый газ, об открытии которого мы говорили раньше? Его изучением в течение ряда лет усиленно занимались наиболее блестящие ученые того времени. К.Л.Бертолле (1748–1822), Ж.Л.Гей-Люссак (1778–1850), Л.Ж.Тенар (1777–1857), Г.Дэви (1778–1829), «организатор химии» шведский ученый Й.Я.Берцелиус (1779–1848) и многие другие потратили немало времени и настойчивости на то, чтобы разгадать загадку этого таинственного газа. Поскольку этот газ (его мы теперь называем хлором) может быть получен путем окисления соляной кислоты, то было вначале выдвинуто предположение, что он представляет собой соединение оксида мурия с кислородом, т.е. дальнейшую ступень окисления мурия. Поэтому Бертолле предложил назвать этот газ окисленной соляной (муриевой), или оксимуриевой, кислотой.




 – желто-зеленый).
– желто-зеленый). – соль и
– соль и  – рождающий), т.е. образующим соли – солеродом, а хлористые металлы – галоидами, т.е. похожими на соль. В русской научной литературе хлор долгое время называли солетвором, а в 1820 г. впервые появилось название «хлор».
– рождающий), т.е. образующим соли – солеродом, а хлористые металлы – галоидами, т.е. похожими на соль. В русской научной литературе хлор долгое время называли солетвором, а в 1820 г. впервые появилось название «хлор».