какая кислота нерастворима в воде
Уроки по неорганической химии для подготовки к ЕГЭ
Свойства простых веществ:
Свойства сложных веществ:
Особенности протекания реакций:
Химические свойства кислот
1. Сила кислот уменьшается в ряду:
Некоторые реакции, подтверждающие ряд кислот:
Во всех этих реакциях образуются либо осадок, либо (более) слабая кислота.
Если осадка не образуется и обе кислоты сильные (т.е. кислота, которая вступила в реакцию, и кислота, которая образовалась в результате реакции), то в растворе такие реакции не идут. Подобные реакции возможны только в случае образования сильных летучих кислот (HNO3 и HCl) в реакциях с твердыми солями, а не растворами:
Аналогичным образом можно получить и слабую плавиковую кислоту:
HBr и HI (они также являются летучими) таким образом получать не удается, так как они окисляются концентрированной серной кислотой:
2. Летучесть кислот
Следующие кислоты являются летучими: HNO3, HF, HCl, HBr, HI, H2S, H2Se.
Остальные кислоты являются нелетучими.
3. Сила кислот (способность к диссоциации)
4. Растворимость кислот в воде
Нерастворимыми кислотами являются: H2SiO3 и все высшие жирные кислоты, т.е. кислоты, содержащие 10 атомов углерода и больше. Например, C17H35COOH (стеариновая кислота).
5. Термическое разложение кислот
При нагревании разлагаются следующие кислоты:
6. Взаимодействие с основаниями (реакция нейтрализации)
Эти реакции идут, только если образующаяся соль существует в водном растворе, т.е. в таблице растворимости не должен стоять прочерк:
H2S + Al(OH)3 → реакция не идет, т.к. Al2S3 в водной среде разлагается (по сути, идет обратная реакция)
H2S + Cr(OH)3 → реакция не идет по той же причине.
Особенность кремниевой кислоты: из оснований она реагирует только с щелочами:
7. Взаимодействие с солями
Реакции с солями идут, если выделяется газ, выпадает осадок или образуется более слабая кислота:
8. Взаимодействие кислот-неокислителей с металлами
Металлы, стоящие в ряду активности металлов до водорода, взаимодействуют с кислотами-неокислителями с выделением водорода:
Виды кислот и способы их получения
В химии неорганические соединения делятся на простые и сложные вещества. Простые состоят из атомов одного химического элемента, сложные — из нескольких. Сложные неорганические вещества делятся на пять основных классов: кислоты, основания, амфотерные гидроксиды, оксиды, соли.
Разберёмся с первым классом из списка — кислотами.
Что такое кислота — определение в химии
Кислоты — это сложные вещества, которые состоят из атомов водорода и кислотных остатков.
A c — кислотный остаток;
x — число атомов водорода;
n — степень окисления кислотного остатка.
В химических реакциях активный атом водорода может замещаться на атом металла, в результате чего получается соль. Кислотный остаток — это часть молекулы кислоты без атомов водорода. Валентность кислотного остатка равна числу связанных с ним атомов водорода.
Виды кислот и их классификация, какие бывают (примеры)
Существуют несколько классификаций кислот. Разберёмся с основной классификацией, созданной по формальным признакам: содержанию кислорода, растворимости и так далее.
По содержанию кислорода
Кислоты могут делиться на кислородосодержащие и бескислородные.
Кислородсодержащие получаются при воздействии воды на кислотные оксиды — ангидриды.
Их название в корне содержит название элемента, входящего в состав ангидрида. Примеры:
Номенклатура выглядит следующим образом. В случае, если элементу соответствуют несколько кислот, для названия кислоты с большей валентностью такого элемента употребляют суффикс «Н» или «В». Для кислот с меньшей валентностью элемента в названиях добавляют еще один суффикс «ИСТ». Например, серная ( H 2 S O 4 ) и сернистая кислота ( H 2 S O 3 ).
Бескислородные представляют собой растворы некоторых газов в воде. Названия бескислородных кислот составляют по принципу: элемент + водородная кислота.
Важно, что газ и раствор газа имеют различные свойства. Например, хлороводород и соляная кислота.
Газ хлороводород можно получить из водорода и хлора. Уравнение:
H 2 + C l 2 → 2 H C l
В сухом состоянии такой газ не проявляет кислотных свойств. При перевозке в тех же металлических ёмкостях не происходит никаких реакций. Но, если хлороводород растворить в воде, получается раствор, который называют соляной кислотой. Она обладает сильными кислотными свойствами и опасна при реагировании с металлом.
По растворимости в воде
Кислоты делят на растворимые и нерастворимые. Большинство кислот растворимы. Нерастворимые — кремниевая H 2 S i O 3 и все органические карбоновые кислоты, содержащие десять атомов углерода и больше.
По летучести
Летучие кислоты — это химические соединения, которые быстро испаряются при нормальных условиях, то есть молекулы легко переходят в газовую фазу. В их список входят, к примеру, органические соединения, которые образуются в человеческом организме в результате процесса пищеварения, болезней или метаболизма.
Список летучих кислот:
Нелетучими являются все остальные. Они стабильны в водных растворах.
По силе (степени диссоциации)
Кислоты также можно разделить на сильные и слабые. Если в водном растворе кислота полностью распадается на ионы (диссоциирует), то она является сильной. Слабые кислоты не распадаются на ионы полностью, обычно их диссоциация протекает в незначительной степени.
Как определить силу кислоты, то есть степень диссоциации? Можно использовать лёгкий приём: вычесть из числа атомов O число атомов H. Если в ответе получается число меньше 2 — слабая. Больше или равно — сильная.
Степень диссициации можно также установить экспериментальным путем посредством измерения проводимости растворов. Разбавленные растворы сильных кислот хорошо проводят электрический ток, растворы слабых кислот — плохо.
Характерные химические и физические свойства
Химические свойства
Взаимодействие с основными оксидами. Образуются соль и вода:
C a O + 2 H C l → C a C l 2 + H 2 O
Взаимодействие с амфотерными оксидами. Образуются соль и вода:
Z n O + 2 H N O 3 → Z n ( N O 3 ) 2 + H 2 O
Взаимодействие со щелочами. Образуются соль и вода (реакция нейтрализации):
N a O H + H C l → N a C l + H 2 O
Взаимодействие с солями. Реакция протекает, если выпадает осадок или выделяется газ:
B a C l 2 + H 2 S O 4 → B a S O 4 ↓ + H C l ↑
Сильные кислоты вытесняют более слабые из их солей:
K 3 P O 4 + 3 H C l → 3 K C l + H 3 P O 4
Также металлы, стоящие в ряду активности до водорода, вытесняют его из раствора кислоты (если соль, которая образуется в итоге, растворима):
M g + 2 H C l → M g C l 2 + H 2 ↑
Однако! С азотной и концентрированной серной кислотами реакция идёт иначе:
M g + 2 H 2 S O 4 → M g S O 4 + S O 2 ↑ + 2 H 2
Физические свойства
Получение и применение кислот
Кислоты можно получить несколькими методами.
Взаимодействие кислотного оксида с водой:
H 2 O + S O 3 → H 2 S O 4
Взаимодействие водорода и неметалла:
H 2 + C l 2 → 2 H C l
Вытеснение слабой кислоты из солей более сильной кислотой:
3 H 2 S O 4 + 2 K 3 P O 4 → 3 K 2 S O 4 + H 3 P O 4
Кислоты находят широкое применение в различных сферах. К примеру, серная используется для производства лакокрасочных материалов и минеральных удобрений. Борная является медицинским антисептиком. Уксусную и лимонную добавляют при приготовлении выпечки, а аскорбиновую применяют при лечении простудных заболеваний.
Характерные химические свойства кислот
Содержание:
Кислоты – это химические соединения, содержащие в себе положительный атом водорода (катион H+) и кислотный остаток (анион A-). Является сложным веществом.
Общая характеристика
В первую очередь кислоты различают по растворимости. Есть нерастворимые, растворимые и полурастворимые кислоты. Эти различия прописаны в таблице растворимости, так что наизусть запоминать не требуется.
Классификация:
Бескислородные кислоты – это растворы галогеноводородов, атомы которых в растворе связаны полярной ковалентной связью. Название кислоты складывается из названия кислотного остатка в первую очередь, а дальше называется катион (водород). Так с хлором и водородом образуется хлороводородная кислота, а с серой – сероводородная.
Кислородосодержащие кислоты, или оксокислоты называют за счёт наличия в них кислорода. Общего принципа построения названия этих кислот нет, так что их названия необходимо запоминать на память.
Физические свойства
Кислоты, в зависимости от условий, могут быть в трёх агрегатных состояниях: в жидком, твёрдом и газообразном состоянии. Кислоты могут обладать цветом и запахом.
Химические свойства
Изменение цвета индикаторов
Кислота в водной среде способна изменить цвет разных индикаторов. Кислоты окрашивают в красных цвет лакмус, метилоранж и универсальный индикатор. Фенолфталеин не окрашивается.
Взаимодействие кислот с металлами
Кислота способна реагировать только с металлами, находящимися левее водорода в ряду активности металлов.
Из приведенного выше химического уравнения нужно отметить, что при взаимодействии кислоты и металла происходит реакция замещения, образуется соль и выделяется H2.
Взаимодействие кислот с основными и амфотерными оксидами
При взаимодействии кислоты с основным или амфотерным оксидами происходит реакция обмена в результате которой образуются соль и H2O.
В качестве примера приведены следующие реакции:
Из приведённого выше химического уравнения нужно отметить, что в реакциях основного оксида калия и амфотерного оксида алюминия (III) с кислотами, образуется соль и H2O.
Взаимодействие кислот с основными и амфотерными гидроксидами
Из приведённой выше химического уравнения нужно отметить, что при реакции основного гидроксида калия и амфотерного гидроксида алюминия (III) с кислотами образуются соль и H2O.
Взаимодействие кислот с солями
Реакция кислоты с солью является реакцией обмена, так же ее называют реакцией нейтрализации. Она возможно только в случае выпадения соли в осадок, выделения газа, слабые электролиты или вода. Рассмотрим все случаи более подробно.
Из приведённого выше химического уравнения можно увидеть, что при взаимодействии кислоты и соли образуются новые кислота и нерастворимая соль, которые выпадают в осадок. Осадок может иметь различную окраску, плотность и консистенцию.
Из приведённых выше химических уравнений нужно отметить, что при реакции соли с кислотой образуется новая соль и выделяется газ. Разберём одну из реакций: при взаимодействии твёрдого хлорида натрия с концентрированной хлороводородной кислотой образовалась натриевая соль серной кислоты и выделился летучий газ хлороводород.
Такие реакции возможны только при условии, когда одним из реагентов сильный электролит. Для того, чтобы убедиться, что реакция будет протекать используют вытеснительный ряд:
В этом ряду кислоты расположены так, что в растворах кислот и их солей могут в результате реакции вытесняют из раствора те, что стоят левее в ряду. Азотная и фосфорная кислоты находятся на одном месте в ряду, т.к. имеют одинаковые вытеснительные способности.
Из приведённого выше химического уравнения нужно отметить, что хлороводородная кислота, которая находится в данном ряду левее, способна вытеснять кислотный остаток карбоновой кислоты, стоящей в ряду правее. Нужно учитывать, что карбоновая кислота слабая и при стандартных условиях она распадется на углекислый газ и воду. Углекислый газ выделяется из раствора, а вода остаётся.
Разложение кислородсодержащих кислот
В результате реакции разложения кислородсодержащих кислот всегда образуется вода и оксид.
Из приведённых выше реакций можно увидеть, что карбоновая легко разлагается при обычных условиях, так как является одной из самых слабой кислотой. Для разложения сернистой и кремниевой кислоты их растворы необходимо нагреть. Во всех трёх реакция в результате образуется вода и оксиды кислотных остатков.
Гидролиз
Определение гидролиза
| Гидролиз — это процесс взаимодействия сложного химического вещества с водой, итогом которого становится разложение молекул этого вещества. Сам термин происходит от двух греческих слов: hydor, что значит «вода», и lysis, то есть «распад». |
Гидролизации подвержены как органические, так и неорганические вещества: углеводы, белки, оксиды, карбиды, соли и т. д. Например, гидролиз органических соединений напрямую связан с пищеварением — с его помощью происходит распад и усвоение клетками организма жиров, белков, углеводов. Но сейчас мы займемся неорганической химией и рассмотрим гидролизацию на примере солей.
| Гидролиз солей — это реакция взаимодействия ионов соли с Н + и ОН − ионами воды, которая ведет к распаду исходного соединения. В результате такого ионного обмена образуется слабый электролит — кислотный, щелочной или нейтральный. |
Условия гидролиза
Далеко не все соединения распадаются, вступая в реакцию с молекулами воды. Сейчас мы на примере солей рассмотрим, какие вещества подвергаются гидролизу, а какие нет, и от чего это зависит.
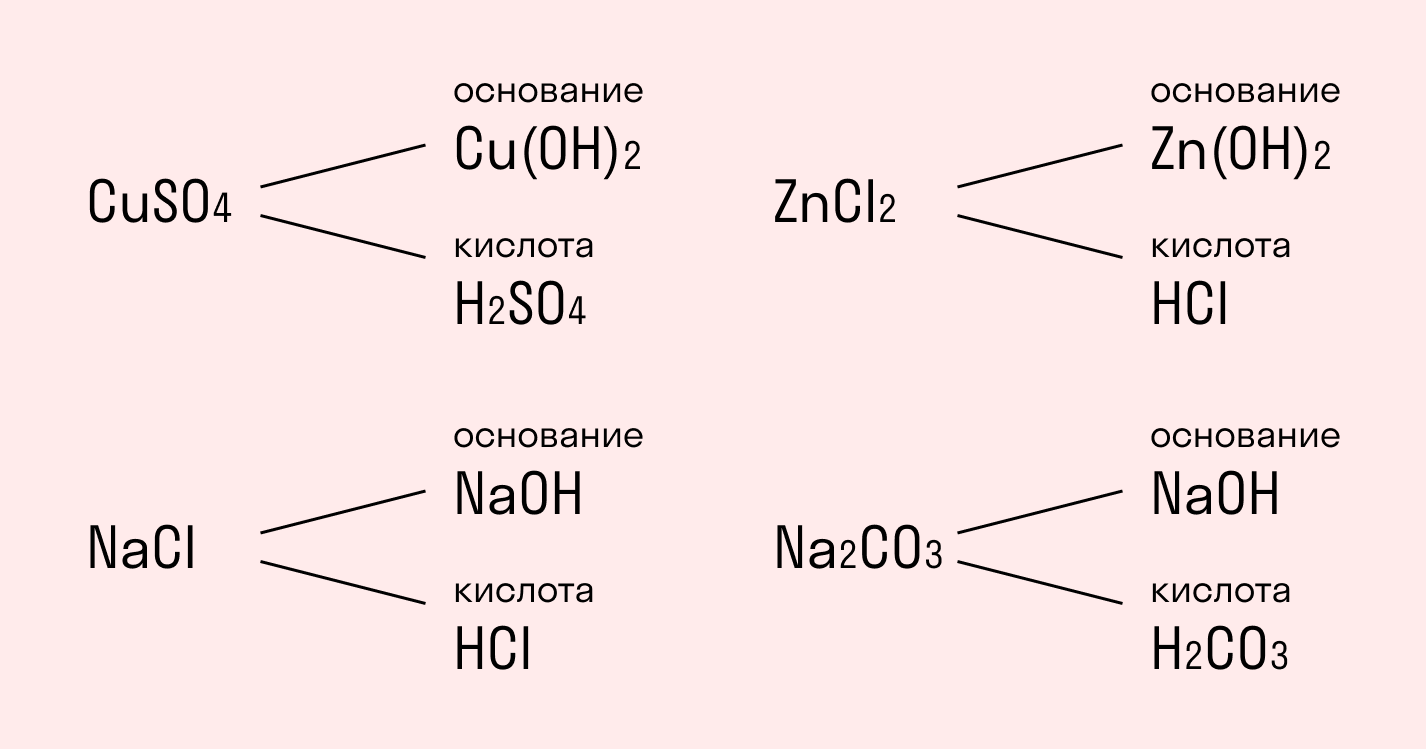
Начнем с того, что любая соль включает основание — амфотерный гидроксид, и кислотный остаток.
сульфат меди CuSO4состоит из основания Cu(ОН)2и кислоты H2SO4;
хлорид натрия NaCl состоит из основания NaOH и кислоты HCl;
хлорид цинка ZnCl2состоит из основания Zn(ОН)2 и кислоты HCI;
карбонат натрия Na2CO3состоит из основания NaOH и кислоты H2CO3.
В зависимости от того, какие соли подвергаются гидролизу — со слабым основанием или слабой кислотой, в итоге может получиться кислая, щелочная или нейтральная среда водного раствора.
А что происходит, если соль состоит из сильного основания и сильного кислотного остатка? Ничего. 🙂 В этом случае ее сильные катионы и анионы не взаимодействуют с ионами воды. Такая соль не распадается, то есть не подвержена гидролизу.
Схема химической реакции гидролиза выглядит так:
XY + HOH ↔ XH + HOY
XH — кислотный остаток;
Индикаторы среды раствора
Для определения среды раствора за считанные секунды используются специальные индикаторы. Самый распространенный из них — лакмусовая бумага, но также популярны фенолфталеин и метиловый оранжевый. В нейтральной среде они не меняют свой цвет, а в кислотной или щелочной — приобретают другую окраску.
Изменение цвета индикатора однозначно говорит о том, что произошла гидролизация. Однако если цвет остался тем же — это не всегда означает отсутствие гидролиза. Среда будет почти нейтральной и в том случае, когда гидролизу подвергается соль со слабым основанием и слабой кислотой. Но об этом поговорим дальше, а пока посмотрите таблицу.
Виды гидролиза
Мы выяснили, что в составе соли может быть слабый ион, который и отвечает за гидролизацию. Он находится в основании, в кислотном остатке или в обоих компонентах, и от этого зависит тип гидролиза.
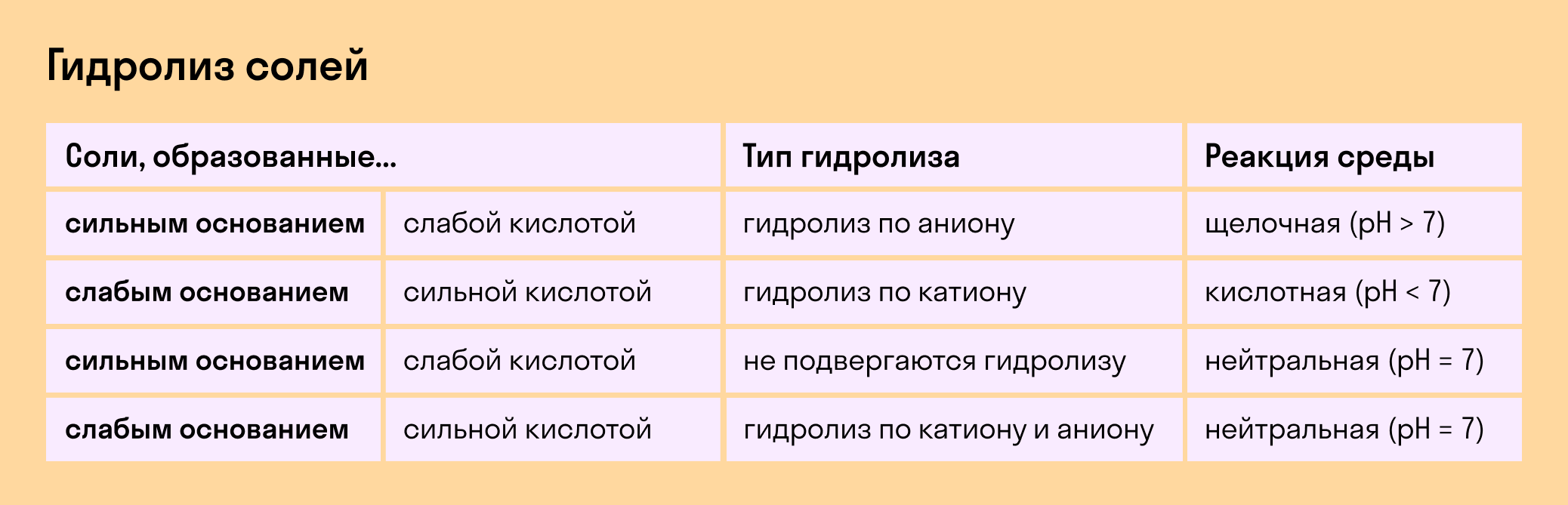
Соль с сильным основанием и сильной кислотой
Гидролиз отсутствует. Как вы уже знаете, при наличии сильного основания и сильного кислотного остатка соль не распадается при взаимодействии с водой. Так, например, невозможен гидролиз хлорида натрия (NaCl), поскольку в составе этого вещества нет слабых ионов. К таким же не подверженным гидролизации солям относят KClO4, Ba(NO3)2 и т. д.
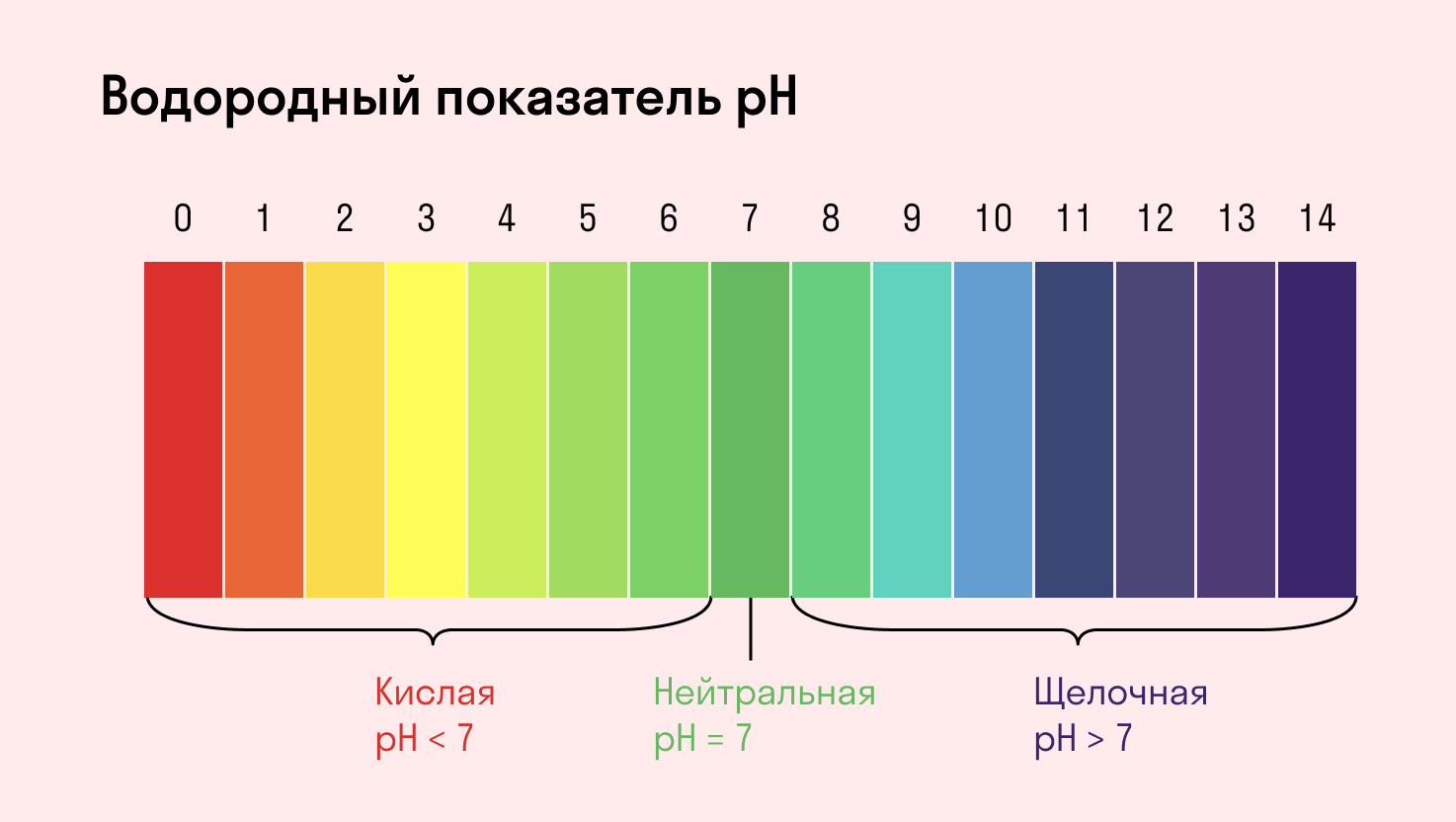
Среда водного раствора — нейтральная, т. е. pH = 7.
Реакция индикаторов: не меняют свой цвет (лакмус остается фиолетовым, а фенолфталеин — бесцветным).
Соль со слабым основанием и сильной кислотой
Среда водного раствора — кислая, pH меньше 7.
Реакция индикаторов: фенолфталеин остается бесцветным, лакмус и метиловый оранжевый — краснеют.
Соль с сильным основанием и слабой кислотой
Среда водного раствора — щелочная, pH больше 7.
Реакция индикаторов: фенолфталеин становится малиновым, лакмус — синим, а метиловый оранжевый желтеет.
Молекулярное уравнение: KNO2 + H2O ↔ HNO2 + KOH
Ионное уравнение: K + + NO2 − + HOH ↔ HNO2 + K + + OH −
Гидролиз по катиону и аниону. Если у соли оба компонента — слабые, при взаимодействии с водой в реакцию вступает и анион, и катион. При этом катион основания связывает ионы воды OH − а анион кислоты связывает ионы H +
Среда водного раствора: нейтральная, слабокислая или слабощелочная.
Реакция индикаторов: могут не изменить свой цвет.
Цианид аммония NH4CN включает слабое основание NH4OH и слабую кислоту HCN.
Молекулярное уравнение: NH4CN + H2O ↔ NH4OH + HCN
Ионное уравнение: NH4 + + CN − + HOH ↔ NH4OH + HCN
Среда в данном случае будет слабощелочной.
Обобщим все эти сведения в таблице гидролиза солей.
Ступенчатый гидролиз
Любой из видов гидролиза может проходить ступенчато. Так бывает в тех случаях, когда с водой взаимодействует соль с многозарядными катионами и анионами. Сколько ступеней будет включать процесс — зависит от числового заряда иона, отвечающего за гидролиз.
Как определить количество ступеней:
если соль содержит слабую многоосновную кислоту — число ступеней равняется основности этой кислоты;
если соль содержит слабое многокислотное основание — число ступеней определяют по кислотности основания.
Для примера рассмотрим гидролиз карбоната калия K2CO3. У нас есть двухосновная слабая кислота H2CO3, а значит, гидролизация пройдет по аниону в две ступени.
I ступень: K2CO3+HOH ↔ KOH+KHCO3, итогом которой стало получение гидроксида калия (KOH) и кислой соли (KHCO3).
II ступень: K2HCO3+HOH ↔ KOH+H2CO3, в итоге получился тот же гидроксид калия (KOH) и слабая угольная кислота (H2CO3).
Для приблизительных расчетов обычно принимают в учет только результаты первой ступени.
Обратимый и необратимый гидролиз
Химические вещества могут гидролизоваться обратимо или необратимо. В первом случае распадается лишь некоторое количество частиц, а во втором — практически все. Если соль полностью разлагается водой, это необратимый процесс, и его называют полным гидролизом.
Необратимо гидролизуются соли, в составе которых есть слабые нерастворимые основания и слабые и/или летучие кислоты. Такие соединения могут существовать лишь в сухом виде, их не получить путем смешивания водных растворов других солей.
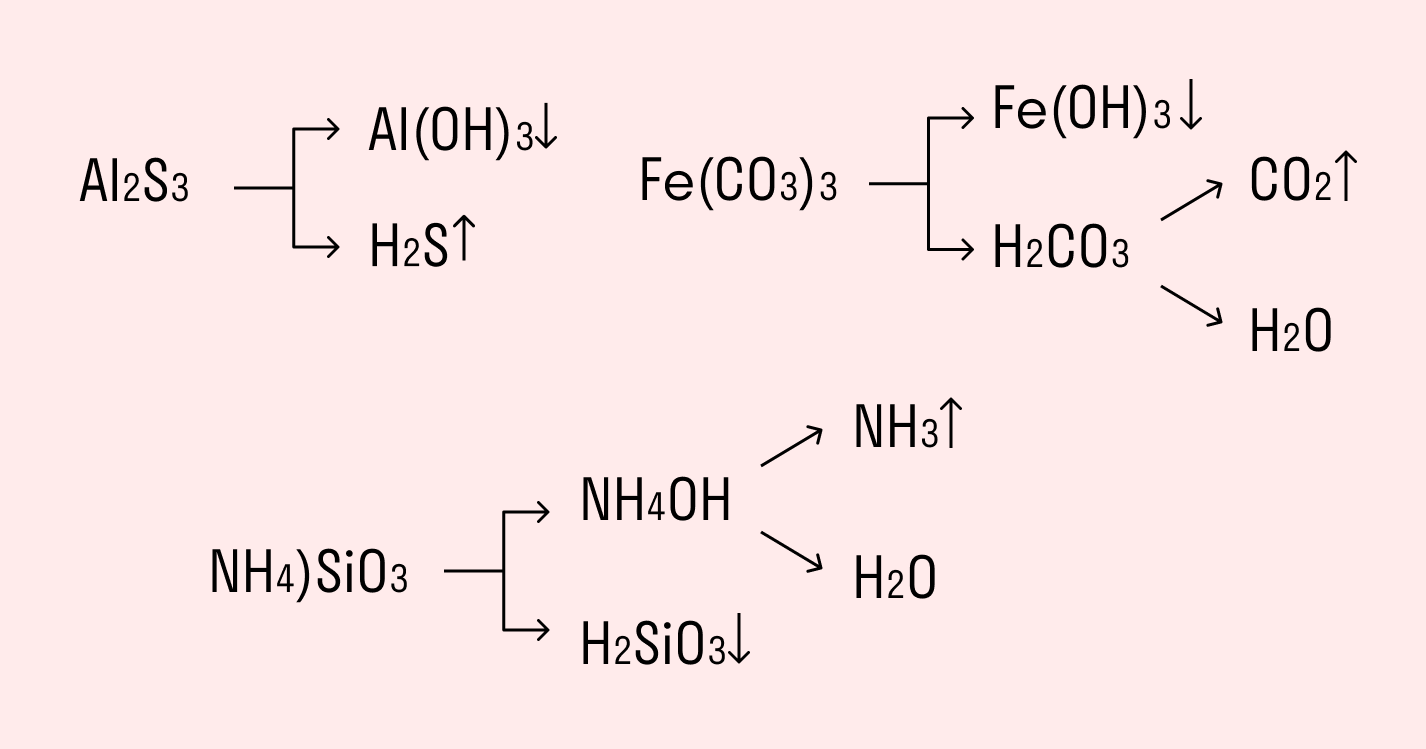
Например, полному гидролизу подвергается сульфид алюминия:
Как видите, в результате гидролизации образуется гидроксид алюминия и сероводород.
Необратимые реакции при взаимодействии с водой имеют место и в органической химии. В качестве примера рассмотрим полный гидролиз органического вещества — карбида кальция, в результате которого образуется ацетилен:
Степень гидролиза
Взаимодействие соли или другого химического соединения с водой может усиливаться или ослабляться в зависимости от нескольких факторов. Если нужно получить количественное выражение гидролиза, говорят о его степени, которая указывается в процентах.
h — степень гидролиза,
nгидр. — количество гидролизованного вещества,
nобщ. — общее количество растворенного в воде вещества.
На степень гидролизации может повлиять:
температура, при которой происходит процесс;
концентрация водного раствора;
состав участвующих в гидролизе веществ.
Можно усилить гидролиз с помощью воды (просто разбавить полученный раствор) или стимулировать процесс повышением температуры. Более сложным способом будет добавление в раствор такого вещества, которое могло бы связать один из продуктов гидролиза. К соли со слабой кислотой и сильным основанием нужно добавить соль со слабым основанием и сильной кислотой.
Для ослабления гидролиза раствор охлаждают и/или делают более концентрированным. Также можно изменить его состав: если гидролизация идет по катиону — добавляют кислоту, а если по аниону — щелочь.
Итак, мы разобрались, что такое гидролиз солей и каким он бывает. Пора проверить свои знания и ответить на вопросы по материалу.
Вопросы для самопроверки:
Назовите необходимое условие для гидролиза.
Какие типы гидролиза вы знаете?
В каком случае в результате гидролиза может образоваться слабощелочная или слабокислая среда?
По какому типу гидролизуется соль с сильным основанием и слабым кислотным остатком?
При гидролизе соли с сильным основанием и слабой кислотой для ослабления процесса нужно добавить в раствор кислоту или щелочь?
Как воздействует на гидролиз разбавление раствора водой?
Как определяется количество ступеней гидролиза?
Какая среда раствора образуется при гидролизации солей NaF, KCl, FeBr2, Na2PO4? Ответов может быть несколько.
Какие из солей гидролизуются по катиону: Csl, FeSO4, RbNO3, CuSO4, Mn(NO3)2? Ответов может быть несколько.
Какая из солей не подвергается гидролизу: K2HPO4, KNO3, KCN, Ni(NO3)2?
Самоучитель по химии
Пособие для тех, кто не знает, но хочет узнать и понять химию
Часть I. Элементы общей химии
(первый уровень сложности)
Продолжение. Начало см. в № 13, 18/2007
Глава 2. Важнейшие классы
неорганических соединений (окончание)
Основания – это сложные вещества, в состав которых входят атомы металлов и гидроксигруппы ОН.
Общая формула оснований: 
Валентность ОН-группы равна I.
Основания называют по схеме:
гидроксид (чего?) металла (n),
где n – переменная валентность металла.
Например: Са(ОН)2 – гидроксид кальция, Fе(OH)3 – гидроксид железа(III), NH4OH – гидроксид аммония.
Обратите внимание. В состав последнего основания не входит атом металла. Это исключение. Валентность группы NН4 (аммоний) равна I.
По растворимости в воде основания подразделяют на растворимые и нерастворимые. Это легко определить по таблице растворимости.
Растворимые в воде основания называются щелочами. В состав щелочей входят атомы активных металлов (они находятся в начале ряда напряжений, до магния). Гидроксид аммония тоже относится к щелочам, т.к. существует только в растворах.
Задание 2.21. Пользуясь таблицей растворимости или рядом напряжений, составьте химические формулы двух-трех щелочей.
Свойства и способы получения щелочей
Щелочи можно получить действием активного металла (K, Nа, Cа, Ва) или его оксида на воду:
2Nа + 2H2O = 2NаОН + H2
• Растворы щелочей реагируют с кислотными и амфотерными оксидами, а также с кислотами. Последняя реакция называется реакцией нейтрализации:
Реакция нейтрализации характерна для всех кислот.
• Растворы щелочей реагируют с растворами солей. Реакция происходит, если образуется хотя бы одно нерастворимое соединение. Эта реакция относится к реакциям обмена, т.е. в результате получается новая соль и новое основание:
Обратите внимание. 1) Последняя реакция не происходит, т.к. оба вещества в правой части уравнения растворимы в воде.
2) Валентности составных частей исходных веществ определяйте по кислотному остатку или по числу групп ОН.
3) Полученные значения валентностей используйте при составлении формул веществ – продуктов реакции.
4) Растворимость получаемых веществ определяйте по таблице растворимости.
Задание 2.22. Расставьте коэффициенты в приведенных выше схемах реакций.
Задание 2.23. Составьте уравнения возможных реакций обмена:
Определите, какая из реакций не происходит и почему.
• Растворы щелочей, как и растворы кислот, изменяют окраску индикаторов. В растворе щелочи фиолетовый лакмус синеет, оранжевый метилоранж желтеет, бесцветный фенолфталеин краснеет.
Все изменения окрасок индикаторов можно свести в таблицу (табл. 4):
Окраска индикаторов в различных средах
Индикатор
Характер среды
Обратите внимание. Если к воде добавить кислоту, то среда раствора будет кислая, если добавить щелочь – среда щелочная, в чистой воде среда нейтральная.
В о п р о с 1. Можно ли при помощи фенолфталеина узнать, какая жидкость в стакане: вода, кислота НCl, раствор KОН? Можно ли для этого использовать раствор лакмуса?
В о п р о с 2. Почему реакцию между кислотой и щелочью называют реакцией нейтрализации?
Свойства и способы получения
нерастворимых в воде оснований
Среди нерастворимых в воде оснований следует выделить особую группу веществ – амфотерные гидроксиды. Их свойства будут рассмотрены ниже. Способы получения амфотерных оснований такие же, как и нерастворимых оснований.
Нерастворимые основания получают, действуя на раствор соли, в состав которой входит нужный атом металла, раствором щелочи:
CuSO4 + 2NaOH = Cu(OH)2 
Попробуем определить, какие вещества нужно взять для того, чтобы получить гидроксид марганца(II). До реакции составные части нерастворимого основания Mn(OH)2 находились в составе растворимых веществ – соли марганца (например, MnCl2) и щелочи (например, KOH):
Задание 2.24. Напишите уравнения реакций, при помощи которых можно получить:
а) гидроксид железа(III); б) гидроксид железа(II).
Свойства нерастворимых в воде оснований во многом отличаются от свойств щелочей. Нерастворимые в воде основания не реагируют с растворами солей, а также с амфотерными и некоторыми кислотными оксидами.
• Нерастворимые основания реагируют с кислотами. При этом происходит растворение исходного нерастворимого вещества (осадка). Например:
Таким образом, подобные реакции возможны, если образуется растворимая соль.
• Нерастворимые основания разлагаются при нагревании. При этом чем меньше активность металла (см. ряд напряжений), тем легче разлагается основание на оксид и воду:
Свойства амфотерных гидроксидов
Амфотерные гидроксиды соответствуют амфотерным оксидам. Это означает, что в состав амфотерного гидроксида входит тот же атом металла и с той же валентностью, что и в состав амфотерного оксида:
Амфотерные вещества проявляют двойственные свойства, они реагируют и с кислотами, и с щелочами (при этом амфотерные гидроксиды растворяются):
Если эта реакция происходит с растворами щелочей, то вместо вещества состава Na3AlO3 (или NaAlO2) * образуется сложное комплексное соединение: Na3[Al(OH)6] или Na[Al(OH)4].
Задание 2.25. Составьте уравнения реакций с кислотой и со щелочью следующих амфотерных гидроксидов: а) гидроксида цинка; б) гидроксида хрома(III).
Выводы по главе 2.3. Молекулы неорганических оснований содержат гидроксигруппы ОН.
Все неорганические основания, кроме NH4OH, содержат атомы металлов.
Основания делят на растворимые в воде (щелочи) и нерастворимые.
Растворы щелочей реагируют с кислотами (реакция нейтрализации), с кислотными и амфотерными оксидами, с растворами солей. Щелочи обнаруживаются индикаторами в щелочной («синей») области. Нерастворимые в воде основания не изменяют окраску индикатора, могут реагировать с некоторыми кислотами и кислотными оксидами. Термически неустойчивы.
Соль – это продукт реакции между кислотой и основанием.
В состав любой соли входит остаток основания (атом металла или группа NH4) и остаток кислоты (кислотный остаток). Например:
Задание 2.26. Для каждой из этих солей (см. выше) определите, где в ее молекуле остаток кислоты, а где – остаток основания. Определите валентности составных частей.
В состав некоторых солей входят атомы водорода или группы ОН. Такое различие подсказывает, что соли могут быть разных типов. Рассмотрим три вида солей.
Средние соли получаются, если кислота и основание полностью прореагировали:
Кислые соли получаются, если не все атомы водорода кислоты были замещены на атомы металла:
Кислотные остатки таких солей содержат атом водорода. Кислые соли могут проявлять некоторые свойства кислот. Например, они могут реагировать со щелочами:
Осно’вные соли образуются, если не все группы ОН основания замещаются на кислотный остаток:
Такие соли содержат гидроксигруппу ОН. Осно’вные соли могут проявлять некоторые свойства оснований. Например, они реагируют с кислотами:
Во многих примерах, которые иллюстрировали свойства оксидов, кислот и оснований, продуктами реакции были соли. Попробуем обобщить эти сведения и выяснить, в результате каких процессов можно получить соль заданного состава.
Способы получения солей
Способы получения солей можно условно разбить на две группы:
1-й с п о с о б – получение солей из веществ, которые не являются солями;
2-й с п о с о б – получение солей из других солей.
Реакции 1-го с п о с о б а основаны на том, что в реакцию вступают противоположные по свойствам вещества (рис. 4).



























 FeS;
FeS;

 (нет реакции)
(нет реакции) . ;
. ;