какая кислота образует два типа кислых солей
Какая кислота образует два типа кислых солей?
226. Формулы только слабых электролитов указаны в ряду:
227. Укажите уравнение электролитической диссоциации:
228. Общие химические свойства водных растворов кислот объясняется наличием:
В. катионов Н + и анионов кислотных остатков
229. Сокращенному ионному уравнению Ba 2+ + SO4 2- = BaSO4↓
соответствует левая часть уравнения химической реакции:
230. Молярность – это:
А. выраженная в граммах масса растворенного вещества, содержащаяся в 1 мл раствора
Б. количество молей растворенного вещества, содержащееся в 1 литре раствора
В. количество эквивалентных масс в 1 литре раствора
231. Соль, в растворе которой лакмус будет окрашиваться в красный цвет, имеет формулу:
232. Молярная масса эквивалента ортофосфорной кислоты равна:
233. В воде массой 300г растворили глюкозу массой 10г. Укажите массовую долю (%) глюкозы в полученном растворе:
234. Для приготовления водного раствора массой 150г с массовой долей NaOH 30% необходимо взять:
А. 105 г Н2О и 45 г NaOH
Б. 75 г Н2О и 75 г NaOH
В. 45 г Н2О и 105 г NaOH
Г. 120 г Н2О и 30 г NaOH
235. Сколько граммов раствора с массовой долей 10% можно приготовить из 30 граммов натрия хлорида?
236. Хлориддиаммин серебра разрушается под действием реактива:
237. Борно – этиловый эфир окрашивает пламя в цвет:
238. Коэффициент перед гидроксидом аммония в реакции:
AgCl + NH4OH → … должен быть:
239. Валентность кремния 14Si в возбужденном состоянии равна:
А. I Б. III В. IV Г. II Д. V
В ТЕСТОВЫХ ЗАДАНИЯХ №№240 – 246 ВЫБРАТЬ
ВСЕ ПРАВИЛЬНЫЕ ОТВЕТЫ:
A. 3S + 2А1 = A12S3 + 509кДж
Б. 2HgO = 2Hg + O2 – 180кДж
B. СO2 + 2Mg = С + 2MgO + 809кДж
Г. 2Сu2O = O2 + 4Сu – 342кДж
242. Фенолфталеин окрасится в растворах:
243. Нейтральную среду имеют растворы:
244. Кислотную среду имеют растворы:
245. С гидроксидом натрия в растворе реагируют:
A. хлорид хрома (III)
Б. карбонат кальция
B. нитрат бария
Г. сульфат магния
246. Между собой реагируют оксиды:
В ТЕСТОВЫХ ЗАДАНИЯХ №№247 – 255 НЕОБХОДИМО
ПРЕДЛАГАЕМЫЕ ОТВЕТЫ МОГУТ БЫТЬ ИСПОЛЬЗОВАНЫ ОДИН ИЛИ
НЕСКОЛЬКО РАЗ, ИЛИ НЕ ИСПОЛЬЗОВАНЫ СОВСЕМ.
247. Установите соответствие:
Название оксида:Название соответствующей кислоты:
1. оксид серы (VI) А. сернистая кислота
2. оксид углерода (IV) Б. серная кислота
3. оксид фосфора (V) В. угольная кислота
Г. oртофосфорная кислота
248. Установите соответствие:
Кислота:Соль:
1.серная кислота А. сульфиды
2.азотистая кислота Б. нитриты
3.бромоводородная кислота В. нитраты
249. Установите соответствие:
Анионы:Реактивы, используемые для
1. бромид — анион А. Р-р хлороводородной кислоты;
Б. Р-р хлорида бария;
2. фосфат — анион В. Р-р нитрата серебра;
Г. Этиловый спирт и конц. серная к-та;
Д. Дифениламин в конц. серной кислоте.
250. Установите соответствие:
Открываемые катионы: Используемые реактивы:
1. калий А. р-р гексацианоферрата (II) калия
2. магний Б. р-р гидроксида аммония
3. медь (II) В. р-р гексанитрокобольтата (III) натрия
Г. р-р гидроортофосфата натрия
Д. р-р оксалата аммония
251. Установите соответствие:
Элементарные частицы:Расположение в атоме:
1. протон А. в ядре атома
2. нейтрон Б.вокруг ядра
3. электрон В. в ядре и вокруг ядра атома
252. Установите соответствие:
Лекарственные средства:Применение в медицине:
1. 5% спиртовой раствор йода А. Дезинфицирующее средство
и способствует заживлению ран;
2. Калия бромид Б. Для лечения чесотки,противоядие
при отравлении галогенами,
3. Сульфат бария цианидами;
В. Успокоительное средство;
4. Тиосульфат натрия Г. Рентгеноконтрастное средство;
Д. Регулирует осмотическое давление
жидких тканей организма;
Е. Антисептическое средство в
253. Установите соответствие:
Индикаторы:Окраска в щелочной среде:
1. фенолфталеин А. желтая
2. метилоранж Б. синяя
3. красная лакмусовая бумага В. малиновая
4. синяя лакмусовая бумага Г. розовая
254. Установите соответствие:
Химические вещества:Класс соединений:
1. гидроксохлорид кальция А. основной оксид
2. дигидроортофосфат натрия Б. кислая соль
3. хлорид меди (II) В. основная соль
4. гидроксид бария Г. основание
Е. комплексная соль
255. Установите соответствие:
Какая кислота образует два типа кислых солей
Химические свойства основных оксидов:
1. основ.оксид + кислота = соль + Н2О
2. основ.оксид + кисл.оксид = соль
Химические свойства кислотных оксидов:
1. кисл.оксид + основание = соль + Н2О
2. кисл.оксид + основ.оксид = соль
3. кисл.оксид + Н2О = кислота
ОСНОВАНИЯ – это сложные вещества, состоящие из ионов металла и гидроксид-ионов.
Химические свойства оснований:
1. основание + кислота = соль + Н2О
2. щелочь + кисл.оксид = соль + Н2О
3. щелочь + соль = новое основание + новая соль (↑ или ↓)
(2 KOH + CuCl 2 = Cu ( OH )2 ↓ + 2 KCl )
4. нерастворимое основание = оксид Ме + Н2О
это сложные вещества, которые имеют свойства и кислот, и оснований, и потому их формулы можно записывать в разных формах:
форма основания форма кислоты
КИСЛОТЫ – это сложные вещества, состоящие из ионов водорода и кислотных остатков.
1. кислота + основание = соль + Н2О
( HCl + NaOH = NaCl + H 2 O )
2. кислота + основ.оксид = соль + Н2О
3. кислота + соль = новая кислота + новая соль (↑ или ↓)
4. кислота + Ме = соль + Н2 (Ме до водорода, соль растворима)
СОЛИ – это сложные вещества, состоящие из ионов металла и кислотных остатков.
1. соль + щелочь = новое основание + новая соль (↑ или ↓)
( FeCl 3 +3 KOH = Fe ( OH )3 ↓ +3 KCl )
2. соль + кислота = новая кислота + новая соль (↑ или ↓)
3. соль + соль = новая соль + новая соль (↓)
( NaCl + AgNO 3 = AgCl ↓ + NaNO 3 )
4. соль + Ме = новая соль + другой Ме
Гидролиз
Определение гидролиза
| Гидролиз — это процесс взаимодействия сложного химического вещества с водой, итогом которого становится разложение молекул этого вещества. Сам термин происходит от двух греческих слов: hydor, что значит «вода», и lysis, то есть «распад». |
Гидролизации подвержены как органические, так и неорганические вещества: углеводы, белки, оксиды, карбиды, соли и т. д. Например, гидролиз органических соединений напрямую связан с пищеварением — с его помощью происходит распад и усвоение клетками организма жиров, белков, углеводов. Но сейчас мы займемся неорганической химией и рассмотрим гидролизацию на примере солей.
| Гидролиз солей — это реакция взаимодействия ионов соли с Н + и ОН − ионами воды, которая ведет к распаду исходного соединения. В результате такого ионного обмена образуется слабый электролит — кислотный, щелочной или нейтральный. |
Условия гидролиза
Далеко не все соединения распадаются, вступая в реакцию с молекулами воды. Сейчас мы на примере солей рассмотрим, какие вещества подвергаются гидролизу, а какие нет, и от чего это зависит.
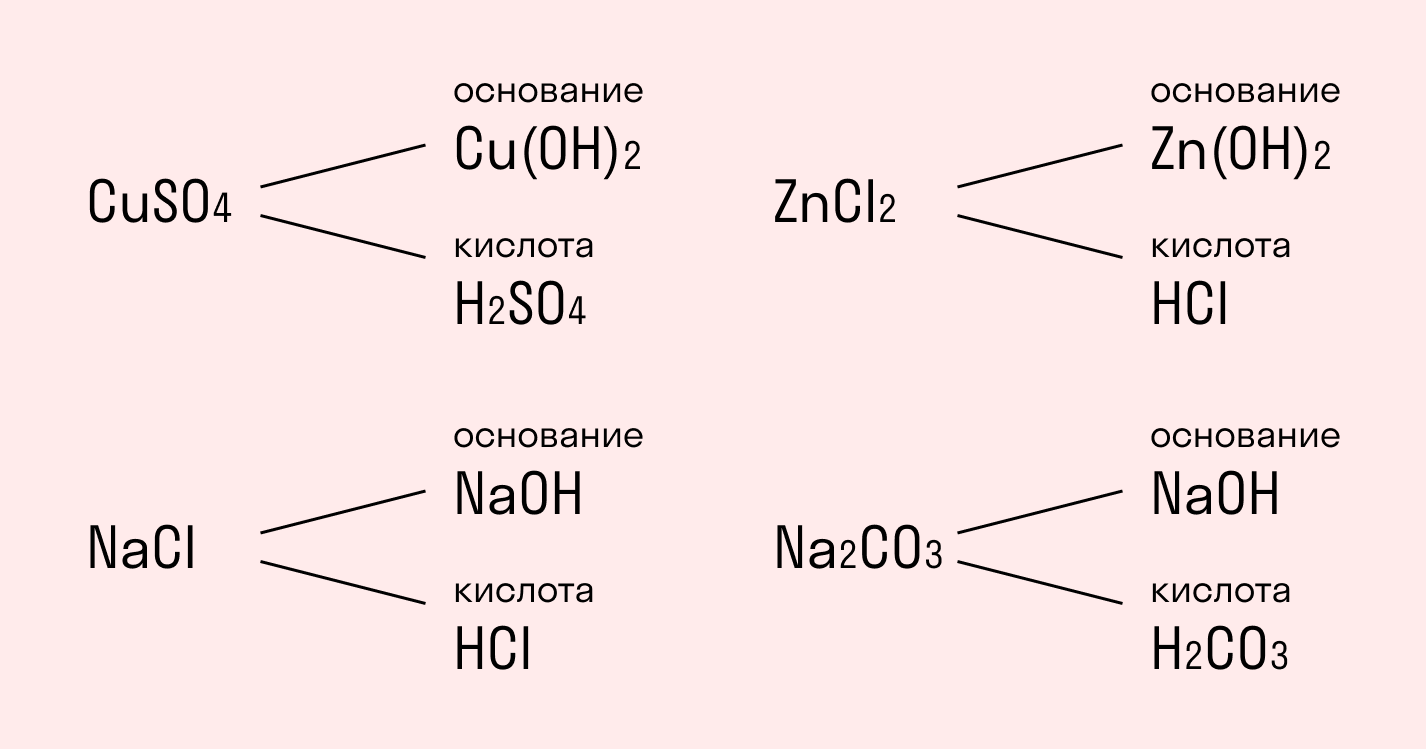
Начнем с того, что любая соль включает основание — амфотерный гидроксид, и кислотный остаток.
сульфат меди CuSO4состоит из основания Cu(ОН)2и кислоты H2SO4;
хлорид натрия NaCl состоит из основания NaOH и кислоты HCl;
хлорид цинка ZnCl2состоит из основания Zn(ОН)2 и кислоты HCI;
карбонат натрия Na2CO3состоит из основания NaOH и кислоты H2CO3.
В зависимости от того, какие соли подвергаются гидролизу — со слабым основанием или слабой кислотой, в итоге может получиться кислая, щелочная или нейтральная среда водного раствора.
А что происходит, если соль состоит из сильного основания и сильного кислотного остатка? Ничего. 🙂 В этом случае ее сильные катионы и анионы не взаимодействуют с ионами воды. Такая соль не распадается, то есть не подвержена гидролизу.
Схема химической реакции гидролиза выглядит так:
XY + HOH ↔ XH + HOY
XH — кислотный остаток;
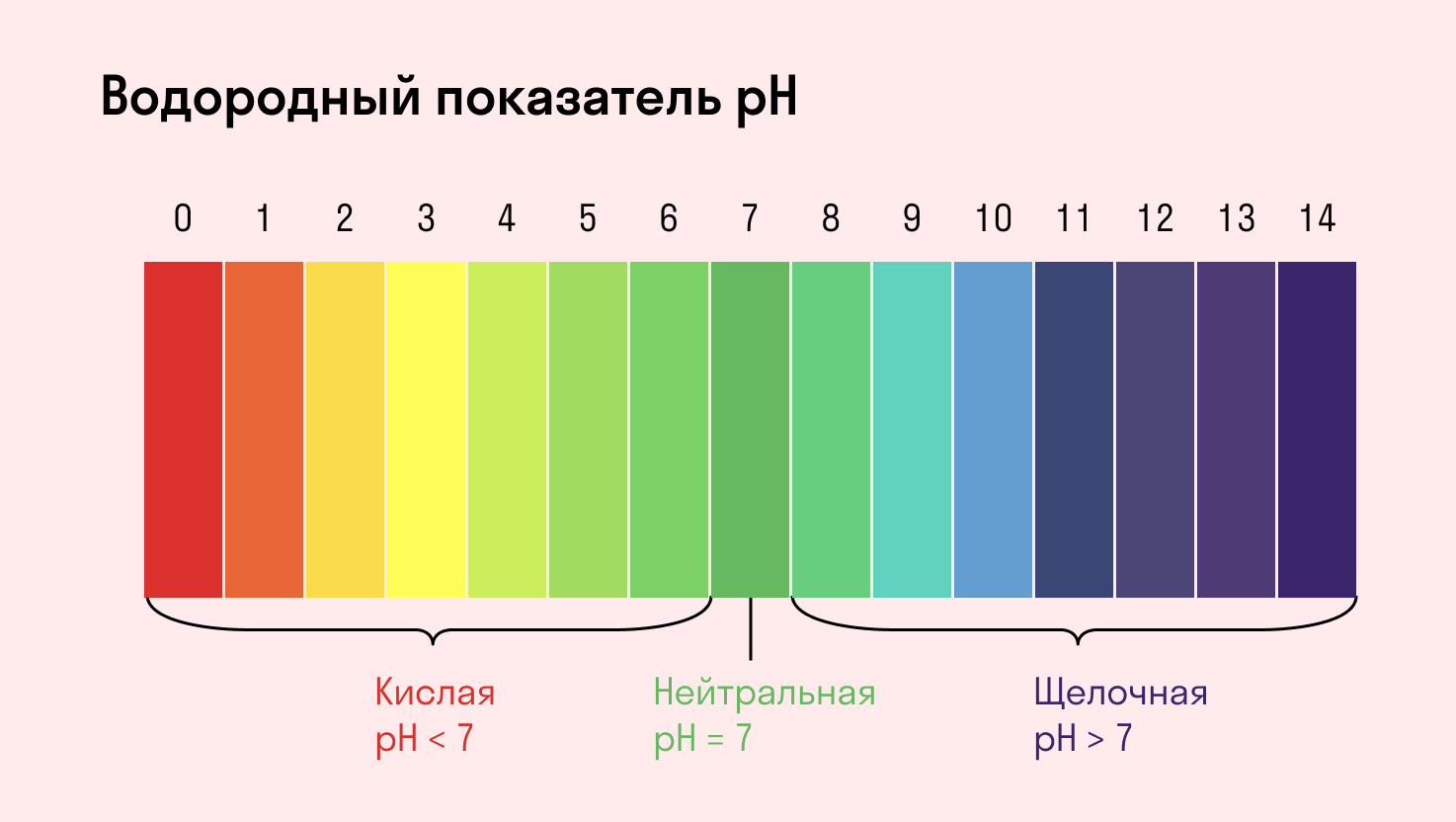
Индикаторы среды раствора
Для определения среды раствора за считанные секунды используются специальные индикаторы. Самый распространенный из них — лакмусовая бумага, но также популярны фенолфталеин и метиловый оранжевый. В нейтральной среде они не меняют свой цвет, а в кислотной или щелочной — приобретают другую окраску.
Изменение цвета индикатора однозначно говорит о том, что произошла гидролизация. Однако если цвет остался тем же — это не всегда означает отсутствие гидролиза. Среда будет почти нейтральной и в том случае, когда гидролизу подвергается соль со слабым основанием и слабой кислотой. Но об этом поговорим дальше, а пока посмотрите таблицу.
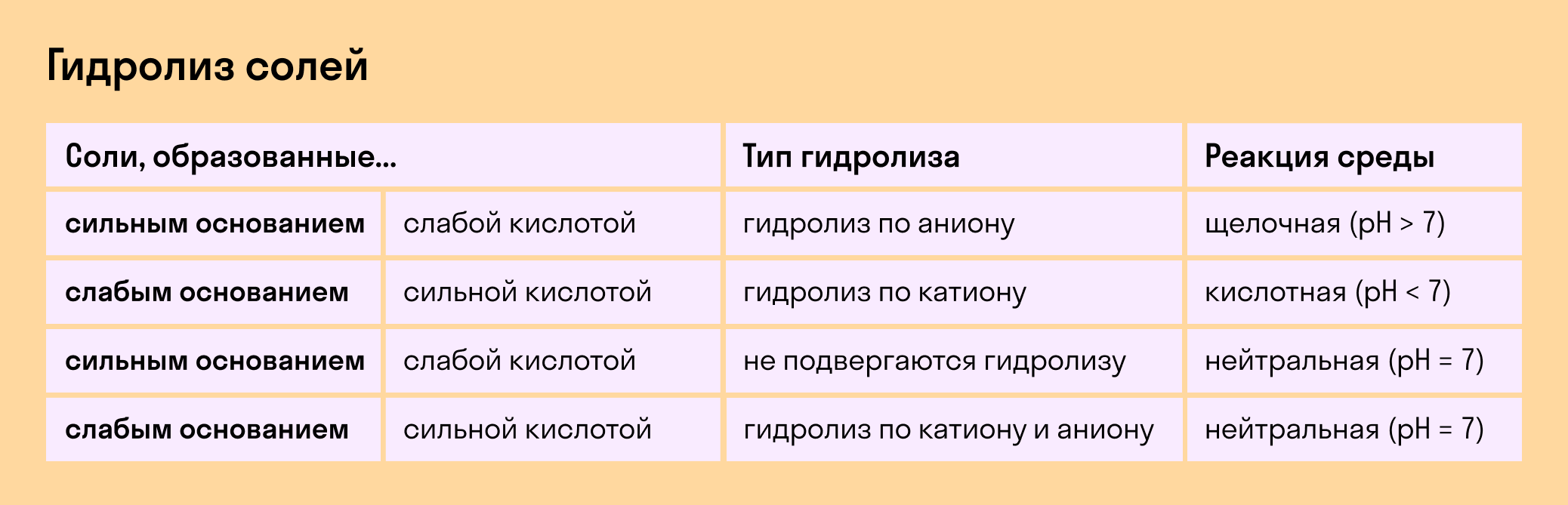
Виды гидролиза
Мы выяснили, что в составе соли может быть слабый ион, который и отвечает за гидролизацию. Он находится в основании, в кислотном остатке или в обоих компонентах, и от этого зависит тип гидролиза.
Соль с сильным основанием и сильной кислотой
Гидролиз отсутствует. Как вы уже знаете, при наличии сильного основания и сильного кислотного остатка соль не распадается при взаимодействии с водой. Так, например, невозможен гидролиз хлорида натрия (NaCl), поскольку в составе этого вещества нет слабых ионов. К таким же не подверженным гидролизации солям относят KClO4, Ba(NO3)2 и т. д.
Среда водного раствора — нейтральная, т. е. pH = 7.
Реакция индикаторов: не меняют свой цвет (лакмус остается фиолетовым, а фенолфталеин — бесцветным).
Соль со слабым основанием и сильной кислотой
Среда водного раствора — кислая, pH меньше 7.
Реакция индикаторов: фенолфталеин остается бесцветным, лакмус и метиловый оранжевый — краснеют.
Соль с сильным основанием и слабой кислотой
Среда водного раствора — щелочная, pH больше 7.
Реакция индикаторов: фенолфталеин становится малиновым, лакмус — синим, а метиловый оранжевый желтеет.
Молекулярное уравнение: KNO2 + H2O ↔ HNO2 + KOH
Ионное уравнение: K + + NO2 − + HOH ↔ HNO2 + K + + OH −
Гидролиз по катиону и аниону. Если у соли оба компонента — слабые, при взаимодействии с водой в реакцию вступает и анион, и катион. При этом катион основания связывает ионы воды OH − а анион кислоты связывает ионы H +
Среда водного раствора: нейтральная, слабокислая или слабощелочная.
Реакция индикаторов: могут не изменить свой цвет.
Цианид аммония NH4CN включает слабое основание NH4OH и слабую кислоту HCN.
Молекулярное уравнение: NH4CN + H2O ↔ NH4OH + HCN
Ионное уравнение: NH4 + + CN − + HOH ↔ NH4OH + HCN
Среда в данном случае будет слабощелочной.
Обобщим все эти сведения в таблице гидролиза солей.
Ступенчатый гидролиз
Любой из видов гидролиза может проходить ступенчато. Так бывает в тех случаях, когда с водой взаимодействует соль с многозарядными катионами и анионами. Сколько ступеней будет включать процесс — зависит от числового заряда иона, отвечающего за гидролиз.
Как определить количество ступеней:
если соль содержит слабую многоосновную кислоту — число ступеней равняется основности этой кислоты;
если соль содержит слабое многокислотное основание — число ступеней определяют по кислотности основания.
Для примера рассмотрим гидролиз карбоната калия K2CO3. У нас есть двухосновная слабая кислота H2CO3, а значит, гидролизация пройдет по аниону в две ступени.
I ступень: K2CO3+HOH ↔ KOH+KHCO3, итогом которой стало получение гидроксида калия (KOH) и кислой соли (KHCO3).
II ступень: K2HCO3+HOH ↔ KOH+H2CO3, в итоге получился тот же гидроксид калия (KOH) и слабая угольная кислота (H2CO3).
Для приблизительных расчетов обычно принимают в учет только результаты первой ступени.
Обратимый и необратимый гидролиз
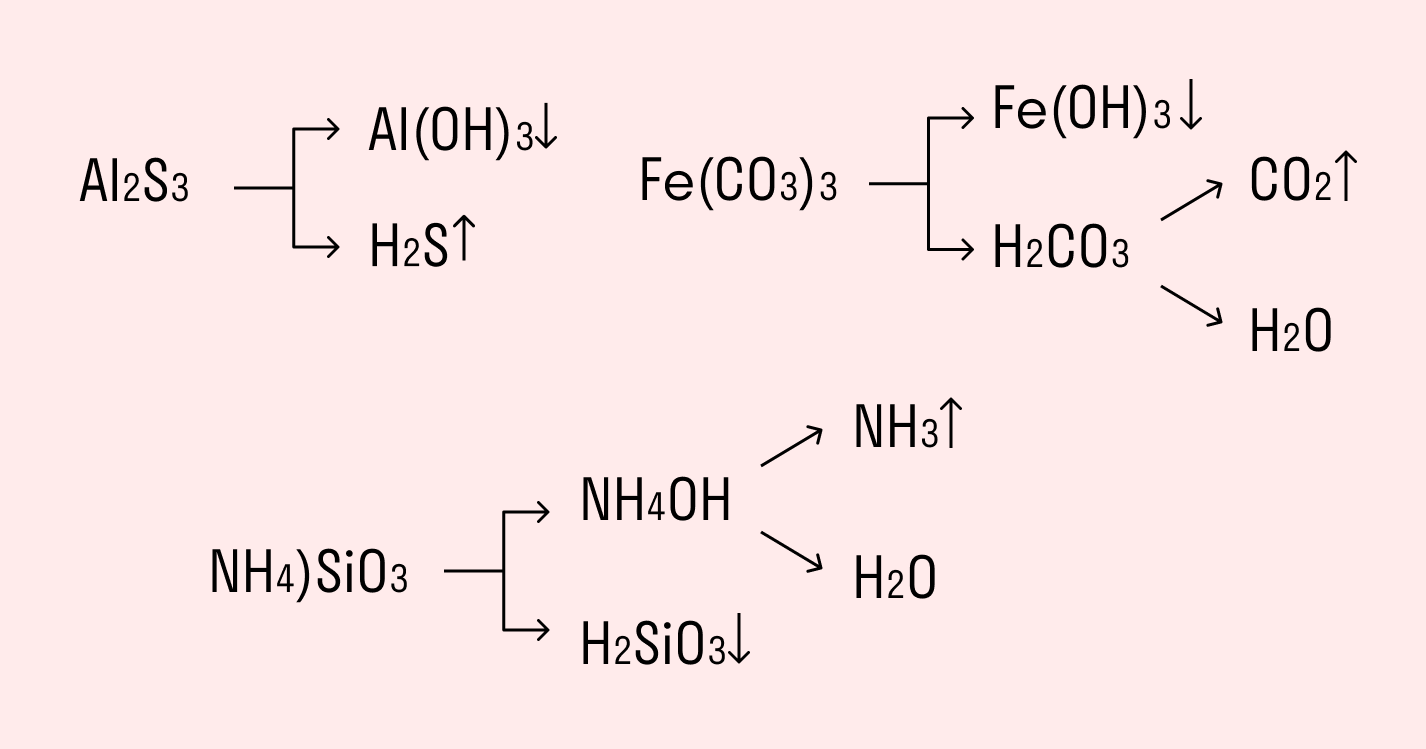
Химические вещества могут гидролизоваться обратимо или необратимо. В первом случае распадается лишь некоторое количество частиц, а во втором — практически все. Если соль полностью разлагается водой, это необратимый процесс, и его называют полным гидролизом.
Необратимо гидролизуются соли, в составе которых есть слабые нерастворимые основания и слабые и/или летучие кислоты. Такие соединения могут существовать лишь в сухом виде, их не получить путем смешивания водных растворов других солей.
Например, полному гидролизу подвергается сульфид алюминия:
Как видите, в результате гидролизации образуется гидроксид алюминия и сероводород.
Необратимые реакции при взаимодействии с водой имеют место и в органической химии. В качестве примера рассмотрим полный гидролиз органического вещества — карбида кальция, в результате которого образуется ацетилен:
Степень гидролиза
Взаимодействие соли или другого химического соединения с водой может усиливаться или ослабляться в зависимости от нескольких факторов. Если нужно получить количественное выражение гидролиза, говорят о его степени, которая указывается в процентах.
h — степень гидролиза,
nгидр. — количество гидролизованного вещества,
nобщ. — общее количество растворенного в воде вещества.
На степень гидролизации может повлиять:
температура, при которой происходит процесс;
концентрация водного раствора;
состав участвующих в гидролизе веществ.
Можно усилить гидролиз с помощью воды (просто разбавить полученный раствор) или стимулировать процесс повышением температуры. Более сложным способом будет добавление в раствор такого вещества, которое могло бы связать один из продуктов гидролиза. К соли со слабой кислотой и сильным основанием нужно добавить соль со слабым основанием и сильной кислотой.
Для ослабления гидролиза раствор охлаждают и/или делают более концентрированным. Также можно изменить его состав: если гидролизация идет по катиону — добавляют кислоту, а если по аниону — щелочь.
Итак, мы разобрались, что такое гидролиз солей и каким он бывает. Пора проверить свои знания и ответить на вопросы по материалу.
Вопросы для самопроверки:
Назовите необходимое условие для гидролиза.
Какие типы гидролиза вы знаете?
В каком случае в результате гидролиза может образоваться слабощелочная или слабокислая среда?
По какому типу гидролизуется соль с сильным основанием и слабым кислотным остатком?
При гидролизе соли с сильным основанием и слабой кислотой для ослабления процесса нужно добавить в раствор кислоту или щелочь?
Как воздействует на гидролиз разбавление раствора водой?
Как определяется количество ступеней гидролиза?
Какая среда раствора образуется при гидролизации солей NaF, KCl, FeBr2, Na2PO4? Ответов может быть несколько.
Какие из солей гидролизуются по катиону: Csl, FeSO4, RbNO3, CuSO4, Mn(NO3)2? Ответов может быть несколько.
Какая из солей не подвергается гидролизу: K2HPO4, KNO3, KCN, Ni(NO3)2?
Какая кислота образует два типа кислых солей
§8.7 Соли. Названия и классификация солей.
В предыдущих параграфах этой главы вы постоянно встречались с реакциями, в которых образуются соли.
Солями называются вещества, в которых атомы металла связаны с кислотными остатками.
NaCl – хлорид натрия,
Na 2 SO 4 – сульфат натрия,
СаSO 4 – сульфат кальция,
СаCl 2 – хлорид кальция,
(NH 4 ) 2 SO 4 – сульфат аммония.
Формула соли строится с учетом валентностей металла и кислотного остатка. Практически все соли – ионные соединения, поэтому можно говорить, что в солях связаны между собой ионы металла и ионы кислотных остатков:
Na + Cl – – хлорид натрия
Ca 2+ SO 4 2– – сульфат кальция и т.д.
Названия солей составляются из названия кислотного остатка и названия металла. Главным в названии является кислотный остаток. Названия солей в зависимости от кислотного остатка показаны в таблице 8-6.
Таблица 8-6. Построение названий солей. В верхней части таблицы приведены кислородсодержащие кислотные остатки, в нижней – бескислородные.
Соль какой кислоты
Валентность остатка
Ca(NO 3 ) 2 нитрат кальция
Кремниевая H 2 SiO 3
Na 2 SiO 3 силикат натрия
PbSO 4 сульфат свинца
Na 2 CO 3 карбонат натрия
Фосфорная H 3 PO 4
AlPO 4 фосфат алюминия
Бромоводородная HBr
NaBr бромид натрия
Сероводородная H 2 S
FeS сульфид железа (II)
NH 4 Cl хлорид аммония
Фтороводородная HF
CaF 2 фторид кальция
Из таблицы 8-6 видно, что названия кислородсодержащих солей имеют окончания ” ат “, а названия бескислородных солей – окончания ” ид “.
В некоторых случаях для кислородсодержащих солей может использоваться окончание ” ит “. Например, Na 2 SO 3 – сульфит натрия. Это делается для того, чтобы различать соли серной кислоты (H 2 SO 4 ) и сернистой кислоты (H 2 SO 3 ) и в других таких же случаях.
Любую соль можно получить соответствующей реакцией нейтрализации. Например, сульфит натрия образуется в реакции между сернистой кислотой и основанием (едким натром). При этом на 1 моль кислоты требуется взять 2 моля основания:
сульфит натрия (средняя соль)
Если взять только 1 моль основания – то есть меньше, чем требуется для полной нейтрализации, то образуется кислая соль – гидросульфит натрия:
гидросульфит натрия (кислая соль)
Кислые соли образуются многоосновными кислотами. Одноосновные кислоты кислых солей не образуют.
Кислые соли, помимо ионов металла и кислотного остатка, содержат ионы водорода.
Названия кислых солей содержат приставку “гидро” (от слова hydrogenium – водород). Например:
NaHCO 3 – гидрокарбонат натрия,
K 2 HPO 4 – гидрофосфат калия,
KH 2 PO 4 – дигидрофосфат калия.
Основные соли образуются при неполной нейтрализации основания. Названия основных солей образуют с помощью приставки “гидроксо”. Ниже приведен пример, показывающий отличие основных солей от обычных (средних):
хлорид магния ( средняя соль)
гидроксохлорид магния ( основная соль)
Основные соли, помимо ионов металла и кислотного остатка, содержат гидроксильные группы.
Основные соли образуются только из многокислотных оснований. Одноокислотные основания таких солей образовать не могут.
В таблице 8-6 приведены международные названия солей. Однако полезно знать также русские названия и некоторые исторически сложившиеся, традиционные названия солей, имеющих важное значение (таблица 8-7).
Таблица 8-7. Международные, русские и традиционные названия некоторых важных солей.
Международное название
Традиционное название
В быту – как моющее и чистящее средство
Гидрокарбонат натрия
Натрий углекислый кислый
Пищевой продукт: выпечка кондитерских изделий
Применяется в технике
Натрий сернокислый
Лекарственное средство
Магний сернокислый
Лекарственное средство
Применяется в зажигательных смесях для головок спичек
В химии и в технике до сих пор сохраняется много старинных названий. Например, каустическая сода – вовсе не соль, а техническое название гидроксида натрия NaOH. Если обыкновенной содой можно почистить раковину или посуду, то каустическую соду ни при каких обстоятельствах брать в руки или использовать в быту нельзя!
Эти простые знания могут пригодиться в жизни – мало ли с какими веществами придется столкнуться в будущем.
** Строение солей аналогично строению соответствующих кислот и оснований. Ниже приведены структурные формулы типичных средних, кислых и основных солей.
В заключение приведем строение и название основной соли, формула которой, на первый взгляд, выглядит очень сложной: [Fe(OH) 2 ] 2 CO 3 – дигидроксокарбонат железа (III).
На самом деле, при рассмотрении структурной формулы такой соли становится ясно, что эта соль – продукт частичной нейтрализации гидроксида железа (III) угольной кислотой:
8.23. Закончите уравнения реакций. Определите, какие соли (средние, кислые, основные) получаются при данном мольном соотношении реагентов. Назовите эти соли.
в) 3Ca(OH) 2 + 2H 3 PO 4 =
г) Ca(OH) 2 + H 3 PO 4 =
Кислые соли
Задания на применение знаний о кислых солях встречаются в вариантах работ ЕГЭ
на разных уровнях сложности (А, В и С). Поэтому при подготовке учащихся к сдаче ЕГЭ
нужно рассмотреть следующие вопросы.
1. Определение и номенклатура.
Кислые соли – это продукты неполного замещения атомов водорода многоосновных кислот на металл. Номенклатура кислых солей отличается от средних только добавлением приставки «гидро…» или «дигидро…» к названию соли, например: NaHCO3 – гидрокарбонат натрия, Са(Н2РО4)2 – дигидрофосфат кальция.
Кислые соли получаются при взаимодействии кислот с металлами, оксидами металлов, гидроксидами металлов, солями, аммиаком, если кислота в избытке.
Na2S + HCl = NaHS + NaCl,
Также кислые соли получаются при взаимодействии кислотных оксидов со щелочами, если оксид в избытке. Например:
Средняя соль 
K2СО3 
Чтобы из средней соли получить кислую, нужно добавить избыток кислоты или соответствующего оксида и воды:
Чтобы из кислой соли получить среднюю, нужно добавить избыток щелочи:
Гидрокарбонаты разлагаются с образованием карбонатов при кипячении:
2KНСО3 
Кислые соли проявляют свойства кислот, взаимодействуют с металлами, оксидами металлов, гидроксидами металлов, солями.
2KНSO4 + Mg = H2 
2KHSO4 + MgCO3 = H2O + CO2 
2KHSO4 + BaCl2 = BaSO4 
5. Задачи на кислые соли. Образование одной соли.
При решении задач на избыток и недостаток нужно помнить о возможности образования кислых солей, поэтому сначала составляют уравнения всех возможных реакций. После нахождения количеств реагирующих веществ делают вывод о том, какая соль получится, и решают задачу по соответствующему уравнению.
З а д а ч а 1. Через раствор, содержащий 60 г NaOH, пропустили 44,8 л СО2. Найти массу образовавшейся соли.
| Дано: | Найти: m(соли). |
| m(NaOH) = 60 г, | |
| V(CO2) = 44,8 л. |


Поскольку 

Количество вещества образовавшейся соли равно количеству вещества прореагировавшего гидроксида натрия:

m(NaHCO3) = M • 
З а д а ч а 2. Оксид фосфора(V) массой 2,84 г растворили в 120 г 9%-й ортофосфорной кислоты. Полученный раствор прокипятили, затем к нему добавили 6 г гидроксида натрия. Найти массу полученной соли.
| Дано: | Найти: m(соли). |
| m(P2O5) = 2,84 г, | |
| m(р-ра)(H3PO4) = 120 г, | |
 (H3PO4) = 9 %, (H3PO4) = 9 %, | |
| m(NaOH) = 6 г. |

следовательно, 
m(H3PO4) = m(р-ра)• 







то получится дигидрофосфат натрия:

m(NaH2PO4) = M• 
З а д а ч а 3. Сероводород объемом 8,96 л пропустили через 340 г 2%-го раствора аммиака. Назовите соль, получившуюся в результате реакции, и определите ее массу.
Ответ: гидросульфид аммония,
m(NH4HS) = 20,4 г.
З а д а ч а 4. Газ, полученный при сжигании 3,36 л пропана, прореагировал с 400 мл 6%-го раствора гидроксида калия ( 
Ответ: 
З а д а ч а 5. Весь углекислый газ, полученный при сжигании 9,6 кг угля, пропустили через раствор, содержащий 29,6 кг гидроксида кальция. Найти массу полученной соли.
З а д а ч а 6. В 9,8 кг 20%-го раствора серной кислоты растворили 1,3 кг цинка. Найти массу полученной соли.
6. Задачи на кислые соли. Образование смеси двух солей.
Это более сложный вариант задач на кислые соли. В зависимости от количества реагирующих веществ возможно образование смеси двух солей.
Например, при нейтрализации оксида фосфора(V) щелочью в зависимости от молярного соотношения реагентов могут образоваться следующие продукты:






Следует помнить, что при неполной нейтрализации возможно образование смеси двух соединений. При взаимодействии 0,2 моль Р2О5 с раствором щелочи, содержащим 0,9 моль NaOH, молярное соотношение находится между 1:4 и 1:6. В этом случае образуется смесь двух солей: фосфата натрия и гидрофосфата натрия.
Если раствор щелочи будет содержать 0,6 моль NaOH, то молярное соотношение будет другим: 0,2:0,6 = 1:3, оно находится между 1:2 и 1:4, поэтому получится смесь двух других солей: дигидрофосфата и гидрофосфата натрия.
Эти задачи можно решать разными способами. Мы будем исходить из предположения, что одновременно происходят две реакции.
А л г о р и т м р е ш е н и я
1. Составить уравнения всех возможных реакций.
2. Найти количества реагирующих веществ и по их соотношению определить уравнения двух реакций, которые происходят одновременно.
3. Обозначить количество одного из реагирующих веществ в первом уравнении как х моль, во втором – у моль.
4. Выразить через х и у количества другого реагирующего вещества согласно молярным соотношениям по уравнениям.
5. Составить систему уравнений с двумя неизвестными.
З а д а ч а 1. Оксид фосфора(V), полученный при сжигании 6,2 г фосфора, пропустили через 200 г 8,4%-го раствора гидроксида калия. Какие вещества и в каких количествах получаются?
| Дано: | Найти:  1; 1;  2. 2. |
| m(P) = 6,2 г, | |
| m(р-ра KОН) = 200 г, | |
 (KОН) = 8,4 %. (KОН) = 8,4 %. |

следовательно, 
m(KOH) = 

Уравнения возможных реакций:


Обозначим 


Составим систему уравнений:
Поскольку количество вещества образующейся соли вдвое больше количества вещества вступившего в реакцию оксида фосфора(V), то получится по 0,1 моль гидро- и дигидрофосфата калия:




Ответ: 

З а д а ч а 2. Найти массы и массовые доли солей, полученных при растворении 22,4 л углекислого газа в 480 г 10%-го раствора гидроксида натрия.
Ответ: m(Na2CO3) = 21,2 г, 
m(NaHCO3) = 67,2 г, 
З а д а ч а 3. Найти массовые доли солей в растворе, полученном при пропускании 100 м 3 аммиака через 500 кг 50%-го раствора фосфорной кислоты.
Ответ. 

З а д а ч а 4. К 50 г раствора ортофосфорной кислоты с массовой долей 11,76 % прибавили 150 г раствора гидроксида калия с массовой долей 5,6 %. Найти состав остатка, полученного при выпаривании раствора.
З а д а ч а 5. Сожгли 5,6 л бутана (н.у.) и образовавшийся углекислый газ пропустили через раствор, содержащий 102,6 г гидроксида бария. Найти массы полученных солей.