какая кислота считается концентрированной по процентам
Растворы кислот
Приблизительные растворы. В большинстве случаев в лаборатории приходится пользоваться соляной, серной и азотной кислотами. Кислоты имеются в продаже в виде концентрированных растворов, процентное содержание которых определяют по их плотности.
Кислоты, применяемые в лаборатории, бывают технические и чистые. Технические кислоты содержат примеси, а потому при аналитических работах не употребляются.
Концентрированная соляная кислота на воздухе дымит, поэтому работать с ней нужно в вытяжном шкафу. Наиболее концентрированная соляная кислота имеет плотность 1,2 г/см3 и содержит 39,11%’ хлористого водорода.
Разбавление кислоты проводят по расчету, описайному выше.
Пример. Нужно приготовить 1 л 5%-ного раствора соляной кислоты, пользуясь раствором ее с плотностью 1,19 г/см3. По справочнику узнаем, что 5%,-ный раствор нмеет плотность 1,024 г/см3; следовательно, 1 л ее будет весить 1,024*1000 = 1024 г. В этом количестве должно содержаться чистого хлористого водорода:
Кислота с плотностью 1,19 г/см3 содержит 37,23% HCl (находим также по справочнику). Чтобы узнать, сколько следует взять этой кислоты, составляют пропорцию:
или 137,5/1,19 = 115,5 кислоты с плотностью 1,19 г/см3, Отмерив 116 мл раствора кислоты, доводят объем его до 1 л.
Так же разбавляют серную кислоту. При разбавлении ее следует помнить, что нужно приливать кислотук воде
, а не наоборот. При разбавлении происходит сильное разогревание, и если приливать воду к кислоте, то возможно разбрызгивание ее, что опасно, так как серная кислота вызывает тяжелые ожоги. Если кислота попала на одежду или обувь, следует быстро обмыть облитое место большим количеством воды, а затем нейтрализовать кислоту углекислым натрием или раствором аммиака. При попадании на кожу рук или лица нужно сразу же обмыть это место большим количеством воды.
Особой осторожности требует обращение с олеумом, представляющим моногидрат серной кислоты, насыщенный серным ангидридом SO3. По содержанию последнего олеум бывает нескольких концентраций.
Следует помнить, что при небольшом охлаждении олеум закристаллизовывается и в жидком состоянии находится только при комнатной температуре. На воздухе он дымит с выделением SO3, который образует пары серной кислоты при взаимодействии с влагой воздуха.
Большие трудности вызывает переливание олеума из крупной тары в мелкую. Эту операцию следует проводить или под тягой, или на воздухе, но там, где образующаяся серная кислота и SO3 не могут оказать какого-либо вредного действия на людей и окружающие предметы.
Если олеум затвердел, его следует вначале нагреть, поместив тару с ним в теплое помещение. Когда олеум расплавится и превратится в маслянистую жидкость, его нужно вынести на воздух и там переливать в более мелкую посуду, пользуясь для этого способом передавлива-ния при помощи воздуха (сухого) или инертного газа (азота).
При смешивании с водой азотной кислоты также происходит разогревание (не такое, правда, сильное, как в случае серной кислоты), и поэтому меры предосторожности должны применяться и при работе с ней.
В лабораторной практике находят применение твердые органические кислоты. Обращение с ними много проще и удобнее, чем с жидкими. В этом случае следует заботиться лишь о том, чтобы кислоты не загрязнялись чем-либо посторонним. При необходимости твердые органические кислоты очищают перекристаллизацией (см, гл. 15 «Кристаллизация»),
Точные растворы. Точные растворы кислот готовят так же, как и приблизительные, с той только разницей, что вначале стремятся получить раствор несколько большей концентрации, чтобы после можно было его точно, по расчету, разбавить. Для точных растворов берут только химически чистые препараты.
Нужное количество концентрированных кислот обычно берут по объему, вычисленному на основании плотности.
Пример. Нужно приготовить 0,1 и. раствор H2SO4. Это значит, что в I л раствора должно содержаться:
Кислота с плотностью 1,84 г\смг содержит 95,6% H2SO4 н для приготовления 1 л 0,1 н. раствора нужно взять следующее количество (х) ее (в г):
Соответствующий объем кислоты составит:
Отмерив из бюретки точно 2,8 мл кислоты, разбавляют ее до 1 л в мерной колбе и затем титруют раствором щелочи п устанавливают нормальность полученного раствора. Если раствор получится более концентрированный), к нему добавляют из бюретки рассчитанное количество воды. Например, при титровании установлено, что 1 мл 6,1 н. раствора H2SO4 содержит не 0,0049 г H2SO4, а 0,0051 г. Для вычисления количества воды, которое необходимо для приготовления точно 0,1 н. раствора, составляем пропорцию:
Расчет показывает, что этот объем равен 1041 мл раствор нужно добавить 1041 — 1000 = 41 мл воды. Следует еще учесть то количество раствора, которое взято для титрования. Пусть взято 20 мл, что составляет 20/1000 = 0,02 от имеющегося объема. Следовательно, воды нужно добавить не 41 мл, а меньше: 41 — (41*0,02) = = 41 —0,8 = 40,2 мл.
Исправленный раствор следует снова проверить на содержание вещества, взятого для растворения. Точные растворы соляной кислоты готовят также ионообменным способом, исходя из точной рассчитанной навески хлористого натрия. Рассчитанную и отвешенную на аналитических весах навеску растворяют в дистиллированной или деминерализованной воде, полученный раствор пропускают через хроматографическую колонку, наполненную катионитом в Н-форме. Раствор, вытекающий из колонки, будет содержать эквивалентное количество HCl.
Как правило, точные (или титрованные) растворы следует сохранять в плотно закрытых колбах, В пробку сосуда обязательно нужно вставлять хлоркальциевую трубку, заполненную в случае раствора щелочи натронной известью или аскаритом, а в случае кислоты — хлористым кальцием или просто ватой.
Для проверки нормальности кислот часто применяют прокаленный углекислый натрий Na2COs. Однако он обладает гигроскопичностью и поэтому не полностью удовлетворяет требованиям аналитиков. Значительно удобнее пользоваться для этих целей кислым углекислым калием KHCO3, высушенным в эксикаторе над CaCl2.
При титровании полезно пользоваться «свидетелем», для приготовления которого в дистиллированную или деминерализованную воду добавляют одну каплю кислоты (если титруют щелочь) или щелочи (если титруют кислоту) и столько капель индикаторного раствора, сколько добавлено в титруемый раствор.
Приготовление эмпирических, по определяемому веществу, и стандартных растворов, кислот проводят по расчету с применением формул, приведенных для этих и описанных выше случаев.
Серная кислота ГОСТ 4204-77
наименование
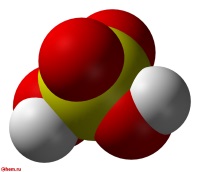
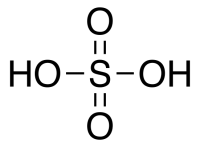
Серная кислота H 2 SO 4 — сильная двухосновная кислота, отвечающая высшей степени окисления серы (+6). При обычных условиях концентрированная серная кислота — тяжёлая маслянистая жидкость без цвета и запаха, с кислым «медным» вкусом. В технике серной кислотой называют её смеси как с водой, так и с серным ангидридом SO3. Если молярное отношение SO3 : H2O 1 — раствор SO3 в серной кислоте (олеум).
Содержание
Название
В XVIII—XIX веках серу для пороха производили из серного колчедана (пирит) на купоросных заводах. Серную кислоту в то время называли «купоросным маслом», очевидно отсюда происхождение названия её солей (а точнее именно кристаллогидратов) — купоросы.
Получение серной кислоты
Промышленный (контактный) способ
В промышленности серную кислоту получают окислением диоксида серы (сернистый газ, образующийся в процессе сжигания серы или серного колчедана) до триоксида (серного ангидрида) с последующим взаимодействием SO3 с водой. Получаемую данным способом серную кислоту также называют контактной (концентрация 92-94 %).
Нитрозный (башенный) способ
Раньше серную кислоту получали исключительно нитрозным методом в специальных башнях, а кислоту называли башенной (концентрация 75 %). Сущность этого метода заключается в окислении диоксида серы диоксидом азота в присутствии воды. Именно таким способом произошла реакция в воздухе Лондона во время Великого смога.
Другой способ
Сульфиды данных металлов обладают высочайшей прочностью, а также отличительным чёрным окрасом,
но могут быть окислены до сульфатов, например, азотной кислотой при кипении:
CuS + 8HNO3 → CuSO4 + 8NO2↑ + 4H2O
Физические и физико-химические свойства
Олеум
Растворы серного ангидрида SO3 в серной кислоте называются олеумом, они образуют два соединения H2SO4·SO3 и H2SO4·2SO3.
Олеум содержит также пиросерные кислоты, получающиеся по реакциям:
Температура кипения водных растворов серной кислоты повышается с ростом её концентрации и достигает максимума при содержании 98,3 % H2SO4.
| Содержание % по массе | Плотность при 20 ℃, г/см³ | Температура плавления, ℃ | Температура кипения, ℃ | |
|---|---|---|---|---|
| H2SO4 | SO3 (свободный) | |||
| 10 | – | 1,0661 | −5,5 | 102,0 |
| 20 | – | 1,1394 | −19,0 | 104,4 |
| 40 | – | 1,3028 | −65,2 | 113,9 |
| 60 | – | 1,4983 | −25,8 | 141,8 |
| 80 | – | 1,7272 | −3,0 | 210,2 |
| 98 | – | 1,8365 | 0,1 | 332,4 |
| 100 | – | 1,8305 | 10,4 | 296,2 |
| 104,5 | 20 | 1,8968 | −11,0 | 166,6 |
| 109 | 40 | 1,9611 | 33,3 | 100,6 |
| 113,5 | 60 | 2,0012 | 7,1 | 69,8 |
| 118,0 | 80 | 1,9947 | 16,9 | 55,0 |
| 122,5 | 100 | 1,9203 | 16,8 | 44,7 |
Температура кипения олеума с увеличением содержания SO3 понижается. При увеличении концентрации водных растворов серной кислоты общее давление пара над растворами понижается и при содержании 98,3 % H2SO4 достигает минимума. С увеличением концентрации SO3 в олеуме общее давление пара над ним повышается. Давление пара над водными растворами серной кислоты и олеума можно вычислить по уравнению:
величины коэффициентов А и В зависят от концентрации серной кислоты. Пар над водными растворами серной кислоты состоит из смеси паров воды, H2SO4 и SO3, при этом состав пара отличается от состава жидкости при всех концентрациях серной кислоты, кроме соответствующей азеотропной смеси.
С повышением температуры усиливается диссоциация:
При нормальном давлении степень диссоциации: 10⁻⁵ (373 К), 2,5 (473 К), 27,1 (573 К), 69,1 (673 К).
Плотность 100%-ной серной кислоты можно определить по уравнению:
d = 1,851 7 − 1,1 ⋅ 10 −3 t + 2 ⋅ 10 −6 t 2
С повышением концентрации растворов серной кислоты их теплоемкость уменьшается и достигает минимума для 100%-ной серной кислоты, теплоемкость олеума с повышением содержания SO3 увеличивается.
При повышении концентрации и понижении температуры теплопроводность λ уменьшается:
λ = 0,518 + 0,0016t − ( 0,25 + t/1293 ) ⋅ C/100
где С — концентрация серной кислоты, в %.
Максимальную вязкость имеет олеум H2SO4·SO3, с повышением температуры η снижается. Электрическое сопротивление серной кислоты минимально при концентрации SO3 и 92 % H2SO4 и максимально при концентрации 84 и 99,8 % H2SO4. Для олеума минимальное ρ при концентрации 10 % SO3. С повышением температуры ρ серной кислоты увеличивается. Диэлектрическая проницаемость 100%-ной серной кислоты 101 (298,15 К), 122 (281,15 К); криоскопическая постоянная 6,12, эбулиоскопическая постоянная 5,33; коэффициент диффузии пара серной кислоты в воздухе изменяется в зависимости от температуры; D = 1,67·10⁻⁵T 3/2 см²/с.
Химические свойства
Серная кислота в концентрированном виде при нагревании — довольно сильный окислитель.
Окисляет HI и частично HBr до свободных галогенов.
Углерод до CO2, серу — до SO2.
Окисляет многие металлы (исключения: Au, Pt, Ir, Rh, Ta.). При этом концентрированная серная кислота восстанавливается до SO2, например:
На холоде в концентрированной серной кислоте Fe, Al, Cr, Co, Ni, Ba пассивируются и реакции не протекают.
Наиболее сильными восстановителями концентрированная серная кислота восстанавливается до S и H2S. Концентрированная серная кислота поглощает водяные пары, поэтому она применяется для сушки газов, жидкостей и твёрдых тел, например, в эксикаторах. Однако концентрированная H2SO4 частично восстанавливается водородом, из-за чего не может применяться для его сушки. Отщепляя воду от органических соединений и оставляя при этом чёрный углерод (уголь), концентрированная серная кислота приводит к обугливанию древесины, сахара и других веществ.
Разбавленная H2SO4 взаимодействует со всеми металлами, находящимися в электрохимическом ряду напряжений левее водорода с его выделением, например:
Окислительные свойства для разбавленной H2SO4 нехарактерны. Серная кислота образует два ряда солей: средние — сульфаты и кислые — гидросульфаты, а также эфиры. Известны пероксомоносерная (или кислота Каро) H2SO5 и пероксодисерная H2S2O8 кислоты.
Серная кислота реагирует также с основными оксидами, образуя сульфат и воду:
На металлообрабатывающих заводах раствор серной кислоты применяют для удаления слоя оксида металла с поверхности металлических изделий, подвергающихся в процессе изготовления сильному нагреванию. Так, оксид железа удаляется с поверхности листового железа действием нагретого раствора серной кислоты:
Концентрированная H2SO4 превращает некоторые органические вещества в другие соединения углерода:
Качественной реакцией на серную кислоту и её растворимые соли является их взаимодействие с растворимыми солями бария, при котором образуется белый осадок сульфата бария, нерастворимый в воде и кислотах, например:
Применение
Серную кислоту применяют:
Мировое производство серной кислоты около 200 млн тонн в год. Самый крупный потребитель серной кислоты — производство минеральных удобрений. На P₂O₅ фосфорных удобрений расходуется в 2,2—3,4 раза больше по массе серной кислоты, а на (NH₄)₂SO₄ серной кислоты 75 % от массы расходуемого (NH₄)₂SO₄. Поэтому сернокислотные заводы стремятся строить в комплексе с заводами по производству минеральных удобрений.
Токсическое действие
Исторические сведения
Серная кислота известна с древности, встречаясь в природе в свободном виде, например, в виде озёр вблизи вулканов. Возможно, первое упоминание о кислых газах, получаемых при прокаливании квасцов или железного купороса «зеленого камня», встречается в сочинениях, приписываемых арабскому алхимику Джабир ибн Хайяну.
В IX веке персидский алхимик Ар-Рази, прокаливая смесь железного и медного купороса (FeSO4•7H2O и CuSO4•5H2O), также получил раствор серной кислоты. Этот способ усовершенствовал европейский алхимик Альберт Магнус, живший в XIII веке.
Схема получения серной кислоты из железного купороса — термическое разложение сульфата железа (II) с последующим охлаждением смеси
В трудах алхимика Валентина (XIII в) описывается способ получения серной кислоты путём поглощения водой газа (серный ангидрид), выделяющегося при сжигании смеси порошков серы и селитры. Впоследствии этот способ лег в основу т. н. «камерного» способа, осуществляемого в небольших камерах, облицованных свинцом, который не растворяется в серной кислоте. В СССР такой способ просуществовал вплоть до 1955 г.
Алхимикам XV в известен был также способ получения серной кислоты из пирита — серного колчедана, более дешевого и распространенного сырья, чем сера. Таким способом получали серную кислоту на протяжении 300 лет, небольшими количествами в стеклянных ретортах. Впоследствии, в связи с развитием катализа этот метод вытеснил камерный способ синтеза серной кислоты. В настоящее время серную кислоту получают каталитическим окислением (на V2O5) оксида серы (IV) в оксид серы (VI), и последующим растворением оксида серы (VI) в 70 % серной кислоте с образованием олеума.
В России производство серной кислоты впервые было организовано в 1805 году под Москвой в Звенигородском уезде. В 1913 году Россия по производству серной кислоты занимала 13 место в мире.
Дополнительные сведения
Серная кислота (H2SO 4 )
При температуре +10,5°C, серная кислота превращается в застывшую стекловидную кристаллическую массу, подобно губке, поглощающую влагу из окружающей среды. В промышленности и химии серная кислота является одним из основных химических соединений и занимает лидирующие позиции по объему производства в тоннах. Именно поэтому серную кислоту называют «кровью химии». С помощью серной кислоты получают удобрения, лекарственные препараты, другие кислоты, большой ряд химических веществ, удобрений и многое другое.
К концентрированным растворам серной кислоты относятся растворы от 40%, способные растворять серебро или палладий.
К разбавленной серной кислоте относятся растворы, концентрация которых составляет менее 40%. Это не такие активные растворы, но они способны вступать в реакцию с латунью и медью.
Области применения серной кислоты:
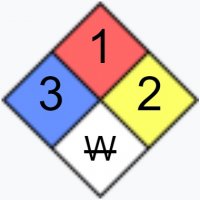
Опасные свойства серной кислоты для человека
Серная кислота представляет повышенную опасность для человеческого организма. Ее токсическое действие наступает не только при непосредственном контакте с кожей, но при вдыхании ее паров, когда происходит выделение сернистого газа.
Опасное воздействие серной кислоты распространяется на:
Интоксикацию организма может усилить мышьяк, который часто входит в состав серной кислоты.
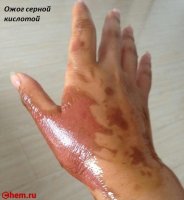
При соприкосновении серной кислоты с кожей происходят сильнейшие ожоги, но не меньшую опасность представляет и отравление парами серной кислоты. Если на слизистые покровы или на кожу попадает серная кислота, появляется сильный ожог, плохо заживающий. Если по масштабу ожог внушительный, у пострадавшего развивается ожоговая болезнь, которая может привести даже к смертельному исходу, если своевременно не будет оказана квалифицированная медицинская помощь.
Предельно допустимая концентрация (ПДК) паров серной кислоты в атмосферном воздухе не должна превышать 0,3 мг/м3 (максимально разовая) и 0,1 мг/м3 (среднесуточная), что соответствует 2-му классу опасности (по ГОСТ 2184-2013).
Вследствие технических неполадок на производстве или неосторожности и массивного выброса в атмосферу может случиться массовое отравление парами серной кислоты. Для предотвращения таких ситуаций применяются газоанализаторы серной кислоты. Газоанализаторы серной кислоты сигнализируют об утечках серной кислоты в цехах химических производств, на складах хранения серной кислоты, при проведении погрузочно-разгрузочных работ, связанных с серной кислотой. Могут применяться в отраслях промышленности, связанных с производством, хранением и использованием серной кислоты.
Ниже в таблице представлены модели газоанализаторов, анализаторов, газосигнализаторов, контролирующих содержание паров серной кислоты (H2SO4) в воздухе.
По территории Республик Башкортостан и Татарстан возможна доставка оборудования КИПиА до склада Покупателя. Доставка в другие регионы России осуществляется посредством транспортных компаний Автотрейдинг и ЖелДорЭкспедиция, в отдельных случаях-службой доставки Даймекс, PONY EXPRESS.
Доставка по России
Уфа
Москва
Санкт-Петербург
Абакан
Альметьевск
Анадырь
Анапа
Арзамас
Армавир
Архангельск
Астрахань
Ачинск
Балаково
Барнаул
Белгород
Белогорск
Березники
Бийск
Биробиджан
Благовещенск
Братск
Брянск
Владивосток
Владикавказ
Владимир
Волгоград
Волжский
Вологда
Воронеж
Глазов
Екатеринбург
Иваново
Ижевск
Иркутск
Ишимбай
Йошкар-Ола
Казань
Калуга
Кемерово
Кипарисово
Киров
Комсомольск
Кострома
Краснодар
Красноярск
Курган
Курск
Кызыл
Лабытнанги
Липецк
Магадан
Магнитогорск
Майкоп
Махачкала
Миасс
Мурманск
Набережные Челны
Нальчик
Нерюнгри
Нефтекамск
Нефтеюганск
Нижневартовск
Нижний Тагил
Новгород
Новокузнецк
Новороссийск
Новосибирск
Новый Уренгой
Ноябрьск
Омск
Оренбург
Орск
Орёл
Пенза
Пермь
Петрозаводск
Петропавловск
Псков
Пятигорск
Ростов
Рубцовск
Рязань
Салават
Салехард
Самара
Саранск
Саратов
Сахалинск
Севастополь
Северодвинск
Симферополь
Смоленск
Сосногорск
Сочи
Ставрополь
Стерлитамак
Сургут
Сызрань
Сыктывкар
Таганрог
Тамбов
Тверь
Тобольск
Тольятти
Томск
Тула
Тюмень
Улан-Удэ
Ульяновск
Усть-Илимск
Хабаровск
Ханты-Мансийск
Чайковский
Чебоксары
Челябинск
Череповец
Черкесск
Чита
Шахты
Южно-Сахалинск
Якутск
Ялта
Ярославль