какая кислота соответствует оксиду so2
Оксиды серы. Серная кислота
Сера с кислородом образует два оксида: SO2 – оксид серы (IV) и SO3 – оксид серы (VI).
Оксид серы (IV) — SO2 (сернистый газ, сернистый ангидрид)
Сернистый газ – это бесцветный газ с резким запахом, ядовит. Тяжелее воздуха более чем в два раза. Хорошо растворяется в воде. При комнатной температуре в одном объёме воды растворяется около 40 объёмов сернистого газа, при этом образуется сернистая кислота H2SO3.
Химические свойства
Сернистый газ – типичный кислотный оксид. Он взаимодействует:
а) с основаниями, образуя два типа солей: кислые (гидросульфиты) и средние (сульфиты):
б) с основными оксидами:
Сернистая кислота существуют только в растворе, относится к двухосновным кислотам. Сернистая кислота обладает всеми общими свойствами кислот.
Окислительно – восстановительные свойства
В окислительно-восстановительных процессах сернистый газ может быть как окислителем, так и восстановителем, потому что атом серы в этом соединении имеет промежуточную степень окисления +4.
Как окислитель SO2 реагирует с более сильными восстановителями, например с сероводородом:
Как восстановитель SO2 реагирует с более сильными окислителями, например с кислородом в присутствии катализатора, с хлором и т.д.:
Получение
1) Сернистый газ образуется при горении серы:
2) В промышленности его получают при обжиге пирита:
3) В лаборатории сернистый газ можно получить:
а) при действии кислот на сульфиты:
б) при взаимодействии концентрированной серной кислоты с тяжелыми металлами:
Применение
Сернистый газ находит широкое применение в текстильной промышленности для отбеливания различных изделий. Кроме того, его используют в сельском хозяйстве для уничтожения вредных микроорганизмов в теплицах и погребах. В больших количествах SO2 идет на получение серной кислоты.
Оксид серы (VI) – SO3 (серный ангидрид)
Серный ангидрид SO3 – это бесцветная жидкость, которая при температуре ниже 17 о С превращается в белую кристаллическую массу. Очень хорошо поглощает влагу (гигроскопичен).
Химические свойства
Как типичный кислотный оксид серный ангидрид взаимодействует:
а) с основаниями, образуя два типа солей – кислые (гидросульфиты) и средние (сульфаты):
Особым свойством SO3 является его способность хорошо растворяться в серной кислоте. Раствор SO3 в серной кислоте имеет название олеум.
Оксид серы (VI) характеризуется сильными окислительными свойствами (обычно восстанавливается до SO2):
Получение и применение
Серный ангидрид образуется при окислении сернистого газа:
В чистом виде серный ангидрид практического значения не имеет. Он получается как промежуточный продукт при производстве серной кислоты.
Серная кислота H2SO4
Упоминания о серной кислоте впервые встречаются у арабских и европейских алхимиков. Ее получали, прокаливая на воздухе железный купорос (FeSO4∙7H2O): 2FeSO4 = Fe2O3 + SO3↑ + SO2↑ либо смесь серы с селитрой: 6KNO3 + 5S = 3K2SO4 + 2SO3↑ + 3N2↑, а выделяющиеся пары серного ангидрида конденсировали. Поглощая влагу, они превращались в олеум. В зависимости от способа приготовления H2SO4 называли купоросным маслом или серным маслом. В 1595 г. алхимик Андреас Либавий установил тождественность обоих веществ.
Долгое время купоросное масло не находило широкого применения. Интерес к нему сильно возрос после того, как в XVIII в. был открыт процесс получения из индиго индигокармина – устойчивого синего красителя. Первую фабрику по производству серной кислоты основали недалеко от Лондона в 1736 г. Процесс осуществляли в свинцовых камерах, на дно которых наливали воду. В верхней части камеры сжигали расплавленную смесь селитры с серой, затем туда запускали воздух. Процедуру повторяли до тех пор, пока на дне ёмкости не образовывалась кислота требуемой концентрации.
В XIX в. способ усовершенствовали: вместо селитры стали использовать азотную кислоту (она при разложении в камере даёт NO2). Чтобы возвращать в систему нитрозные газы были сконструированы специальные башни, которые и дали название всему процессу – башенный процесс. Заводы, работающие по башенному методу, существуют и в наше время.

Серная кислота – это тяжелая маслянистая жидкость без цвета и запаха, гигроскопична; хорошо растворяется в воде. При растворении концентрированной серной кислоты в воде выделяется большое количество тепла, поэтому ее надо осторожно приливать в воду (а не наоборот!) и перемешивать раствор.
Раствор серной кислоты в воде с содержанием H2SO4 менее 70% обычно называют разбавленной серной кислотой, а раствор более 70% — концентрированной серной кислотой.
Химические свойства
Разбавленная серная кислота проявляет все характерные свойства сильных кислот. Она реагирует:
Процесс взаимодействия ионов Ва 2+ с сульфат-ионами SO4 2+ приводит к образованию белого нерастворимого осадка BaSO4. Это качественная реакция на сульфат-ион.
Окислительно – восстановительные свойства
В разбавленной серной кислоте растворяются металлы, которые в электрохимическом ряду напряжений находятся до водорода. При этом образуются сульфаты металлов и выделяется водород:
Металлы, которые в электрохимическом ряду напряжений находятся после водорода, не реагируют с разбавленной серной кислотой:
Концентрированная серная кислота является сильным окислителем, особенно при нагревании. Она окисляет многие металлы, неметаллы и некоторые органические вещества.
При взаимодействии концентрированной серной кислоты с металлами, которые в электрохимическом ряду напряжений находятся после водорода (Cu, Ag, Hg), образуются сульфаты металлов, а также продукт восстановления серной кислоты – SO2.

Более активными металлами (Zn, Al, Mg) концентрированная серная кислота может восстанавливаться до свободной серы или сероводорода. Например, при взаимодействии серной кислоты с цинком, магнием, алюминием в зависимости от концентрации кислоты одновременно могут образовываться различные продукты восстановления серной кислоты – SO2, S, H2S:
На холоде концентрированная серная кислота пассивирует некоторые металлы, например алюминий и железо, поэтому ее перевозят в железных цистернах:
Концентрированная серная кислота окисляет некоторые неметаллы (серу, углерод и др.), восстанавливаясь до оксида серы (IV) SO2:
Получение и применение

В промышленности серную кислоту получают контактным способом. Процесс получения происходит в три стадии:
Полученный олеум перевозят в железных цистернах. Из олеума получают серную кислоту нужной концентрации, приливая его в воду. Это можно выразить схемой:
Серная кислота находит разнообразное применение в самых различных областях народного хозяйства. Ее используют для осушки газов, в производстве других кислот, для получения удобрений, различных красителей и лекарственных средств.
Соли серной кислоты

Большинство сульфатов хорошо растворимы в воде (малорастворим CaSO4, еще менее PbSO4 и практически нерастворим BaSO4). Некоторые сульфаты, содержащие кристаллизационную воду, называются купоросами:
CuSO4 ∙ 5H2O медный купорос
FeSO4 ∙ 7H2O железный купорос
Соли серной кислоты имеют все общие свойства солей. Особенным является их отношение к нагреванию.
Сульфаты активных металлов (Na, K, Ba) не разлагаются даже при 1000 о С, а других (Cu, Al, Fe) – распадаются при небольшом нагревании на оксид металла и SO3:
Скачать:
Скачать бесплатно реферат на тему: «Производство серной кислоты контактным способом» Производство-серной-кислоты-контактным-способом.docx (232 Загрузки)
Скачать рефераты по другим темам можно здесь
*на изображении записи фотография медного купороса
Похожее
Добавить комментарий Отменить ответ
Репетитор по химии. Занятия проходят онлайн по Скайпу. По всем вопросам пишите в Ватсапп: +7 928 285 70 42
Классификация неорганических веществ
Среди простых веществ выделяют металлы и неметаллы. Среди сложных: оксиды, основания, кислоты и соли. Классификация неорганических веществ построена следующим образом:
Большинство химических свойств мы изучим по мере продвижения по периодической таблице Д.И. Менделеева. В этой статье мне хотелось бы подчеркнуть ряд принципиальных деталей, которые помогут в дальнейшем при изучении химии.
Оксиды
Все оксиды подразделяются на солеобразующие и несолеобразующие. Солеобразующие имеют соответствующие им основания и кислоты (в той же степени окисления (СО)!) и охотно вступают в реакции солеобразования. К ним относятся, например:
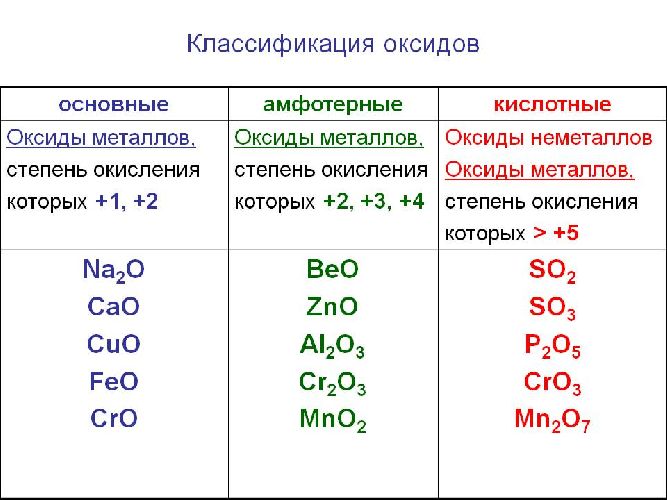
Солеобразующие оксиды, в свою очередь, делятся на основные, амфотерные и кислотные.
Основным оксидам соответствуют основания в той же СО. В химических реакциях основные оксиды проявляют основные свойства, образуются исключительно металлами. Примеры: Li2O, Na2O, K2O, Rb2O CaO, FeO, CrO, MnO.
Основные оксиды взаимодействуют с водой с образованием соответствующего основания (реакцию идет, если основание растворимо) и с кислотными оксидами и кислотами с образованием солей. Между собой основные оксиды не взаимодействуют.
Li2O + H2O → LiOH (основный оксид + вода → основание)
Здесь не происходит окисления/восстановления, поэтому сохраняйте исходные степени окисления атомов.
Эти оксиды действительно имеют двойственный характер: они проявляют как кислотные, так и основные свойства. Примеры: BeO, ZnO, Al2O3, Fe2O3, Cr2O3, MnO2, PbO, PbO2, Ga2O3.
С водой они не взаимодействуют, так как продукт реакции, основание, получается нерастворимым. Амфотерные оксиды реагируют как с кислотами и кислотными оксидами, так и с основаниями и основными оксидами.
ZnO + KOH + H2O → K2[Zn(OH)4] (амф. оксид + основание = комплексная соль)
ZnO + N2O5 → Zn(NO3)2 (амф. оксид + кисл. оксид = соль; СО азота сохраняется в ходе реакции)
Fe2O3 + HCl → FeCl3 + H2O (амф. оксид + кислота = соль + вода; обратите внимание на то, что СО Fe = +3 не меняется в ходе реакции)
Проявляют в ходе химических реакций кислотные свойства. Образованы металлами и неметаллами, чаще всего в высокой СО. Примеры: SO2, SO3, P2O5, N2O3, NO2, N2O5, SiO2, MnO3, Mn2O7.
Кислотные оксиды вступают в реакцию с основными и амфотерными, реагируют с основаниями. Реакции между кислотными оксидами не характерны.
SO2 + Na2O → Na2SO3 (кисл. оксид + осн. оксид = соль; сохраняем СО S = +4)
SO3 + Li2O → Li2SO4 (кисл. оксид + осн. оксид = соль; сохраняем СО S = +6)
P2O5 + NaOH → Na3PO4 + H2O (кисл. оксид + основание = соль + вода)
Реакции несолеобразующих оксидов с основаниями, кислотами и солеобразующими оксидов редки и не приводят к образованию солей. Некоторые из несолеобразующих оксидов используют в качестве восстановителей:
FeO + CO → Fe + CO2 (восстановление железа из его оксида)
Основания
Основания классифицируются по количеству гидроксид-ионов в молекуле на одно-, двух- и трехкислотные.
Так же, как и оксиды, основания различаются по свойствам. Все основания хорошо реагируют с кислотами, даже нерастворимые основания способны растворяться в кислотах. Также нерастворимые основания при нагревании легко разлагаются на воду и соответствующий оксид.
Mg(OH)2 → (t) MgO + H2O (при нагревании нерастворимые основания легко разлагаются)
Если в ходе реакции основания с солью выделяется газ, выпадает осадок или образуется слабый электролит (вода), то такая реакция идет. Нерастворимые основания с солями почти не реагируют.
Ba(OH)2 + NH4Cl → BaCl2 + NH3 + H2O (в ходе реакции образуется нестойкое основание NH4OH, которое распадается на NH3 и H2O)
KOH + BaCl2 ↛ реакция не идет, так как в продуктах нет газа/осадка/слабого электролита (воды)
В растворах щелочей pH > 7, поэтому лакмус окрашивает их в синий цвет.
Al(OH)3 + HCl → AlCl3 + H2O (амф. гидроксид + кислота = соль + вода)
Al(OH)3 + KOH → K[Al(OH)4] (амф. гидроксид + основание = комплексная соль)
При нагревании до высоких температур комплексные соли не образуются.
Кислоты
Кислоты отлично реагируют с основными оксидами, основаниями, растворяя даже те, которые выпали в осадок (реакция нейтрализации). Также кислоты способны вступать в реакцию с теми металлами, которые стоят в ряду напряжений до водорода (то есть способны вытеснить его из кислоты).
Zn + HCl → ZnCl2 + H2↑ (реакция идет, так как цинк стоил в ряду активности левее водорода и способен вытеснить его из кислоты)
Cu + HCl ↛ (реакция не идет, так как медь расположена в ряду активности правее водорода, менее активна и не способна вытеснить его из кислоты)
Все кислоты подразделяются на сильные и слабые. Напомню, что мы составили подробную таблицу сильных и слабых кислот (и оснований!) в теме гидролиз. В реакции из сильной кислоты (соляной) можно получить более слабую, например, сероводородную или угольную кислоту.
В завершении подтемы кислот предлагаю вам вспомнить названия основных кислот и их кислотных остатков.
Блиц-опрос по теме Классификация неорганических веществ
Кислотные оксиды

Всего получено оценок: 1195.
Всего получено оценок: 1195.
Оксиды – сложные вещества, состоящие из двух элементов, один из которых кислород. В названиях оксидов сначала указывают слово оксид, затем название второго элемента, которым он образован. Какие особенности имеют кислотные оксиды, и чем они отличаются от других видов оксидов?
Классификация оксидов
Оксиды делятся на солеобразующие и несолеобразующие. Уже по названию ясно, что несолеобразующие не образуют солей. Таких оксидов немного : это вода H2 O, фторид кислорода OF2 (если условно его считать оксидом), угарный газ, или оксид углерода (II), монооксид углерода CO; оксиды азота (I) и (II): N2 O (оксид диазота, веселящий газ) и NO (монооксид азота).
Солеобразующие оксиды образуют соли при взаимодействии с кислотами или щелочами. В качестве гидроксидов им соответствуют основания, амфотерные основания и кислородосодержащие кислоты. Соответственно они называются основными оксидами (например, CaO), амфотерными оксидами (Al2 O3 ) и кислотными оксидами, или ангидридами кислот (CO2).
Основные свойства кислотных оксидов
Типичными реакциями являются взаимодействие кислотных оксидов с основаниями в результате чего образуется соль и вода:
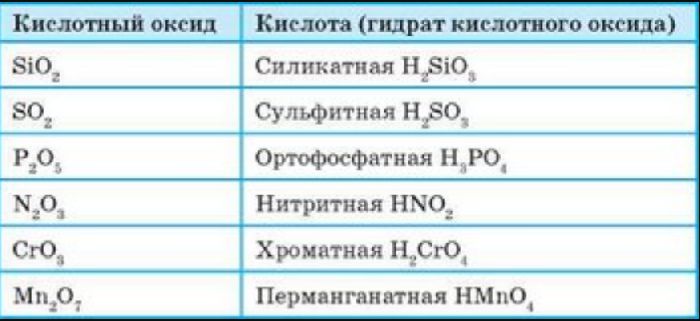
Все кислотные оксиды, кроме диоксида кремния SiO2 (кремниевый ангидрид, кремнезем), реагируют с водой, образуя кислоты:
Кислотные оксиды образуются при взаимодействии с кислородом простых и сложных веществ (S+O2 =SO2 ), либо при разложении в результате нагревания сложных веществ, содержащих кислород, – кислот, нерастворимых оснований, солей (H2 SiO3 =SiO2 +H2 O).
Список кислотных оксидов:
| Название кислотного оксида | Формула кислотного оксида | Свойства кислотного оксида |
| Оксид серы (IV) | SO2 | бесцветный токсичный газ с резким запахом |
| Оксид серы (VI) | SO3 | легколетучая безцветная токсичная жидкость |
| Оксид углерода (IV) | CO2 | бесцветный газ без запаха |
| Оксид кремния (IV) | SiO2 | бесцветные кристаллы, обладающие прочностью |
| Оксид фосфора (V) | P2 O5 | белый легковозгораемый порошок с неприятным запахом |
| Оксид азота (V) | N2 O5 | вещество, состоящее из бесцветных летучих кристаллов |
| Оксид хлора (VII) | Cl2 O7 | бесцветная маслянистая токсичная жидкость |
| Оксид марганца (VII) | Mn2 O7 | жидкость с металлическим блеском, являющаяся сильным окислителем. |
Что мы узнали?
Кислотные оксиды относятся к солеобразующим оксидам и образуются с помощью кислот. Кислотные оксиды вступают в реакции с основаниями и водой, а их образование происходит при нагревании и разложении сложных веществ.
Урок №43. Оксиды: классификация, номенклатура, свойства, получение, применение
Сегодня мы начинаем подробное знакомство с важнейшими классами неорганических соединений. Неорганические вещества по составу делятся, как вы уже знаете, на простые (металлы и неметаллы) и сложные:
А – кислотный остаток
ОН – гидроксильная группа
Сложные неорганические вещества подразделяют на четыре класса: оксиды, кислоты, основания, соли. Мы начинаем с класса оксидов.
ОКСИДЫ
оксид углерода ( II )
оксид марганца (VII )
Классификация оксидов
Все оксиды можно разделить на две группы: солеобразующие (основные, кислотные, амфотерные) и несолеобразующие или безразличные.
4). Несолеобразующие оксиды – это оксиды безразличные к кислотам и основаниям. К ним относятся оксиды неметаллов с валентностью I и II (Например, N 2 O, NO, CO).
Вывод: характер свойств оксидов в первую очередь зависит от валентности элемента.
Например, оксиды хрома:
Классификация по растворимости в воде
Кислотные оксиды
(не растворим в воде)
Основные оксиды
В воде растворяются только оксиды щелочных и щелочноземельных металлов
Амфотерные оксиды
С водой не взаимодействуют.
В воде не растворимы
Выполните задания:
1. Выпишите отдельно химические формулы солеобразующих кислотных и основных оксидов.
Выпишите оксиды и классифицируйте их.
Физические свойства оксидов
Химические свойства оксидов
ХИМИЧЕСКИЕ СВОЙСТВА ОСНОВНЫХ ОКСИДОВ
1. Основной оксид + Кислотный оксид = Соль (р. соединения)
3K 2 O + 2H 3 PO 4 = 2K 3 PO 4 + 3H 2 O
Na 2 O + H 2 O = 2NaOH
ХИМИЧЕСКИЕ СВОЙСТВА КИСЛОТНЫХ ОКСИДОВ
2. Кислотный оксид + Основание = Соль + Н 2 О (р. обмена)
P 2 O 5 + 6KOH = 2K 3 PO 4 + 3H 2 O
3. Основной оксид + Кислотный оксид = Соль (р. соединения)
4. Менее летучие вытесняют более летучие из их солей
CaCO 3 + SiO 2 = CaSiO 3 +CO 2
ХИМИЧЕСКИЕ СВОЙСТВА АМФОТЕРНЫХ ОКСИДОВ
Взаимодействуют как с кислотами, так и со щелочами.
ZnO + 2 HCl = ZnCl 2 + H 2 O
ZnO + 2 NaOH + H 2 O = Na 2 [Zn(OH) 4 ] ( в растворе)
ZnO + 2 NaOH = Na 2 ZnO 2 + H 2 O (при сплавлении)
Применение оксидов
Некоторые оксиды не растворяются в воде, но многие вступают с водой в реакции соединения:
В результате часто получаются очень нужные и полезные соединения. Например, H 2 SO 4 – серная кислота, Са(ОН) 2 – гашеная известь и т.д.
Если оксиды нерастворимы в воде, то люди умело используют и это их свойство. Например, оксид цинка ZnO – вещество белого цвета, поэтому используется для приготовления белой масляной краски (цинковые белила). Поскольку ZnO практически не растворим в воде, то цинковыми белилами можно красить любые поверхности, в том числе и те, которые подвергаются воздействию атмосферных осадков. Нерастворимость и неядовитость позволяют использовать этот оксид при изготовлении косметических кремов, пудры. Фармацевты делают из него вяжущий и подсушивающий порошок для наружного применения.
Такими же ценными свойствами обладает оксид титана (IV) – TiO 2 . Он тоже имеет красивый белый цвет и применяется для изготовления титановых белил. TiO 2 не растворяется не только в воде, но и в кислотах, поэтому покрытия из этого оксида особенно устойчивы. Этот оксид добавляют в пластмассу для придания ей белого цвета. Он входит в состав эмалей для металлической и керамической посуды.
Оксид хрома (III) – Cr 2 O 3 – очень прочные кристаллы темно-зеленого цвета, не растворимые в воде. Cr 2 O 3 используют как пигмент (краску) при изготовлении декоративного зеленого стекла и керамики. Известная многим паста ГОИ (сокращение от наименования “Государственный оптический институт”) применяется для шлифовки и полировки оптики, металлических изделий, в ювелирном деле.













