какая кислота в батарейках
Какая кислота в батарейках
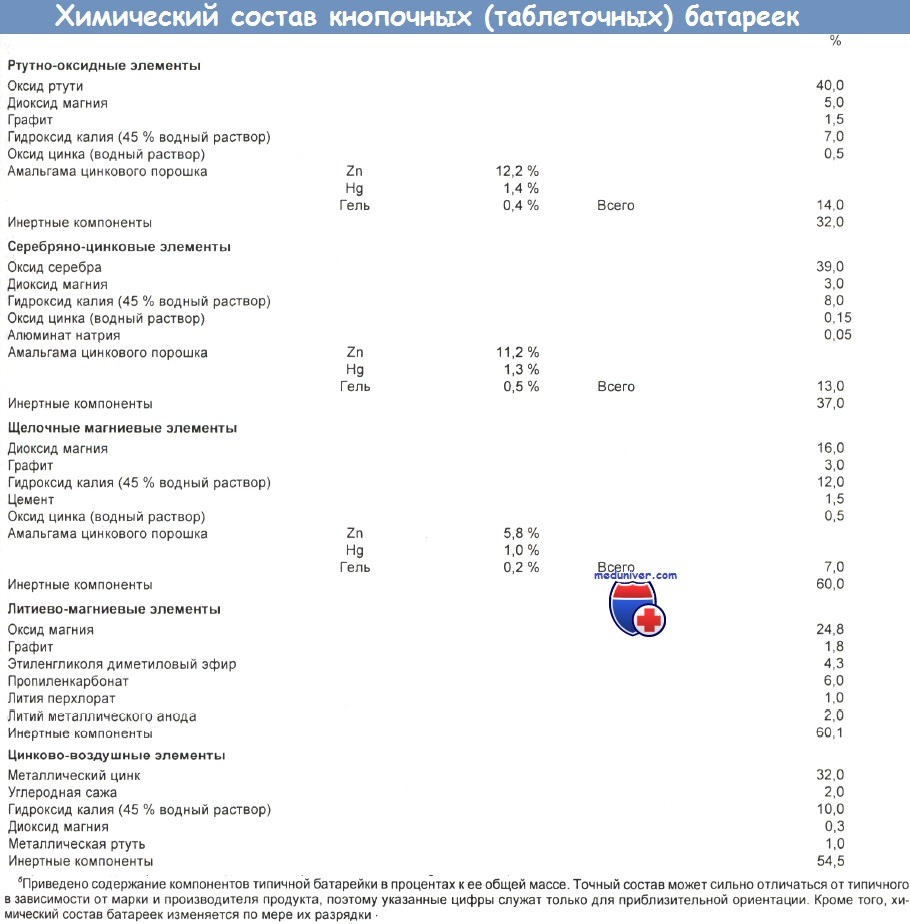
Оксид ртути удлиняет срок службы и улучшает рабочие характеристики батареек, но одновременно повышает их потенциальную токсичность. Типичный ртутно-оксидный элемент содержит 15—50 % этого вещества, а это эквивалентно от 0,09 до 21 г ртути (1—5 г в среднем). Электролит представляет собой 40—45 % раствор гидроксида натрия или калия, однако на него обычно приходится не более 13 % массы батарейки.
В состав батареек входят различные соединения тяжелых металлов (гидроксиды лития и никеля, диоксид марганца, оксиды ртути, цинка, серебра и кадмия), а также едкие щелочи.
Диаметр кнопочных (таблеточных, галетных) элементов составляет от 8 до 25 мм. Их размер — важный фактор воздействия на пищевод: большинство случаев его прободения вызвано батарейками с диаметром более 18 мм (т. е. крупнее монеты достоинством 10 копеек). Сообщалось, что батарейки диаметром 15—23 мм застревают в пищеводе, а диаметром 7,9 мм могут задерживаться там. Ни размер элемента, ни симптомы не позволяют судить о его локализации в этом отделе пищеварительного тракта.
а) Гистопатология отравления батарейками. Все известные на сегодняшний день тяжелые осложнения при проглатывании батареек связаны с некротизацией тканей. Кнопочный щелочной элемент для фотокамеры размером 22 х 5 мм, задержавшийся на 4 сут в пищеводе 16-месячного ребенка, привел к влажному некрозу и летальному прободению. Щелочная батарейка для кинокамеры размером 25 х 5 мм, пробыв в пищеводе 24 ч, несмотря на стероидную терапию, вызвала образование летального трахейно-пищеводного свища.
Votteler и соавт. сообщают о несмертельном случае такого же свищеобразования при воздействии на пищевод кнопочного элемента с появлением язвы, внешне похожей на сухой некроз и окруженной черным осадком. Батарейка для слухового аппарата размером 15 х 8 мм задержалась в меккелевом дивертикуле, вызвав через 2 сут некроз, кровотечение и прободение, потребовавшие резекции тонкой кишки.
б) Механизм отравления батарейками. Механизм эрозии слизистой оболочки, вероятно, многофакторный. Щелочной электролит с 40—45 % гидроксида калия соответствует раствору едкой щелочи с концентрацией примерно 8 N, вызывающему влажный некроз у подопытных животных. Возможно спонтанное протекание электролита из швов батарейки, особенно после коррозионного действия желудочной кислоты на оболочку элемента. Задержка на слизистой оболочке приводит к кумулятивному местному эффекту, резко отличному от влияния свободно проходящего по тракту едкого электролита, который разбавляется пищеварительными соками.
Образование гидроксида на поверхности анода может способствовать некротизации, и исследования на животных показывают, что самый сильный ожог возникает около него — вдоль пластиковой перемычки между двумя полюсами. Богатая электролитами жидкость пищеварительного тракта представляет собой подходящую среду для проведения тока между анодом и катодом. В течение 10 с в 1 N растворе NaCl рН индикаторной бумажной полоски, соединяющей положительный и отрицательный полюса кнопочной батарейки, достиг 11.
К двум названным механизмам, возможно, добавляется некротизация, вызванная сдавливанием, однако типичная картина влажного некроза при вскрытии говорит, что сдавливание по крайней мере является не единственным патофизиологическим механизмом.
в) Интоксикация тяжелыми металлами при отравлении батарейками. Опасения вызывает прежде всего ртутная интоксикация, поскольку в кнопочных батарейках присутствует определенное количество неорганической ртути. Однако, хотя по крайней мере 17 батареек, извлеченных из пищеварительного тракта пациентов, подверглось коррозии или треснуло, лишь в одном случае отмечен слегка повышенный бессимптомный уровень этого металла в биологических жидкостях.
В сыворотке концентрация ртути составляла 19 мкг/100 мл (при норме ниже 5 мкг/100 мл), а в моче — 98 мкг/л (при норме ниже 50 мкг/л). Токсичные и летальные уровни оксида ртути для человека неизвестны, однако Lewis сообщает, что для крыс пероральная летальная доза (ЛД50) равна 18 мг/кг. Скрининг на ртуть в нескольких случаях извлечения из организма расколотых кнопочных батареек дал отрицательные результаты. Оксид ртути обладает едким действием, однако плохо растворим и всасывается медленно. Желудочная кислота может еще сильнее ограничивать всасывание, восстанавливая оксид до нерастворимой металлической ртути, потенциал проникновения которой в кровь минимален.
Коррозия железа в ободочках кнопочных батареек, по-видимому, катализирует этот процесс, протекающий в пищеварительном тракте практически полностью.
г) Клиника отравления батарейками. Наличие желудочно-кишечных симптомов должно вызывать подозрение на некроз и прободение, поскольку свободное прохождение кнопочных батареек по пищеварительному тракту протекает в большинстве случаев бессимптомно. У пациентов с пораженным пищеводом наблюдаются лихорадка, затрудненное и болезненное глотание, рвота, тахипноэ и болезненность живота при пальпации. При прободении меккелева дивертикула возникают перемежающиеся боли в животе, его болезненность при движении и нажатии, а также рвота.
Треснувшие кнопочные батарейки обусловливают бессимптомный черный немеланотический стул, незначительное желудочно-кишечное кровотечение, слабо выраженную рвоту, анорексию и вялость. Симптомы ртутного отравления после проглатывания кнопочных элементов никогда не описывались. Черный цвет кала чаще всего определяется осадком элементарной ртути, а не желудочно-кишечным кровотечением. Нестабильность жизненно важных показателей отмечалась в двух случаях прободения дуги аорты с последующим кровотечением. Время прохождения батареек по пищеварительному тракту варьирует от 14 ч до 7 сут. Их присутствие в организме может помешать снятию электрокардиограммы.
На основе изучения случаев проглатывания более 2000 кнопочных и 62 цилиндрических батареек Litovitz Schmitz делают следующие выводы:
1. Подавляющее большинство пациентов чувствуют себя удовлетворительно; лишь у 10 % появляются симптомы, и только у двоих наблюдались серьезные осложнения (стриктуры, потребовавшие расширения).
2. Особую проблему представляют элементы для слуховых аппаратов: на их долю приходится 44,6 % всех случаев проглатывания, причем в 32,8 % из них аппарат принадлежал ребенку, проглотившему из него батарейку.
3. Размер элемента и отсутствие симптомов не являются надежными критериями его свободного прохождения через пищевод; для подтверждения требуется рентгенологическое исследование.
4. Взрослые глотают батарейки, как правило, если держат их во рту, пока заняты руки.
5. Ртутно-оксидные элементы чаще всех остальных батареек разрушаются в пищеварительном тракте; самыми прочными являются цинково-воздушные батарейки.
6. Вероятно, опаснее других литиевые батарейки — из-за их более крупных размеров и относительно высокой разности потенциалов.
7. Сироп ипекакуаны бесполезен: благодаря рвоте удалось удалить лишь 1 батарейку из 37 проглоченных, а у 1 пациента батарейка переместилась из желудка в пищевод и там застряла.
8. Эндоскопия как способ извлечения батареек была успешной в 90 % случаев, если очищался пищевод, но только в 42,5 % случаев, когда речь шла о желудке. Возможно, она показана лишь при задержке батареек в пищеводе или при их неспособности преодолеть привратник спустя длительный период наблюдения. Из 16 батареек, выявленных в пищеводе при первой рентгенографии, 7 спонтанно прошло в желудок; непосредственно перед планируемой эндоскопией следует повторно сделать рентгеновский снимок, чтобы убедиться в целесообразности этой процедуры.
9. Для простого удаления батарейки хирургическое вмешательство если и стоит применять, то лишь в исключительных случаях.
10. Большинство попадающих в пищеварительный тракт батареек уже разряжено: 52,5 % проглатывается сразу после извлечения из электроприбора, 41,4 % — спустя некоторое время (забыли выбросить) и только 5,4 % — до использования. Собранные данные не позволяют судить, опаснее ли новые батарейки, чем отслужившие свой срок.
11. С точки зрения клинического исхода мелкие цилиндрические батарейки не опаснее кнопочных.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Почему батарейки нельзя выбрасывать
Содержание
Содержание
На каждой батарейке или аккумуляторе питания всегда нарисована перечеркнутая урна. Про экологию и токсичность говорят сейчас много, но почему же батарейки — эти маленькие и безобидные на вид элементы питания — все-таки нельзя выбрасывать в урну и что с ними тогда делать?
Что опасного в батарейках?
Для начала разберемся, что у нас содержится внутри батареек. Не будем вдаваться в подробности механизма работы, но запомним основное — это элемент питания, под оболочкой которого мы имеем имеет анод и катод, погруженные в электролит и вступающие в химические реакции для выработки электрического тока.
В этом материале мы не станем оценивать характеристики батареек по работоспособности и эффективности. Нас интересует только внутренний состав «ингредиентов».
Батарейки бывают нескольких типов:
Солевые — самые первые и простые батарейки. Анод состоит из смеси диоксида марганца с электролитом. В качестве электролита раньше выступал хлорид аммония, сейчас в основном хлорид цинка иногда с добавкой хлорида кальция.
Щелочные (алкалиновые) батарейки в составе электролита имеют, как понятно из названия, щелочь. Здесь мы имеем анод из цинка, гидроксида калия, катод из диоксида марганца.
Литиевые основаны на литиевом катоде и органическом электролите. В составе также оксиды марганца и меди, серы, дисульфид железа, хлористый тионил.
Оксид-серебряные батарейки подразумевают в составе оксид серебра в виде катода, цинковый анод, щелочной электролит и еще гидроксиды натрия и каля в придачу.
Воздушно-цинковые батарейки — это гидроксид калия либо раствор хлорида цинка в электролите и цинковый катод.
Но и это не все. В целом, в зависимости от типа батарейки, мы получаем под корпусом занятный компот: свинец, литий, марганец, никель, натрий, кадмий, титан, иногда ртуть. Не самый приятный и совершенно точно токсичный набор элементов.
Если вы уже в ужасе побежали вытаскивать батарейки из всех приборов, погодите. Пока вы держите батарейку в руках, пользуетесь ей в приборе — она не опасна. Когда весь букет токсичности прочно спрятан в корпус элемента питания — никакой угрозы для вас или окружающего пространства батарейка не представляет.
От одной выброшенной батарейки вреда ведь не будет?
Было бы здорово так думать, но на планете живет не один человек, а почти 8 миллиардов. По статистике Роспотребнадзора, только в Москве в среднем ежегодно выбрасывается порядка двух тысяч тонн батареек.
В чем же тогда проблема, если сама по себе батарейка не особо страшна? Отдыхая годами на свалке, корпус батарейки разрушается, и все токсичные соединения отправляются на волю. Либо они попадают в почву и грунтовые воды, либо прямиком в атмосферу, если батарейку сожгли. И все наши токсичные товарищи совершают долгое путешествие, отравляющее все на своем пути.
А теперь давайте разберемся, что такого вредного в основных токсичных элементах.
Свинец — как тяжелый металл, вреден в любых количествах, попадающих в организм. Накапливается в мозге, печени, почках, костях. Особенно опасен для детей и внутриутробного развития, вызывая нарушения в работе мозга и центральной нервной системы, снижение умственного развития.
Литий — в чистом виде для человека угрозы не представляет, так как литий сам по себе в небольшой концентрации и так содержится во всех тканях организма. Мы потребляем его с едой, и некоторые лекарственные психотропные препараты содержат литий в том числе. Но превышение нормы лития и интоксикация его соединениями вызывает нарушения в опорно-двигательном аппарате, тормозит ЦНС и работу щитовидной железы.
Марганец — тоже сам по себе не особо токсичен и участвует во многих обменных процессах организма. А вот оксид марганца — такая себе история. Разлагается он только при температуре от 535 градусов, и что точно не стоит делать — так это вдыхать его, так как интоксикация оксидом марганца приводит к поражению мозга.
Никель — вообще-то, ваша поджелудочная железа содержит никель. Но это не отменяет того факта, что никель и его соединения токсичны. В основном его избыток вызывает кожные реакции — дерматиты, витилиго.
Ртуть — вы наверняка про нее знаете, она чрезвычайно токсична и для человека, и для животных. ЦНС, пищеварительная и иммунная системы, дыхательные пути, почки, кожа, глаза — это все поражается ртутью. Наиболее уязвим к ее воздействию внутриутробный плод. Всемирная Организация Здравоохранения признает ртуть одним из десяти химических элементов, представляющих опасность и проблему для здоровья человечества.
Кадмий — токсичен так же, как ртуть или мышьяк. Вдыхать или есть кадмий точно не стоит. Поражает дыхательные пути, ЦНС, желудочно-кишечный тракт, нарушает работу печени и почек. Даже сотых долей грамма соединений кадмия уже достаточно для острого отравления.
И это мы говорим только о том, как эти элементы влияют непосредственно на человека. Но стоит помнить и о токсичности для растений и животных. Например, высокая концентрация кадмия в водоемах вызывает отравление воды и массовую гибель рыбы. Литий химически активен и быстро вступает в реакции в почве и воде. Никель, накапливаясь в почве, вызывает болезни и гибель животных, дегенерацию растений. Природа «болеет» и к тому же становится отличным проводником всех вредных элементов к человеку. Рыба и моллюски с высоким содержанием ртути — уже не редкость, как и вода с повышенным содержанием тяжелых металлов.
А что тогда с ними делать?
Итак, вы уже наверняка достаточно убедились, что даже одна батарейка стоит вашего внимания. Что с ней делать? Не выбрасывать в мусорное ведро!
В каждом городе есть пункты приема батареек и других элементов питания, которые впоследствии отправляются на утилизацию. Например, на сайте компании «Мегаполисресурс», которая занимается в России переработкой батареек, есть удобная карта городов, на которой отмечены все пункты приема и адреса. Просто выберите свой город и посмотрите, куда можно отнести свои отжившие элементы питания — очень часто это обычные магазины, торговые центры.
Найти пункт приема можно также на сайте Duracell — крупнейшего мирового производителя батареек. Именно они стали инициатором экологического проекта по утилизации батареек, к которому подключились российские экологические предприятия, компании, школы.
Бегать сдавать по одной батарейке неудобно. Проще всего организовать хранение использованных батареек у себя дома в отдельном контейнере. Но помните, что в некоторых пунктах приема есть ограничения. Например, до 20 батареек с человека.
Их точно переработают?
До сих пор многие считают утилизацию бесполезным занятием. Мол, потом все отходы все равно попадают на свалку и точно также там валяются или, того хуже, сжигаются, отравляя атмосферу. На самом деле, это не так.
Да, с батарейками дело обстоит достаточно сложно. Даже в Европе есть всего несколько заводов, производящих переработку элементов питания. В России на данный момент основных точек пока только две — завод «Мегаполисресурс» в Челябинске и «Национальная экологическая компания» в Ярославле. Правда, по данным «Российской газеты», к 2024 году в России планируется организовать до семи экологических предприятий.
В начале 2020 года российский филиал Duracell отчитался, что в ходе своего экологического проекта только с мая по октябрь 2019 года на утилизацию в «Мегаполисресурс» были отправлены 30 тонн батареек.
Сейчас батарейки не утилизируются полностью, а возвращаются дальше в промышленный оборот. В среднем, из 100 кг старых батареек получается порядка 40 кг чистого сырья, включая цинк и железо. Батарейки дробятся, их содержимое промывается от электролита. Далее в несколько этапов выщелачивания извлекаются цветные металлы и из соли. Электролит используется для нейтрализации кислот, графитовые стержни в батарейках также отфильтровываются и используются в дальнейшем.
Классификация батареек по электролиту
В зависимости от используемого в батарейках электролита, химические источники тока подразделяют на несколько классов.
В статье мы приводим упрощенную схему классификации, указываем на сильные и слабые стороны различных видов батареек.
Классификация батареек по электролиту
1. «Сухие» или «солевые» батарейки
Тип электролита: угольно-цинковый, «солевой», LeClanche.
Плюсы: низкая стоимость.
Минусы: малая емкость, падающая кривая разряда, низкая эффективность при больших токах нагрузки, низкая эффективность в пониженных температурных условиях.
2. Батарейки «мощные» или «Heavy Duty»
Тип электролита: цинк-хлорид, сухой элемент.
Плюсы: средняя стоимость, улучшенные температурные и рабочие характеристики по сравнению с «сухими» батарейками.
Минусы: малая емкость, падающая кривая разряда.
3. Щелочные, alkaline или «алкалиновые» батарейки
Тип электролита: щелочь-марганец, марганец-цинк.
Плюсы: низкая стоимость, стабильность в работе при пониженных температурах или повышенных нагрузках, сохранение низкого значения сопротивляемости во время разряда, широкое производство и универсальность в использовании.
Минусы: наличие ртути, нестабильная кривая разряда.
4. Ртутные батарейки
Основа электролита: ртуть.
Плюсы: стабильное напряжение, большая емкость, повышенная энергонакопляемость.
Минусы: относительно высокая цена, отсутствие таких батареек в серийном производстве (ввиду наличия вредной ртути).
5. Серебряные батарейки
Основа электролита: серебро.
Плюсы: большая емкость, пологий разряд, относительная нечувствительность к температурам, длительный срок использования и хранения.
Минусы: очень высокая цена, отсутствие таких батареек в серийном производстве (из-за высокой стоимости расходных материалов, а именно, серебра).
6. Воздушно-цинковые батарейки
Основа электролита: воздух-цинк.
Плюсы: экологическая чистота, безвредность, доступная цена, длительный срок хранения, очень большая емкость, которая в 9 – 11 раз превышает показатели всех прочих классов батареек.
Минусы: сложные условия хранения (в открытом виде батарейка быстро саморазряжается), повышенная толщина (в 1,5 раза толще своих аналогов из других классов).
7. Литиевые батарейки
Основа электролита: литий
Плюсы: большая накопительная емкость (за счет размеров), пологий разряд, относительная инертность к температурам, высокий срок службы и хранения, большое начальное напряжение (3,0 – 3,7 В), малый вес.
Минусы: высокая цена, невысокая популярность у потребителей и покупателей.
Какие бывают аккумуляторы в мобильной, компьютерной и бытовой технике
Содержание
Содержание
Аккумуляторы окружают нас повсеместно. Их можно встретить как в привычных каждому пользователю мобильных гаджетах, так и в сложных системах резервного электропитания. В каждой из областей используется свой тип аккумуляторной батареи, в которой ее характеристики «раскрываются» наилучшим образом. В данном материале поговорим о типах аккумуляторных элементов, областях применения и основных правилах эксплуатации.
Аккумуляторы. Общие принципы
По историческим меркам аккумулятор — довольно «молодое» изобретение, которому немногим более 160 лет. Основной принцип работы любого аккумуляторного элемента — протекание в нем обратимой электрохимической реакции, т. е. при приложении к контактам элемента постоянного напряжения, на его пластинах (электродах) накапливается электрическая энергия, при приложении нагрузки — происходит ее расходование. Причем протекает такая реакция на протяжении большого количества циклов заряда/разряда. Как правило, возможное количество перезарядок зависит от типа аккумуляторного элемента, но в среднем, современный аккумулятор способен обеспечить 300–1000 полных циклов.
Работоспособным считается аккумулятор, остаточная емкость которого составляет 70–80 % от начальной. Элементы с меньшими показателями остаточной емкости считаются непригодными для дальнейшей эксплуатации, поскольку не могут обеспечить расчетную автономность.
Какого бы типа не был аккумулятор, костяк конструкции и основной принцип действия у них остается неизменным. В каждом аккумуляторе есть два электрода (положительный и отрицательный, иначе именуемые анод и катод), погруженные в специальную среду — электролит, являющуюся прекрасным «поставщиком» ионов вследствие электролитической диссоциации.
Ион — атом или молекула, несущая на себе электрический заряд. Если ион положительно заряжен — его называют катион, если отрицательно — анион.
В зависимости от используемого материала электродов и применяемого типа электролита существуют различные вариации аккумуляторных элементов, каждый из которых имеет свои конструкционные и эксплуатационные особенности. Ниже поговорим о наиболее распространенных типах аккумуляторов, сферах их применения и особенностях эксплуатации.
Свинцовые аккумуляторы
Несмотря на преклонный возраст технологии, свинцовые аккумуляторы до сих пор успешно применяются в системах резервного питания, автомобильном транспорте, системах аккумулирования возобновляемых источников энергии (солнечная и ветряная энергетика, гидроэнергетика и т. д.).
Как видно из названия, в качестве основного материала, из которого изготавливают электроды, выступает свинец. Точнее, для производства положительных электродов — просто свинец, а для изготовления отрицательных электродов — оксид свинца. В качестве электролита, как правило, выступает раствор серной кислоты.
Существует большое количество конструкций свинцового аккумулятора, направленных на улучшение его эксплуатационных характеристик. Поскольку свинец сам по себе достаточно мягкий металл с невысокой физической прочностью, в чистом виде он слабо противостоит вибрационным нагрузкам, поэтому для использования аккумуляторов, например, в транспорте, в сплав свинца добавляют кальций, делающий структуру металла более прочной.
Для использования свинцового аккумулятора в источниках бесперебойного питания, дабы не допустить контакт пользователя с кислотой, исключить необходимость обслуживания, а также не создавать условия для взрыва водорода, выделяемого из АКБ, при ее заряде, используют свинцовые аккумуляторы определенного типа. Такими аккумуляторами являются источники питания типа AGM (Absorbent Glass Mat), в которых абсорбированным электролитом (не жидким) пропитан специальный пористый мат из стекловолокна.
Довольно часто свинцовые аккумуляторы, выполненные по технологии AGM, ошибочно называют гелевыми. На самом деле это не так. Гелевые аккумуляторы — отдельная ветвь развития свинцовых источников питания.
Аккумуляторы, электролитом в которых выступает раствор серной кислоты в желеобразном состоянии, называются гелевыми. Они рассчитаны на медленную отдачу энергии, поэтому основная область их применения — использование в инертных системах накопления и расходования электроэнергии (солнечная энергетика, питание моторов кресел для инвалидов, гольф-каров и т. д.).
Один свинцовый аккумуляторный элемент выдает напряжение порядка 2 В и способен выдать удельной энергии из расчета 30–60 Вт*ч с 1 кг массы, что в сравнении с другими типами — достаточно мало. Такие аккумуляторы имеют высокие значения саморазряда, а их глубокий разряд приводит к разрушению и осыпанию пластин электродов и безвозвратной порче аккумулятора.
Никель-кадмиевые аккумуляторы
Следующим типом аккумуляторных элементов, активно использующихся во многих сферах, являются никель-кадмиевые аккумуляторы (NiCd). Их можно встретить в детских игрушках, пультах управления, фонариках, ручном аккумуляторном электроинструменте и т. д.
Конструкция элемента не претерпела изменений, только в качестве материала для изготовления электродов используются никель и кадмий, а точнее гидраты закиси этих металлов. В качестве электролита применяют гидроксид калия. Один элемент на основе этих металлов может выдать напряжение 1,2–1,35 В, а значение удельной энергии находится в диапазоне 40–80 Вт*ч/кг.
Никель-кадмиевые аккумуляторы — одни из самых морозоустойчивых. Они работают без существенной потери своей емкости при температурах, близких к –50 ° С, к тому же, абсолютно не боятся глубокого разряда, и после цикла зарядки полностью восстанавливают свои эксплуатационные характеристики.
Хранить NiCd аккумуляторы рекомендуется полностью разряженными.
К отрицательным моментам относят их малую удельную емкость, высокий саморазряд, длительное время зарядки (восполнять энергию нужно малыми зарядными токами) и ярко выраженный «эффект памяти».
Чтобы не испортить аккумулятор, его необходимо заряжать только после полного разряда! Пренебрежение этим правилом повлечет быструю потерю емкости и выход элемента из строя.
Заряжают NiCd-элементы малыми зарядными токами, значения которых составляет порядка 10 % от емкости аккумулятора.
Никель-металлогидридные аккумуляторы
Логическим продолжением никель-кадмиевых аккумуляторов стали никель-металлогидридные (NiMH) элементы питания. В них учтены и практически устранены недостатки предшественников. Аккумуляторы при тех же массогабаритных показателях имеют большую в 2–3 раза емкость, обладают высокой надежностью, с легкостью переносят глубокий разряд и перезаряд, менее подвержены эффекту памяти.
Немаловажную роль в популяризации и широком распространении NiMH элементов сыграл тот факт, что они не содержат в своем составе кадмия, очень вредного для окружающей среды металла. Следовательно, с повестки дня снимаются вопросы правильного хранения и утилизации таких элементов.
Для производства анода используют гидрид никеля с лантаном или литием — так называемый металлогидридный электрод. В качестве катода — оксид никеля. Электролитом выступает соединение гидроксида калия.
Заряжают никель-металлогидридные аккумуляторы большими (в сравнении с NiCd-элементами) токами, величины которых составляют порядка 20–25 % от емкости аккумулятора, но очень важно контролировать температуру элемента во время заряда. Если она превышает 45 °С, нужно немедленно прервать процесс зарядки, в противном случае существует риск порчи элемента.
Зарядку для NiMH-аккумуляторов можно использовать в паре с NiCd-элементами. Обратная совместимость недопустима! Алгоритмы зарядки никель-кадмия более примитивны, они могут причинить вред NiMH-элементу.
Никель-металлогидридные аккумуляторы хранят полностью заряженными. Поскольку этому типу элементов присущ высокий саморазряд, для сохранения работоспособности элемента его нужно периодически подвергать полному циклу разряда/заряда.
Никель-металлогидридные аккумуляторы используют в тех же сферах, что и никель-кадмиевые, однако, благодаря повышенной емкости, их охотно применяют в фототехнике, использующей для питания элементы типа АА и ААА.
Один элемент генерирует 1,2–1,25 в ЭДС, а его удельная энергия составляет 60–75 Вт*ч/кг. Теоретический расчетный «потолок» этого параметра находится на уровне 300 Вт*ч/кг, но видимо технологии производства NiMH-элементов, еще не до конца совершенны.
Литий-ионные аккумуляторы
Современные мобильные устройства уже сложно представить без литий-ионных аккумуляторов. Именно их разработка дала мощный толчок к развитию легких и миниатюрных решений источников питания, и, как следствие, миниатюризации всего сегмента мобильных гаджетов.
Сильными сторонами Li-ion являются высокая плотность аккумулируемой энергии, ее удельное значение, в большинстве случаев, составляет солидные 280 Вт*ч/кг, недостижимые при использовании аккумуляторов другого типа. Именно по этой причине Li-ion аккумуляторы используются не только для питания персональных гаджетов, но и для приведения в движение различных самокатов, велосипедов с электродвигателем и даже автомобилей.
Справедливости ради следует сказать, что «литий-ионный аккумулятор» — это обобщенное название целой группы электрохимических элементов, переносчиком заряда в которых выступают ионы лития. Разница заключается в составе материала катода и типе электролита.
Наибольшее распространение в бытовом сегменте получили литий-полимерные аккумуляторы, в которых в качестве электролита используется специальный твердый полимер, а катодный и анодный материал нанесены на тонкие слои алюминиевой и медной фольги соответственно. Такое конструктивное решение позволяет производить аккумуляторы любой формы и размера, изящно «вписывая» их в разрабатываемые устройства.
Существенный недостаток твердого полимера — его плохая проводимость при нормальной температуре окружающей среды (+ 25 °С). Наилучшие показатели достигаются при увеличении температуры до + 60 °С, а это уже опасно с точки зрения обычного использования. Поэтому производители идут на небольшие ухищрения, добавляя к полимеру электролит в жидком или желеобразном состоянии.
Существенное отличие конструкции литий-ионных аккумуляторов от традиционной конструкции заключается в обязательном наличии разделительного сепаратора, исключающего свободное перемещение ионов лития, в моменты, когда аккумулятор не используется.
Другой элемент, который должен обязательно присутствовать в схеме аккумулятора — BMS-контроллер (Battery Management System), отвечающий за корректную и сбалансированную зарядку ячеек аккумулятора.
Li-ion аккумуляторы при высокой удельной емкости обладают малым весом. Для их зарядки нужно не так уж много времени. У них практически отсутствует эффект памяти и саморазряд. К аккумуляторам литий-ионного типа не предъявляется особых требований к соблюдению циклов заряда/разряда. Заряжать их можно в любое удобное время, не привязываясь к величине остаточного заряда элемента. Хранить Li-ion батареи рекомендуется наполовину заряженными.
Самым существенным недостатком литий-ионного элемента является его категорическое «нежелание» полноценно работать при отрицательных температурах. Эксплуатация литиевого элемента на морозе очень быстро приблизит его выход из строя.