какая масса серебра образуется на стенках пробирки при взаимодействии 15 г 2 процентного раствора
Какая масса серебра образуется на стенках пробирки при взаимодействии 15 г 2 процентного раствора
На своем сайте я выкладываю уникальные, адаптивные, и качественные шаблоны. Все шаблоны проверяются на всех самых популярных браузерх.
Раньше я занимался простой вёрсткой одностраничных, новостных и т.п. шаблонов на HTML, Bootstrap. Однажды увидев сайты на DLE решил склеить пару шаблонов и выложить их в интернет. В итоге эта парочка шаблонов набрала неплохую популярность и хорошие отзывы, и я решил создать отдельный проект.
Кроме шаблонов я так же буду выкладывать полезную информацию для DataLife Engin и “статейки” для веб мастеров. Так же данный проект будет очень полезен для новичков и для тех, кто хочет правильно содержать свой сайт на DataLife Engine. Надеюсь моя работа вам понравится и вы поддержите этот проект. Как легко и удобно следить за обновлениями на сайте?
Достаточно просто зарегистрироваться на сайте, и уведомления о каждой новой публикации будут приходить на вашу электронную почту!
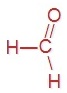
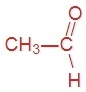
Задание 1 Какие вещества называют альдегидами?
Альдегидами называют вещества, в молекулах которых альдегидная группа связана с углеводородным радикалом (или атомом водорода).
Приведите формулы и названия трёх первых представителей этого гомологического ряда.
 |  |
Задание 3
Формальдегид объёмом 44,8 л (н.у.) растворили в 240 г воды. Рассчитайте массовую долю альдегида в растворе.
Дано: V(HCHO)=44,8 л, m(H2O)=240 г
Найти: ω(HCHO)-?
Решение
1. Вычисляем количество вещества формальдегида объёмом 44,8 л по формуле: n=V/VM, где VM ― молярный объём.
n (HCHO)= V (HCHO):VM=44,8 л : 22,4 л/моль=2 моль
2. Вычисляем массу формальдегида количеством вещества 2 моль по формуле: m= n • M, где M ― молярная масса.
Mr( HCHO )=30, поэтому M( HCHO )=30 г/моль
m( HCHO )=n( HCHO ) • M( HCHO )=2 моль • 30 г/моль=60 г
3. Рассчитываем массу раствора:
m(раствора)=m( HCHO )+m(воды)=60 г + 240 г=300 г
4. Рассчитываем массовую долю альдегида в растворе:
ω(HCHO)=(m(HCHO)/m(р-ра))•100%=(60 г : 300 г)•100%=20%
Ответ: 20%
Задание 7
Какая масса серебра образуется на стенках пробирки при взаимодействии 15 г 2%-ного раствора формальдегида с избытком аммиачного раствора оксида серебра?
Дано: m(раствора)=15 г, ω(HC H O)=2%
Найти: m (Ag)—?
Решение
1. Рассчитываем массу формальдегида в растворе:
m( HC H O )=ω( HC H O )•m(раствора):100%=2%•15 г:100%=0,3 г
2. Количество вещества формальдегида рассчитываем по формуле: n=m/M, где M ― молярная масса.
M( HCHO )=30 г/моль
n( HC H O )=m( HC H O )/M( HC H O )=0,3 г : 30 г/моль=0,01 моль
3. Составим химическое уравнение:
HCHO + Ag2Oаммиачный р-р t ⟶ HCOOH + 2Ag↓
По уравнению реакции n(HCHO):n(Ag)=1:2, поэтому:
n( Ag )=2 • n( HCHO )=2 • 0,01 моль=0,02 моль
4. Рассчитываем массу серебра количеством вещества 0,02 моль по формуле: m =n • M, где M ― молярная масса.
M (Ag )=108 г/моль
m(Ag)=n (Ag) • M(Ag)=0,02 моль • 108 г/моль=2,16 г
Ответ: 2,16 г серебра.
Задание 8
В 1860 г французский химик М. Бертло провёл реакцию ацетилена с водой и был уверен, что получил непредельный спирт: HC≡CH + H2O ⟶ CH2=CH–OH В 1877 г аналогичную реакцию осуществил русский химик Александр Павлович Эльтеков. Учёный пришёл к выводу, что получил уксусный альдегид: HC≡CH + H2O ⟶ CH3CHO Кто из учёных оказался прав? Александр Павлович Эльтеков, т.к. непредельный виниловый спирт неустойчив и в конечном случае превращается в уксусный альдегид.
Какая масса серебра образуется на стенках пробирки при взаимодействии 15 г 2 процентного раствора
Дано: m (HCl раствора) = 100 г
Сначала необходимо записать уравнение химической реакции:
HCl + AgNO 3 = AgCl↓ + H NO 3
1) Находим массу растворенного в воде хлороводорода:
m(HCl) = m(HCl раствора) · W (HCl)
m(HCl) =100 г · 0.15 = 1.5 г
2) Находим количество вещества хлороводорода:
n (HCl) =1.5 г/ 36.5 г / моль = 0.04 моль
3) Находим количество вещества хлорида серебра:
n(HCl) = n (AgCl) => n (AgCl) = 0.04 моль
(т.к. по уравнению реакции количества веществ соляной кислоты и хлорида серебра равны, получается, что количество вещества хлорида серебра равно 0,04 моль)
4) Находим массу хлорида серебра:
m(AgCl) = n (AgCl) · М(AgCl)
m(AgCl) = 0.04 моль · 143.5 г / моль = 58.97 г
Ответ: образуется 58.97 г хлорида серебра.
№2 Чему равна масса сульфата натрия в растворе, если для реакции нейтрализации использовали 8 г 10%-ного раствора гидроксида натрия?
Дано:m(NaOH раствора) = 8г
Запишем уравнение реакции: H 2SO 4 + 2NaOH = Na 2SO 4 + 2H 2O
1) m(NaOH) = m(NaOH раствора) · W(NaOH)
m(NaOH) = 8г · 0.1 = 0.8г
2) n(NaOH) = m(NaOH)/М (NaOH)
n(NaOH) =0.8г/40г/моль = 0.02 моль
n((Na 2SO 4) = ½ · 0.02 моль = 0.01 моль
m(Na 2SO 4) =0.01 моль · 142 г/моль = 1.42г
Ответ: образуется 1.42г сульфата натрия в растворе.
Какая масса серебра образуется на стенках пробирки при взаимодействии 15 г 2 процентного раствора
Габриелян Олег Сергеевич, Остроумов Игорь Геннадьевич
При гидролизе сложного эфира с молекулярной массой 130 образовалась кислота А и спирт Б. Определите структуру эфира, если известно, что серебряная соль кислоты А содержит 59,67 % серебра. Спирт Б не окисляется раствором дихромата калия и реагирует с хлороводородом с образованием алкилхлорида.
Габриелян Олег Сергеевич, Остроумов Игорь Геннадьевич
При полном сгорании навески органического вещества Х получено 14,34 л (н.у.) СО₂, 25,92 г бромоводорода и 8,64 мл Н₂O. Известно, что вещество Х образуется при присоединении брома к непредельном углеводороду Y с разветвленным углеродным скелетом.
Мне кажется в условии задачи ошибка: предельные УВ не способны к реакциям присоединения!
Олимпиада 10 класс
Задача 1.
При сжигании 0,5 моль циклического углеводорода Х во фторе образовалось 220 г четырехфтористого углерода и 100 г фтороводорода.
1. Установите формулу углеводорода Х
2. Составьте структурные формулы циклических изомеров назовите их.
Решение пятой задачи
При взаимодействии белого кристаллического вещества А с соляной кислотой образуется газ В, имеющий плотность 1,96 г/мл. Газ В выделяется также при нагревании вещества А, но его количество вдвое меньше, чем в реакции с соляной кислотой. При действии избытка раствора соляной кислоты на 1,68 г вещества А с последующим упариванием раствора досуха можно получить 1,17 г вещества С. Вещества А и С используются при приготовлении пищи. Определите вещества. (9 баллов).
Решение второй задачи
Раствор бромоводородной кислоты содержит 6,02803·10²⁴ молекул и 1,804·10²⁵ атомов. Рассчитайте массовую долю кислоты в растворе.
В 400 мл раствора с плотностью 1,25 г/мл, содержащий нитрат меди (II) c массовой долей 18,8 % и нитрата серебра с массовой долей 10,2 % насыпали 100 г железных опилок. Через некоторое время раствор отфильтровали. Масса твердых веществ стала равной 128,4 г. Определите массовые доли веществ в полученном растворе, если известно, что при добавлении в него соляной кислоты не происходит никаких видимых изменений. В реакции с ионами меди образуются ионы железа +2, а при реакции с ионами серебра образуются ионы железа +3.
Белавин Иван Юрьевич
“ПЛАСТИНКИ”
9. В раствор сульфата цинка массой 596 г насыпали 40 г порошка магния. Через некоторое время металлический порошок отделили от раствора, высушили и взвесили. Масса порошка оказалась равной 56 г. Определите массовую долю сульфата магния в растворе, оставшемся после отделения металлического порошка.
Какая масса серебра образуется на стенках пробирки при взаимодействии 15 г 2 процентного раствора
Задачи на пластинку (Задание 34 ЕГЭ)

В раствор хлорида меди(II) поместили железную пластинку массой 40г. Через некоторое время пластинки стала равна 41,6 г. Какая масса меди выделилась на пластинке?
Ответ: m(Cu) = 12,8 г

В 136г 25%-ного раствора нитрата серебра поместили медную пластинку массой 15г. Через некоторое время пластинку вынули из раствора, высушили и взвесили. Её масса оказалась равной 22,6г. Какова массовая доля нитрата серебра в растворе после реакции?
Ответ: 13,2 %.

В раствор хлорида олова(II) массой 380г внесли кусочек цинка. После реакции масса кусочка металла увеличилась на 5,4г. Вычислите массовую долю хлорида цинка в растворе после реакции.
Ответ: 3,6 %.

В раствор хлорида кобальта(II) массой 380 г с массовой долей соли 40 % поместили кусочек неизвестного металла (М). Через некоторое время вынули из раствора, высушили и взвесили, его масса увеличилась на 14 г. Массовая доля хлорида кобальта в растворе после реакции стала равной 8,75 %. Определите неизвестный металл, если известно, что в образовавшемся оксиде он имеет степень окисления +2.
Ответ: Mg.

Кусочек марганца поместили в 257,4 г раствора хлорида неизвестного металла (М), проявляющего в соединении степень окисления +2. По окончании реакции масса образца увеличилась на 5,4г, а массовая доля хлорида марганца(II) в растворе составила 30%. Определите неизвестный металл.
Ответ: Сu


В раствор нитрата серебра внесли никелевую пластинку массой 25 г. Через некоторое время пластинку вынули из раствора и высушили, её масса стала равна 48,55 г. Вычислите массовую долю Ni (в %) в пластинке по окончании реакции.
Ответ: ω(Ni) = 33,26 %.

В раствор нитрата свинца(II) массой 150 г с массовой долей растворённого вещества 20% поместили железную пластинку массой 20 г. Пластинку вынули из раствора, когда массовая доля нитрата свинца(II) в растворе стала равной 5%. Найдите массу пластинки после реакции.
Ответ: m2(пласт.) = 30,57г.

В 300г раствора, содержащего нитрат железа(II) (массовая доля соли 6%) и хлорид меди(II) (массовая доля соли 9%), поместили опилки магния, масса которых равна 6 г. Определите массу металлического осадка по окончании реакции.
Ответ: m(осадка) = 15,6 г.
