какая масса твердых продуктов образуется если разложению подвергли 35 г нитрата меди ii
Какая масса твердых продуктов образуется если разложению подвергли 35 г нитрата меди ii
При разложении нитрата меди (II) выделилась смесь газов объемом 11,2 л (в пересчете на н.у.). Масса остатка составила 94 г. К остатку добавили 292 г 10%-ного раствора соляной кислоты. Определите массовую долю HCl в полученном растворе.
В ответе напишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления.
При разложении нитрата меди (II) образуется смесь газов — диоксида азота (IV) и кислорода:
С водным раствором соляной кислоты реагирует оксид меди, образовавшийся при прокаливании нитрата меди (II):
Вычислим количество газов, образующихся при разложении нитрата меди:
По уравнению реакции
Вычислим массу и количество вещества хлороводорода в исходном растворе:
По уравнению реакции взаимодействия оксида меди (II) с соляной кислотой следовательно, с
прореагировало
В растворе осталось
Вычислим массу образовавшегося раствора:
Массовая доля хлороводорода в образовавшемся растворе равна:
| Критерии оценивания выполнения задания | Баллы |
|---|---|
| Ответ правильный и полный, содержит все названные выше элементы | 4 |
| В ответе допущена ошибка в одном из названных выше элементов | 3 |
| В ответе допущена ошибка в двух из названных выше элементов | 2 |
| В ответе допущена ошибка в трёх из названных выше элементов | 1 |
| Все элементы ответа записаны неверно | 0 |
| Максимальный балл | 4 |
В условии сказано, что масса остатка составила 94г. Давайте проверим: исходя из решения количество вещества CuO = количеству вещества Cu(NO3)2 следовательно тоже 0,2 моль. Масса Cu(NO3)2 равна 0,2* молярную массу (188) = 37,6 г. То есть при разложении мы из 37,6 грамм сделали остаток, весом 94 грамма? Даже если это раствор соли, то вода бы выпарилась и она не являлась бы остатком. А как же закон действующих масс? Прошу исправить задачу из-за недействительного условия.
Вы правы, на первый взгляд выглядит странно. Но решение вполне допустимо, если изначально разложился не весь нитрат меди.
Разложение нитрата меди
Кто знает, как выглядит уравнение, описывающее разложение нитрата меди (II). Какая масса твердых продуктов образуется, если разложению подвергли 35 г нитрата меди (II)?
Разложение нитрата меди (II) происходит при нагревании до температуры выше 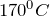
Для того, чтобы перейти к решению задачи, необходимо сначала записать уравнение разложения нитрата меди (II):
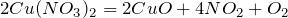
Вычислим молярную массу нитрата меди (II). Значения относительных атомных масс, взятых из Периодической таблицы Д.И. Менделеева, округлим до целых чисел:
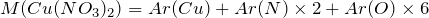
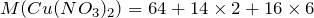
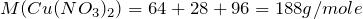
Найдем количество вещества данного соединения:
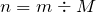
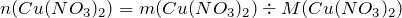
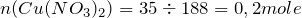
Мольное соотношение исходного вещества (нитрат меди (II)) и твердого продукта реакции (оксид меди (II)) равно:
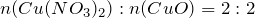
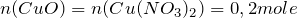
Тогда масса образующегося оксида меди (II) рассчитывается как:
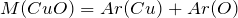
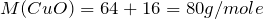
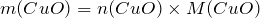
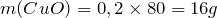
Продуктами разложения нитрата меди является выберите 3 варианта ответа
Продуктами разложения нитрата меди является выберите 3 варианта ответа
3)Продуктами разложения нитрата меди являются 1)Cu 2)CuO 3)O2 4)N2O
5)NO2 6)NO
Ответы и объяснения 1
2Cu(NO3)2 (t)= 2CuO + 2NO2 + 3O2
Знаете ответ? Поделитесь им!
Как написать хороший ответ?
Чтобы добавить хороший ответ необходимо:
Есть сомнения?
Не нашли подходящего ответа на вопрос или ответ отсутствует? Воспользуйтесь поиском по сайту, чтобы найти все ответы на похожие вопросы в разделе Химия.
Трудности с домашними заданиями? Не стесняйтесь попросить о помощи — смело задавайте вопросы!
Химия — одна из важнейших и обширных областей естествознания, наука о веществах, их составе и строении, их свойствах, зависящих от состава и строения, их превращениях, ведущих к изменению состава — химических реакциях, а также о законах и закономерностях, которым эти превращения подчиняются.
Продуктами разложения нитрата меди является выберите 3 варианта ответа
При разложении нитрата меди (II) выделилась смесь газов объемом 11,2 л (в пересчете на н.у.). Масса остатка составила 94 г. К остатку добавили 292 г 10%-ного раствора соляной кислоты. Определите массовую долю HCl в полученном растворе.
В ответе напишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления.
При разложении нитрата меди (II) образуется смесь газов — диоксида азота (IV) и кислорода:
С водным раствором соляной кислоты реагирует оксид меди, образовавшийся при прокаливании нитрата меди (II):
Вычислим количество газов, образующихся при разложении нитрата меди:
По уравнению реакции
Вычислим массу и количество вещества хлороводорода в исходном растворе:
По уравнению реакции взаимодействия оксида меди (II) с соляной кислотой следовательно, с
прореагировало
Вычислим массу образовавшегося раствора:
Массовая доля хлороводорода в образовавшемся растворе равна:
| Критерии оценивания выполнения задания | Баллы |
|---|---|
| Ответ правильный и полный, содержит все названные выше элементы | 4 |
| В ответе допущена ошибка в одном из названных выше элементов | 3 |
| В ответе допущена ошибка в двух из названных выше элементов | 2 |
| В ответе допущена ошибка в трёх из названных выше элементов | 1 |
| Все элементы ответа записаны неверно | |
| Максимальный балл | 4 |
В условии сказано, что масса остатка составила 94г. Давайте проверим: исходя из решения количество вещества CuO = количеству вещества Cu(NO3)2 следовательно тоже 0,2 моль. Масса Cu(NO3)2 равна 0,2* молярную массу (188) = 37,6 г. То есть при разложении мы из 37,6 грамм сделали остаток, весом 94 грамма? Даже если это раствор соли, то вода бы выпарилась и она не являлась бы остатком. А как же закон действующих масс? Прошу исправить задачу из-за недействительного условия.
Вы правы, на первый взгляд выглядит странно. Но решение вполне допустимо, если изначально разложился не весь нитрат меди.
Извините, а можете объяснить, почему в массе раствора не учитывались газы? ( т. е. — m(no 2) — m(o2))
Продуктами разложения нитрата меди является выберите 3 варианта ответа
При термической обработке нитрата меди(II) массой 94,0 г часть вещества разложилась и выделилось 11,2 л (н.у.) смеси газов. К полученному твёрдому остатку добавили 292,0 г 10%-ной соляной кислоты. Определите массовую долю хлороводорода в полученном растворе.
В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
Запишем уравнение термического разложения нитрата меди(II): (1)
Твёрдый остаток – это смесь образовавшегося оксида меди(II) и оставшегося нитрата меди(II).
Рассчитаем количество вещества образовавшейся газовой смеси:
Из уравнения (1):
Рассчитаем массу неразложившегося нитрата меди(II):
Найдём общую массу и количество вещества добавленной соляной кислоты:
С соляной кислотой реагирует только один компонент твёрдого остатка – образовавшийся оксид меди(II):
(2)
Cоляная кислота добавлена в избытке, поэтому весь твёрдый остаток перейдёт в раствор (оксид меди(II) полностью прореагирует и превратится в растворимый хлорид, а нитрат меди(II) − растворимая соль).
По уравнению (2) рассчитаем количество вещества соляной кислоты, вступившей в реакцию с оксидом меди(II):
Найдём количество вещества и массу оставшейся соляной кислоты:
Найдём массу конечного раствора:
Определим массовую долю хлороводорода в полученном растворе:
Ответ:
| Критерии оценивания выполнения задания | Баллы |
|---|---|
| Ответ правильный и полный, содержит следующие элементы: |
• правильно записаны уравнения реакций, соответствующих условию задания;
• правильно произведены вычисления, в которых используются необходимые физические величины, заданные в условии задания;
• продемонстрирована логически обоснованная взаимосвязь физических величин, на основании которых проводятся расчёты;
• в соответствии с условием задания определена искомая физическая величина
Разложение нитрата меди
Кто знает, как выглядит уравнение, описывающее разложение нитрата меди (II). Какая масса твердых продуктов образуется, если разложению подвергли 35 г нитрата меди (II)?
Разложение нитрата меди (II) происходит при нагревании до температуры выше 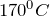
Для того, чтобы перейти к решению задачи, необходимо сначала записать уравнение разложения нитрата меди (II):
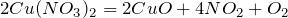
Вычислим молярную массу нитрата меди (II). Значения относительных атомных масс, взятых из Периодической таблицы Д.И. Менделеева, округлим до целых чисел:
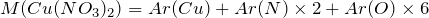
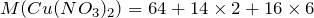
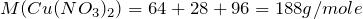
Найдем количество вещества данного соединения:
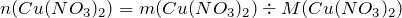
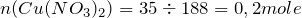
Мольное соотношение исходного вещества (нитрат меди (II)) и твердого продукта реакции (оксид меди (II)) равно:
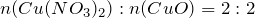
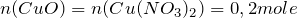
Тогда масса образующегося оксида меди (II) рассчитывается как:
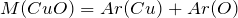
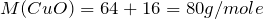
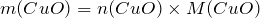
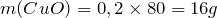
Нитрат меди ii подвергли разложению при нагревании
Нитрат меди ii подвергли разложению при нагревании
При разложении нитрата меди (II) выделилась смесь газов объемом 11,2 л (в пересчете на н.у.). Масса остатка составила 94 г. К остатку добавили 292 г 10%-ного раствора соляной кислоты. Определите массовую долю HCl в полученном растворе.
В ответе напишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления.
При разложении нитрата меди (II) образуется смесь газов — диоксида азота (IV) и кислорода:
С водным раствором соляной кислоты реагирует оксид меди, образовавшийся при прокаливании нитрата меди (II):
Вычислим количество газов, образующихся при разложении нитрата меди:
По уравнению реакции
Вычислим массу и количество вещества хлороводорода в исходном растворе:
По уравнению реакции взаимодействия оксида меди (II) с соляной кислотой следовательно, с
прореагировало
Вычислим массу образовавшегося раствора:
Массовая доля хлороводорода в образовавшемся растворе равна:
| Критерии оценивания выполнения задания | Баллы |
|---|---|
| Ответ правильный и полный, содержит все названные выше элементы | 4 |
| В ответе допущена ошибка в одном из названных выше элементов | 3 |
| В ответе допущена ошибка в двух из названных выше элементов | 2 |
| В ответе допущена ошибка в трёх из названных выше элементов | 1 |
| Все элементы ответа записаны неверно | |
| Максимальный балл | 4 |
В условии сказано, что масса остатка составила 94г. Давайте проверим: исходя из решения количество вещества CuO = количеству вещества Cu(NO3)2 следовательно тоже 0,2 моль. Масса Cu(NO3)2 равна 0,2* молярную массу (188) = 37,6 г. То есть при разложении мы из 37,6 грамм сделали остаток, весом 94 грамма? Даже если это раствор соли, то вода бы выпарилась и она не являлась бы остатком. А как же закон действующих масс? Прошу исправить задачу из-за недействительного условия.
Вы правы, на первый взгляд выглядит странно. Но решение вполне допустимо, если изначально разложился не весь нитрат меди.
Извините, а можете объяснить, почему в массе раствора не учитывались газы? ( т. е. — m(no 2) — m(o2))
Нитрат меди ii подвергли разложению при нагревании
При термической обработке нитрата меди(II) массой 94,0 г часть вещества разложилась и выделилось 11,2 л (н.у.) смеси газов. К полученному твёрдому остатку добавили 292,0 г 10%-ной соляной кислоты. Определите массовую долю хлороводорода в полученном растворе.
В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
Запишем уравнение термического разложения нитрата меди(II): (1)
Твёрдый остаток – это смесь образовавшегося оксида меди(II) и оставшегося нитрата меди(II).
Рассчитаем количество вещества образовавшейся газовой смеси:
Из уравнения (1):
Рассчитаем массу неразложившегося нитрата меди(II):
Найдём общую массу и количество вещества добавленной соляной кислоты:
С соляной кислотой реагирует только один компонент твёрдого остатка – образовавшийся оксид меди(II):
(2)
Cоляная кислота добавлена в избытке, поэтому весь твёрдый остаток перейдёт в раствор (оксид меди(II) полностью прореагирует и превратится в растворимый хлорид, а нитрат меди(II) − растворимая соль).
По уравнению (2) рассчитаем количество вещества соляной кислоты, вступившей в реакцию с оксидом меди(II):
Найдём количество вещества и массу оставшейся соляной кислоты:
Найдём массу конечного раствора:
Определим массовую долю хлороводорода в полученном растворе:
Ответ:
| Критерии оценивания выполнения задания | Баллы |
|---|---|
| Ответ правильный и полный, содержит следующие элементы: |
• правильно записаны уравнения реакций, соответствующих условию задания;
• правильно произведены вычисления, в которых используются необходимые физические величины, заданные в условии задания;
• продемонстрирована логически обоснованная взаимосвязь физических величин, на основании которых проводятся расчёты;
• в соответствии с условием задания определена искомая физическая величина
Разложение нитрата меди
Кто знает, как выглядит уравнение, описывающее разложение нитрата меди (II). Какая масса твердых продуктов образуется, если разложению подвергли 35 г нитрата меди (II)?
Разложение нитрата меди (II) происходит при нагревании до температуры выше 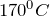
Для того, чтобы перейти к решению задачи, необходимо сначала записать уравнение разложения нитрата меди (II):
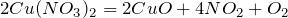
Вычислим молярную массу нитрата меди (II). Значения относительных атомных масс, взятых из Периодической таблицы Д.И. Менделеева, округлим до целых чисел:
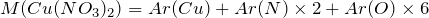
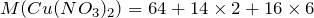
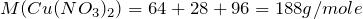
Найдем количество вещества данного соединения:
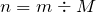
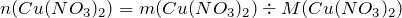
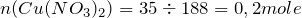
Мольное соотношение исходного вещества (нитрат меди (II)) и твердого продукта реакции (оксид меди (II)) равно:
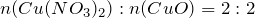
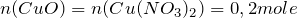
Тогда масса образующегося оксида меди (II) рассчитывается как:
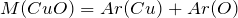
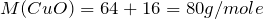
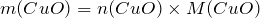
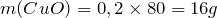
Задачи на неполное разложение
Задачи на частичное разложение — это задачи, в которых исходное вещество распадается только частично, то есть часть исходного вещества остается. При разложении твердого вещества может образоваться новый твердый продукт, но также остается часть исходного реагента, который не разложился. Это необходимо учитывать при составлении химических реакций.
По сути, это одна из разновидностей задач на материальный баланс.
Рассмотрим несколько примеров решения задач на частичное разложение из реальных ЕГЭ по химии.
1. При нагревании образца нитрата алюминия часть вещества разложилась. При этом выделилось 10,08 л (в пересчёте на н.у.) смеси газов. Для полного растворения образовавшегося твёрдого остатка необходимо затратить 60 г 40%-ного раствора гидроксида натрия. При этом образовался тетрагидроксоалюминат натрия. Определите массу исходного образца нитрата алюминия.
Реакция разложения нитрата алюминия:
Из условия известно, что распалась только часть исходного вещества.
Количество вещества смеси газов:
nсм = V/Vm = 10,08 л/22,4 л/моль = 0,45 моль
Примем количество образовавшегося кислорода за х моль:
n(О2) = x моль
тогда количество вещества оксида азота (IV) равно 4х моль:
n(NО2) = 4x моль
Количество образовавшегося оксида алюминия:
Количество и масса разложившегося нитрата алюминия:
mразлож(Al(NО3)3) = n·M = 0,12 моль · 213 г/моль = 25,56 г
С гидроксидом натрия реагирует и образовавшийся оксид алюминия, и остаток нитрата алюминия:
Определим массу и количество вещества гидроксида натрия:
m(NaOH) = ω(NaOH)·mр-ра(NaOH) = 0,40 ·60 г = 24 г
n(NaOH) = m(NaOH)/M(NaOH) = 24 г/40 г/моль = 0,6 моль
Определим количество гидроксида натрия, который потребуется для растворения оксида алюминия во второй реакции:
n2(NaOH) = 2n(Al2О3) = 2·0,06 моль = 0,12 моль
Тогда в первой реакции будет израсходовано:
n1(NaOH) = n(NaOH) – n2(NaOH) = 0,6 моль – 0,12 моль = 0,48 моль
Количество неразложившегося нитрата алюминия, который затем растворится в щелочи в первой реакции:
nнеразлож.(Al(NО3)3) = 1/4·n1(NaOH) = 1/4·0,48 моль = 0,12 моль
Масса этого неразложившегося нитрата алюминия:
mнеразлож.(Al(NО3)3) = nнеразлож.(Al(NО3)3)·M = 0,12 моль·213 г/моль = 25,56 г.
Масса исходного нитрата алюминия:
2. При нагревании карбоната магния часть вещества разложилась. При этом выделилось 5,6 л газа и образовалось 18,4 г твёрдого остатка. Остаток растворили в 365 г соляной кислоты, при этом массовая доля кислоты в конечном растворе составила 2,9%. Вычислите массовую долю соляной кислоты в исходном растворе.
Ответ: w(HCl) = 10%
3. При нагревании хлората калия (KClO3) в присутствии катализатора часть вещества разложилась. При этом выделилось 6,72 л (н.у.) газа и образовался твёрдый остаток массой 16 г. К остатку добавили 170 г 30%-ного раствора нитрата серебра. Определите массовую долю нитрата серебра в полученном растворе. (KClO3 и AgClO3 растворимы в воде.)
Ответ: w(AgNO3) = 10,8%
4. При нагревании образца нитрата магния часть вещества разложилась. При этом выделилось 10,08 л (в пересчёте на н.у.) смеси газов. Масса твёрдого остатка составила 69,36 г. К этому остатку последовательно добавили 100 мл воды и 240 г 20%-ного раствора гидроксида натрия. Определите массовую долю гидроксида натрия в образовавшемся растворе.
Ответ: w(NaOH) = 3,8%
5. При нагревании образца нитрата меди(II) часть вещества разложилась. При этом образовался твёрдый остаток массой 50,8 г. К остатку добавили 150 г 20%-ного раствора гидроксида натрия. При этом образовался раствор с массой 159 г и массовой долей гидроксида натрия 13,84%. Определите объём смеси газов (в пересчёте на н.у.), выделившихся в результате частичного разложения нитрата меди(II).
Ответ: V(смеси газов) = 22,4 л
6. При нагревании образца нитрата серебра часть вещества разложилась. При этом образовался твёрдый остаток массой 88 г. К этому остатку добавили 200 г 20%-ного раствора соляной кислоты. При этом образовался раствор массой 205,3 г с массовой долей соляной кислоты 15,93%. Определите объём смеси газов (в пересчёте на н.у.), выделившихся в результате частичного разложения нитрата серебра.
Ответ: V(смеси газов) = 16,8 л
7. При нагревании образца карбоната бария часть вещества разложилась. При этом выделилось 1,12 л (н.у.) газа. Масса твёрдого остатка составила 27,35 г. Этот остаток добавили к 73 г 30%-ного раствора соляной кислоты. Определите массовую долю кислоты в полученном растворе.
Ответ: w(HCl) = 11,4%
8. При нагревании образца нитрата цинка часть вещества разложилась. При этом выделилось 5,6 л (в пересчёте на н.у.) смеси газов. Масса твёрдого остатка составила 64,8 г. Остаток полностью растворили в минимальном объёме 28%-ного раствора гидроксида натрия. Определите массовую долю нитрата натрия в полученном растворе.
Ответ: w(NaNO3) = 19,26%
9. При нагревании образца нитрата серебра часть вещества разложилась. При этом выделилось 6,72 л (в пересчёте на н.у.) смеси газов. Масса твёрдого остатка составила 25 г. К этому остатку последовательно добавили 50 мл воды и 18,25 г 20%-ного раствора соляной кислоты. Определите массовую долю соляной кислоты в полученном растворе.
Ответ: w(HCl) = 4,2%
10. При нагревании образца нитрата меди(II) массой 94 г часть вещества разложилась. При этом выделилось 11,2 л (в пересчёте на н.у.) смеси газов. К полученному твёрдому остатку добавили 292 г 10%-ного раствора соляной кислоты. Определите массовую долю соляной кислоты в полученном растворе.
Ответ: w(HCl) = 4%
11. При нагревании образца нитрата магния часть вещества разложилась. При этом образовался твёрдый остаток массой 15,4 г. Этот остаток прореагировал с 20 г 20%-ного раствора гидроксида натрия. Определите массу исходного образца нитрата магния и объём смеси газов (в пересчёте на н.у.), выделившихся при частичном разложении нитрата магния.
Ответ: m(Mg(NO3)2) = 37 г, V(смеси газов) = 11,2 л
12. При нагревании образца карбоната бария часть вещества разложилась, при этом выделилось 4,48 л (н.у.) газа. К образовавшемуся твёрдому остатку последовательно добавили 100 мл воды и 200 г 20%-ного раствора сульфата натрия. Вычислите массовую долю гидроксида натрия в полученном растворе.
Ответ: w(NaOH) = 5,6%
13. Оксид меди(II) массой 16 г нагрели в присутствии водорода объёмом 3,36 л (н.у.). При этом водород прореагировал полностью. Полученный твёрдый остаток растворили в 535,5 г 20%-ного раствора азотной кислоты, при этом наблюдали выделение бесцветного газа. Определите массовую долю азотной кислоты в образовавшемся растворе.
Ответ: w(HNO3) = 13,84%
14. При нагревании образца нитрата железа(III) часть вещества разложилась. При этом образовалось 88,6 г твёрдого остатка. Этот остаток может прореагировать с 225 г 16%-ного раствора гидроксида натрия. Определите массу исходного образца нитрата железа(III) и объём выделившейся смеси газов (в пересчёте на н.у.).
Ответ: m(Fe(NO3)3) = 121 г, V(смеси газов) = 16,8 л
15. При нагревании образца гидрокарбоната натрия часть вещества разложилась. При этом выделилось 0,448 л (н.у.) углекислого газа и образовалось 4,64 г твёрдого безводного остатка. Остаток добавили к 0,15%-ному раствору гидроксида кальция. При этом в полученном растворе не осталось ионов кальция и карбонат-анионов. Определите массовую долю гидроксида натрия в конечном растворе.
Ответ: w(NaOH) = 0,11%
16. При нагревании образца карбоната кальция часть вещества разложилась. При этом выделилось 4,48 л (н.у.) углекислого газа. Масса твёрдого остатка составила 41,2 г. Этот остаток добавили к 465,5 г раствора соляной кислоты, взятой в избытке. Определите массовую долю соли в полученном растворе.
Ответ: w(CaCl2) = 11,2%
17. При нагревании образца нитрата магния массой 44,4 г часть вещества разложилась. При этом выделилось 13,44 л (в пересчёте на н.у.) смеси газов. К полученному твёрдому остатку добавили 124,1 г 20%-ного раствора соляной кислоты. Определите массовую долю соляной кислоты в полученном растворе.
Ответ: w(HCl) = 5,1%
18. При нагревании образца нитрата меди(II) часть вещества разложилась. При этом выделилось 5,6 л (в пересчёте на н.у.) смеси газов. Масса твёрдого остатка составила 26,8 г. К этому остатку последовательно добавили 50 мл воды и 10%-ный раствор гидроксида натрия в количестве, необходимом для полного осаждения ионов меди. Определите массовую долю нитрата натрия в образовавшемся растворе.
Ответ: w(NaNO3) = 12,2%
19. При нагревании образца нитрата меди(II) часть вещества разложилась. При этом выделилось 2,8 л (в пересчёте на н.у.) смеси газов. Масса твёрдого остатка составила 32,2 г. К этому остатку последовательно добавили 50 мл воды и 160 г 10%-ного раствора гидроксида натрия. Определите массовую долю гидроксида натрия в образовавшемся растворе.
20. При нагревании образца нитрата алюминия часть вещества разложилась. При этом выделилось 6,72 л (в пересчёте на н.у.) смеси газов. Масса твёрдого остатка составила 25,38 г. Остаток полностью растворили в необходимом для реакции минимальном объёме 24%-ного раствора гидроксида натрия. При этом образовался тетрагидроксоалюминат натрия. Определите массовую долю нитрата натрия в полученном растворе.
Ответ: w(NaNO3) = 24,2%
21. При нагревании образца гидрокарбоната натрия часть вещества разложилась. При этом выделилось 4,48 л (н.у.) газа и образовалось 63,2 г твёрдого безводного остатка. К полученному остатку добавили минимальный объём 20%-ного раствора соляной кислоты, необходимый для полного выделения углекислого газа. Определите массовую долю хлорида натрия в конечном растворе.
Ответ: w(NaCl) = 26,8%
22. При нагревании образца нитрата магния часть вещества разложилась. При этом образовался твёрдый остаток массой 53,6 г. К остатку добавили 200 г 24%-ного раствора гидроксида натрия. При этом образовался раствор с массой 206,4 г и массовой долей гидроксида натрия 15,5%. Определите объём смеси газов (в пересчёте на н.у.), выделившихся в результате частичного разложения нитрата магния.
Ответ: V(смеси газов) = 33,6 л
23. При нагревании образца карбоната бария часть вещества разложилась. При этом выделилось 4,48 л (н.у.) газа и образовалось 50 г твёрдого остатка. К остатку последовательно добавили 100 мл воды и 200 г 20%-ного раствора сульфата натрия. Вычислите массовую долю гидроксида натрия в полученном растворе.