какая модель атома была предложена первой
Как менялась атомная модель на протяжении многих лет?
От эпохи древнегреческой философии до современной квантовой механики атомная теория получала множество обновлений, и каждое из них было весьма революционным для своего времени.
Наше понимание природы окружающих нас вещей продолжает меняться с течением времени. То, что кажется нам очевидным сейчас, могло бы не существовать столетие назад или устареть в ближайшие десятилетия. Прекрасным примером того, как наука совершенствуется с течением времени, является эволюция атомной теории.
Давайте начнем со старых добрых времен, когда наука была не доказательной базой, а философией, и люди верили, что все состоит только из четырех элементов. Представьте себе, насколько простой была бы химия в те времена.
Демокрит
Но эта теория была в значительной степени дискредитирована Аристотелем, который считал, что все на нашей планете состоит из четырех элементов: земли, огня, воды и воздуха.
Джон Дальтон
Следующая остановка в атомной теории произошла спустя почти 2000 лет, от британского химика и любителя метеорологии Джона Дальтона. Он проводил эксперименты, в которых смешивал два газа и наблюдал за их поведением. Большинство газов, которые он тестировал, существовали независимо, не беспокоясь о присутствии другого. Но он обнаружил нечто иное, когда оксиду азота позволили взаимодействовать с атмосферным кислородом. 36 мер чистого азотистого газа прореагировали со 100 мерами воздуха и дали 80 мер нового газа, который не был ни азотистым, ни кислородным.
Это вызвало у него любопытство, поэтому он провел один и тот же эксперимент с разными объемами газа. Он заметил, что газы реагируют друг с другом только в фиксированном соотношении. Это породило закон кратных отношений и теорию атомизма.
Джозеф Джон Томсон
Джозеф Джон Томсон
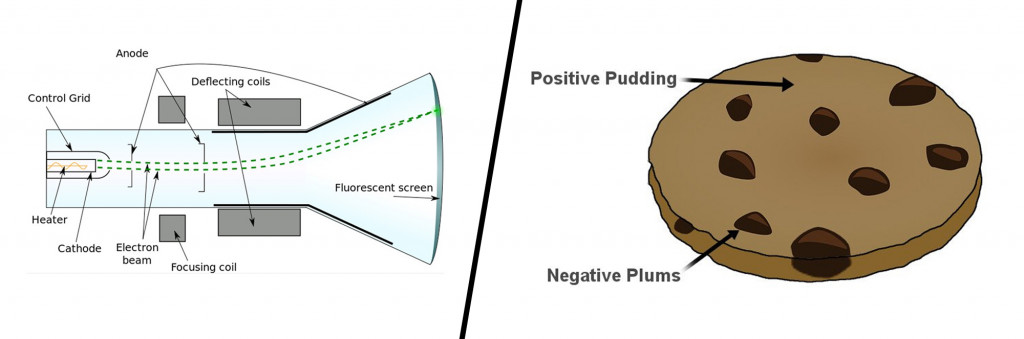
До конца 19 века атомы представлялись неделимыми частицами, но первым, кто разрушил это представление, был английский физик Джозеф Джон Томсон и его надежная катодно-лучевая трубка. Внутри почти вакуумной стеклянной трубки видимый пучок частиц или катодных лучей генерировался путем приложения высокого напряжения к металлическим электродам. Поток частиц, образовавшихся из металла, отклонялся от отрицательного заряда в сторону положительного заряда.
Повторив этот эксперимент несколько раз с другими металлами, он придумал первую атомную модель. Его знаменитая модель сливового пудинга описывала атом как частицу, состоящую из положительно заряженной массы (пудинг) с крошечными отрицательными зарядами, встроенными в нее (как сливы).
Модель катодно-лучевой трубки и сливового пудинга
Эрнест Резерфорд
После некоторого первоначального сопротивления эта модель стала довольно популярной в научном мире. Тем не менее уроженец Новой Зеландии Эрнест Резерфорд не был в этом уверен. В начале 1900-х годов радиоактивность была в моде, и Резерфорд во время своей работы по радиоактивному распаду открыл альфа, бета и гамма-лучи. Он хотел разработать метод альфа-частиц и использовать его для исследования структуры атома.
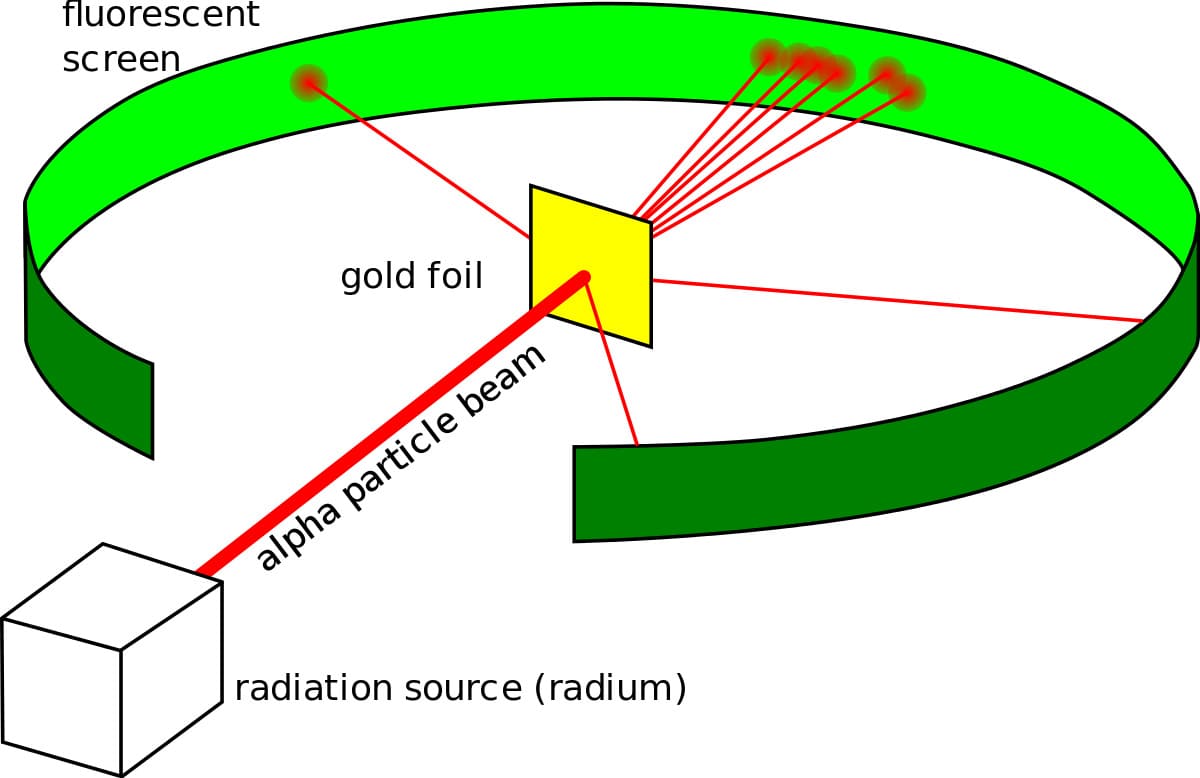
Он сделал то, что делал каждый физик в то время, он поставил эксперимент. Эксперимент с золотой фольгой, также известный как эксперименты Гейгера-Марсдена, состоял из тонкой золотой фольги с круглым экраном, покрытым сульфидом цинка за ней, который вспыхивал каждый раз, когда в нее попадала альфа-частица. Резерфорд ожидал, что частицы вылетают из фольги и ударяются об экран позади нее. Хотя большинство частиц действительно вели себя так, как ожидалось, некоторые из них отклонились на угол более 90 градусов.
Эксперимент Гейгера-Марсдена с золотой фольгой.
Нильс Бор
Через год после публикации атомной теории Резерфорда Нильс Бор обнаружил несоответствие в этой модели. Если бы электроны вращались вокруг положительно заряженного центра, то в какой-то момент эти электроны потеряли бы свою энергию и упали на ядро, сделав атомы нестабильными. Но этого не происходило, атомы были довольно стабильны (кроме радиоактивных).
Несмотря на то, что модель Бора не соответствует действительности для сложных многоэлектронных систем, она по-прежнему является наиболее популярным представлением атомной структуры в большинстве учебников.
Атомная модель Шредингера
Как бы мы ни старались, сложностей квантовой механики не избежать. С установлением квантового поведения таких сущностей, как электрон, стало совершенно ясно, что атомная модель Бора не удовлетворяет принципу неопределенности Гейзенберга. Согласно принципу неопределенности, невозможно узнать точное положение и траекторию движения электронов в атоме, а значит, они не могут существовать на фиксированных орбитах, как предполагал Бор.
Объединив концепцию двойственности волна-частица и принцип неопределенности, Эрвин Шредингер придумал квантово-механическую модель атома. В этой модели электроны вращались вокруг ядра не по круговым орбитам, а в виде электронных облаков на атомной орбитали, которая представляет собой область внутри атома, где вероятность нахождения электрона наиболее высока. Он также сформулировал волновые уравнения Шредингера, которые помогут нам точно рассчитать энергию уровней электронов в атоме. Эта новая и усовершенствованная атомная модель не говорит нам, где находится электрон, но где он может находиться.
Человечество всегда мучилось вопросами: Из чего состоят окружающие нас вещи? И почему они ведут себя по-разному?
И каждый шаг в развитии атомной теории приближал нас к пониманию секретов субатомных частиц, управляющих нашим живым и ярким миром.
История развития представлений о строении атома
Все тела живой и неживой природы, несмотря на их разнообразие, состоят из мельчайших частиц — атомов. Первым, кто высказал предположение об этом, считается древнегреческий философ Демокрит. Именно он назвал атомом мельчайшую неделимую частицу образующую вещество (атом в переводе с др.греч «неделимый»). Лишь в конце XIX в. были сделаны открытия, показавшие сложность строения атома, что атомы разлагаются на более мелкие элементарные частицы и таким образом «атомами» в Демокритовском смысле не являются. Тем не менее, термин используется и теперь в современной химии и физике, несмотря на несоответствие его этимологии современным представлениям о строении атома.
Первые представления об атоме
Демокрит считал, что если разделить, например, яблоко на две половины, затем одну из них еще на две части, и продолжать деление таким образом до тех пор пока результат деления перестанет быть яблоком, то мельчайшая частица которая все еще сохраняет свойство яблока является атомом яблока (т.е. неделимой частью яблока). Он утверждал, что атомы существуют вечно; они настолько малы, что их размеры не поддаются измерению; все атомы одинаковы, но они различаются внешне (атомы воды, например, гладкие, они способны перекатываться, и поэтому жидкости свойственна текучесть; атомы железа имеют зубчики, которыми они зацепляются друг за друга, что придает железу свойства твердого тела). Представления Демокрита были умозрительными.
Группу греческих философов, придерживавшихся того взгляда, что существуют подобные крошечные неделимые частицы, называли атомистами. Атоми́зм — натурфилософская теория, согласно которой чувственно воспринимаемые (материальные) вещи состоят из химически неделимых частиц — атомов. (В современной физике вопрос об атомизме является открытым. Некоторые теоретики придерживаются атомизма, но под атомами подразумевают фундаментальные частицы, которые далее неделимы).
Основы атомной теории строения вещества

Дальтон был одним из самых знаменитых и уважаемых учёных своего времени, ставший широко известным благодаря своим новаторским работам в разных областях знания. Он впервые (1794) провёл исследования и описал дефект зрения, которым страдал сам, — цветовая слепота, позже названный в его честь дальтонизмом; открыл закон парциальных давлений (закон Дальтона) (1801), закон равномерного расширения газов при нагревании (1802), закон растворимости газов в жидкостях (закон Генри-Дальтона). Установил закон кратных отношений (1803), обнаружил явление полимеризации (на примере этилена и бутилена).
Однако вопрос о внутреннем строении атомов даже не возникал, так как атомы считались неделимыми.
В 1897 г. английский физик Дж. Томсон изучая катодные лучи, пришел к выводу, что атомы любого вещества содержат отрицательно заряженные частицы, которые он назвал электронами. Огромной заслугой Томсона явилось доказательство того, что все частицы, образующие катодные лучи, тождественны друг другу и входят в состав вещества. Он предложил первую модель атома — «пудинг с изюмом» 1904 г.
По мысли Томсона, положительный заряд атома занимает весь объем атома и распределен в этом объеме с постоянной плотностью,в положительно заряженной сфере находится несколько электронов, так что атом подобен кексу, в котором роль изюминок играют электроны.
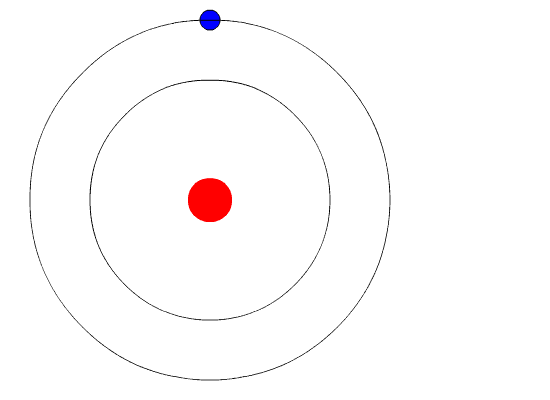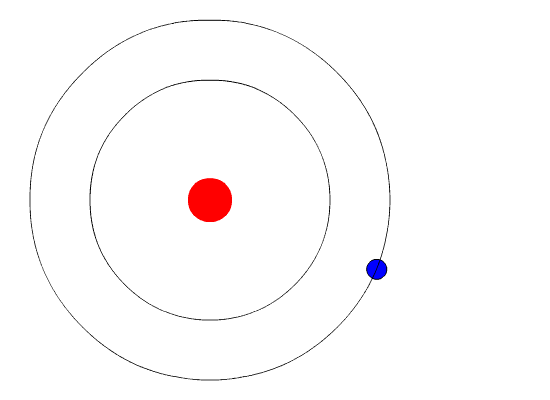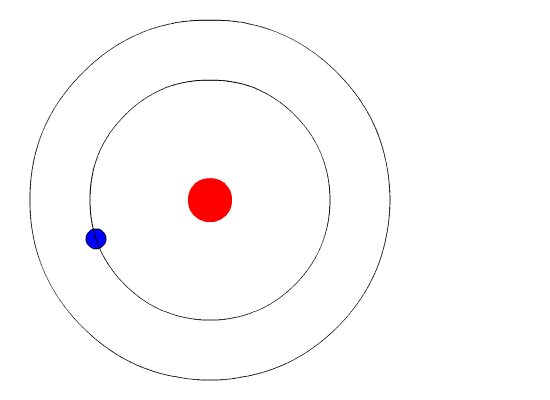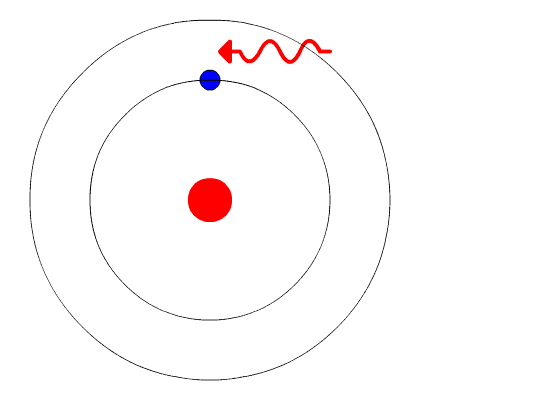
Ядерная модель атома (планетарная)
Резерфорд бомбардировал α-частицами атомы тяжелых элементов (золото, серебро, медь и др.). α-частицы – это полностью ионизированные атомы гелия. Электроны, входящие в состав атомов, вследствие малой массы не могут заметно изменить траекторию α-частицы. Рассеяние, то есть изменение направления движения α-частиц, может вызвать только тяжелая положительно заряженная часть атома.
Было обнаружено, что большинство α-частиц проходит через тонкий слой металла, практически не испытывая отклонения. Однако небольшая часть частиц отклоняется на значительные углы, превышающие 30°. Очень редкие α-частицы (приблизительно одна на десять тысяч) испытывали отклонение на углы, близкие к 180°.
Этот результат был совершенно неожиданным даже для Резерфорда. Он находился в резком противоречии с моделью атома Томсона, согласно которой положительный заряд распределен по всему объему атома. При таком распределении положительный заряд не может создать сильное электрическое поле, способное отбросить α-частицы назад.
Эти соображения привели Резерфорда к выводу, что атом почти пустой, и весь его положительный заряд сосредоточен в малом объеме. Эту часть атома Резерфорд назвал атомным ядром. Так возникла ядерная модель атома (планетарная):
1. В центре атома находится положительно заряженное ядро, занимающее ничтожную часть пространства внутри атома.
2. Весь положительный заряд и почти вся масса атома сосредоточены в его ядре (масса электрона равна 1/1823 а.е.м.).
3. Вокруг ядра вращаются электроны. Их число равно положительному заряду ядра.
Но на основе этой модели нельзя объяснить факт существования атома, его устойчивость. Ведь движение электронов по орбитам происходит с ускорением, причем весьма немалым. Ускоренно движущийся электрон по законам электродинамики должен терять энергию и приближаться к ядру. Как показывают расчеты, основанные на механике Ньютона и электродинамике Максвелла, электрон за ничтожное время должен упасть на ядро. Атом должен прекратить свое существование. В действительности ничего подобного не происходит. Атомы устойчивы и в невозбужденном состоянии могут существовать неограниченно долго, совершенно не излучая электромагнитные волны. Не согласующийся с опытом вывод о неизбежной гибели атома вследствие потери энергии на излучение — это результат применения законов классической физики к явлениям, происходящим внутри атома. Отсюда следует, что к явлениям атомных масштабов законы классической физики неприемлемы.
Датским физик Нильс Бор (1885 — 1962) считал что поведение микрочастиц нельзя описывать теми же законами, что и макроскопических тел.
Бор предположил, что величины характеризующие микромир, должны квантоваться, т.е. они могут принимать только определенные дискретные значения.
Законы микромира — квантовые законы! Эти законы в начале 20 столетия еще не были установлены наукой. Бор сформулировал их в виде трех постулатов. дополняющих ( и «спасающих») атом Резерфорда. Его теория впоследствии привела к созданию стройной теории движения микрочастиц — квантовой механики.

Согласно второму постулату Бора излучение света происходит при переходе атома из стационарного состояния с большей энергией в стационарное состояние с меньшей энергией. Энергия излученного фотона равна разности энергий стационарных состояний.
Квантовая теория строения атома
Теорию Бора сменила квантовая теория, которая учитывает волновые свойства электрона и других элементарных частиц, образующих атом.
В основе современной теории строения атома лежат следующие основные положения:
1. Электрон имеет двойственную (корпускулярно-волновую) природу. Он может вести себя и как частица, и как волна, подобно частице, электрон обладает определенной массой и зарядом; в то же время, движущийся электрон проявляет волновые свойства, например, характеризуется способностью к дифракции. Длина волны электрона λ и его скорость v связаны соотношением де Бройля:
λ = h / mv, где m — масса электрона.
2. Для электрона невозможно одновременно точно, измерить координату и скорость. Чем точнее мы измеряем скорость, тем больше неопределенность в координате, и наоборот. Математическим выражением принципа неопределенности Гейзенберга служит соотношение
∆x∙m∙∆v > ћ/2,
где ∆х — неопределенность положения координаты, ∆v — погрешность измерения скорости.
3. Электрон в атоме не движется по определенным траекториям, а может находиться в любой части около ядерного пространства, однако вероятность его нахождения в разных частях этого пространства неодинакова. Пространство вокруг ядра, в котором вероятность нахождения электрона достаточно велика, называют орбиталью.
4. Ядра атомов состоят из протонов и нейтронов (общее название — нуклоны). Число протонов в ядре равно порядковому номеру элемента, а сумма чисел протонов и нейтронов соответствует его массовому числу.
Последнее положение было сформулировано после того, как в 1920 г. Э.Резерфорд открыл протон, а в 1932 г. Дж.Чедвик — нейтрон.
Различные виды атомов имеют общее название — нуклиды. Нуклиды достаточно характеризовать любыми двумя числами из трех фундаментальных параметров: А — массовое число, Z — заряд ядра, равный числу протонов, и N — число нейтронов в ядре. Эти параметры связаны между собой соотношениями:
Z = А — N,
N = А — Z,
А= Z + N.
Нуклиды с одинаковым Z, но различными А и N, называют изотопами.
Сформулированные выше положения составляют суть новой теории, описывающей движение микрочастиц, — квантовой механики (механику, применимую к движению обычных тел и описываемую законами Ньютона, стали называть классической механикой). Наибольший вклад в развитие этой теории внесли француз Л. де Бройль, немец В.Гейзенберг, австриец Э.Шредингер, англичанин П.Дирак. Впоследствии каждый из этих ученых был удостоен Нобелевской премии.
Квантовая механика — математически очень сложная теория. Но главная трудность не в этом. Процессы, которые описывает квантовая механика, — процессы микромира — недоступны не только восприятию нашими органами чувств, но и воображению. Люди лишены возможности представить их себе наглядно в полной мере, так как они совершенно отличны от тех макроскопических явлений, которые человечество наблюдало на протяжении миллионов лет. Человеческое воображение не создает новые, а лишь комбинирует известные, поэтому практически невозможно на нашем макроскопическом языке описать поведение фотонов и других частиц.
Теория строения атома
Благодаря существованию у человека хорошего вкуса он имеет возможность подсознательного интуитивного принятия верных решений в повседневной деятельности. Стремление к элегантности в науке всегда делало её более совершенной.
Основным источником сведений о строении мельчайших частиц материи, в частности химических частиц (атомов, молекул, ионов), является экспериментальное исследование их свойств. После обобщения экспериментальных данных создавались теории строения этих частиц, содержащих определенную совокупность представлений и постулатов. Любая такая теория ограничена, так как описывает определенную совокупность экспериментальных фактов, возможно очень большую, но часто где-то оказывается предел её возможностей и за этой чертой без дальнейшего ее развития теория становится непригодной и тормозит дальнейшее развитие науки.
Был период бурного развития науки конца XIX столетия и первой половины XX века, когда почти ежегодно делались фундаментальные открытия, которые в течение следующего года воплощались в практику, например, в 1895 году состоялось открытие Рентгеном Х-лучей, которые уже в 1896 году начали использоваться в практической медицине, и в том же 1896 году Беккерель открыл явление радиоактивности солей урана. По сравнению с теми годами, сейчас положение вещей в фундаментальной науке можно назвать периодом застоя, когда развитие техники осуществляется только за счет обычного совершенствования технологий, в частности наращивания объема памяти компьютеров, смартфонов, запасов энергии аккумуляторов и тому подобное. Это можно объяснить только тем, что либо уже все открыто, либо предыдущие фундаментальные теории исчерпали себя, являются неверными и уже тормозят развитие науки. Поэтому необходимо создавать новые теории, которые лучше объясняли бы известные экспериментальные данные и создавали возможности для движения фундаментальной науки вперед.
По моему мнению, сейчас между классической, проверенной временем, теорией химического строения и современной квантовой механикой содержится значительный разрыв, обусловленный ложным пониманием физической сути поведения электрона в атоме. Слишком много в квантовой механике нерешенных вопросов, которые непонятны не только школьникам, но и их учителям и академикам. Среди них: что заставляет электрон двигаться по вытянутой гантелеобразной р-орбите (как написано в школьных учебниках), траектория которой проходит через ядро, почему электрон при этом не падает на ядро и не излучает во время своего углового ускорения по такой орбите свет? При этом отсутствуют доказательства существования такой формы электронной орбиты, иначе говоря, такие орбиты никто не видел.
Сейчас возможно получение правильных квантовых количественных расчетов только для простейшего атома водорода, но ни для одного другого многоэлектронного атома. При этом отсутствует корреляция между теоретическим и экспериментальным орбитальным магнитным спином. Невозможно объяснить, почему ядро, имеющее собственный спин, стабильно находится на своем месте в центре совокупности гантелеобразных электронных орбиталей. Когда спрашиваешь об этом физика, он обычно отвечает, что это представление о гантелеобразную электронную орбиту не имеет физического смысла и является условным, и достаточно только математического описания поведения электрона в атоме.
Планетарная модель строения атома была предложена Резерфордом в 1911г. Позже от нее отказались из-за невозможности объяснения движения электрона по кругу без излучения. Сейчас физики не представляют себе строение атома, а просто описывают его математически сложным трехмерным дифференциальным уравнением Шредингера. Но даже для атома водорода решение этого уравнения не совсем верно из-за элементарных функций. Для атомов, имеющих два и более электронов, уравнение Шредингера не может быть решено даже численным образом.
Не верится, что строение атома невозможно себе представить. По моему, всё возможно себе представить, и если эта воображаемая модель будет правильная, то все формулы и расчеты будут сходиться. Из базовых принципов строения атома совсем не вытекает, почему именно 2 элемента содержатся в I-м периоде периодической системы элементов, восемь во II-м и III-м периодах, восемнадцать в IV-м и V-м периодах, тридцать два в VI-м периоде. Почему происходит такая характерная периодическая смена радиусов атомов и их первых потенциалов ионизации? И почему вообще существует периодическая система элементов. Напротив, существование различных типов химических связей, магнитных свойств веществ, сверхпроводимости объясняется введением надуманных и искусственных понятий типа sp-гибридизации. Такие искусственные объяснения и неочевидные предположения, которые затрудняют общую картину, обычно используются в случаях, когда возникают проблемы в основном алгоритме определенного явления или проблемы. Непонятно также, почему валентность равна 8, а также почему все физико-математические расчеты поведения электронов в атоме, более сложном, чем атома водорода, являются неточными. Поэтому не удается создать точный магнитно-резонансный томограф, настроенный на атомы других важных биологических элементов, кроме атома водорода, например на атом углерода, азота или кислорода. И для уточненного описания поведения электрона в многоэлектронных атомах ученые вынуждены подгонять формулы, вводя какие-то дополнительные коэффициенты, используются приближенные методы, в частности теории возмущений.
На самом деле, в атоме водорода содержит только одно электронное кольцо, что является простым и верным решением, с которым никто не спорит, потому что оно согласуется со всеми расчетами и современными представлениями об s-электроне. Этот единственный электрон вращается по кругу вокруг ядра, которое находится в центре этого круга. Это кольцо может свободно вращаться вокруг ядра, образуя сферу. В атоме гелия первый электронный уровень дополняется вторым, который представляет собой параллельно расположено кольцо с противоположным первому направлением движения электрона. Противоположное направление движений второго необходимо для компенсации магнитного момента, возникающего во время движения первого электрона.
Подобные кольцеобразные модели рисовали и американский архитектор К.Снельсон в 1963 году, и позднее были сконструированы объемные модели в образовательных целях российским педагогом Д.Кожевниковым. Однако они не связывали и не связывают расположение этих колец с потоками электронов, поэтому 32-электронная орбита у них смоделирована неправильно. Траектория движения электрона по периметру всего уровня 8-, 18- и 32-электронных орбит выглядит волнообразной, и, учитывая корпускулярно-волновой дуализм частиц микромира, этот процесс можно описать термином «стоячая волна».
При наличии на орбите одного электрона только он движется по всем кольцам, переходя из одного кольца на другое. При расположении на орбите нескольких электронов, их может расположиться не более одного электрона на одно кольцо. БОльшая вероятность или расположение нескольких электронов в каком-либо из восьми колец уровня обусловлена необходимостью постоянного сохранения максимально полной компенсации момента атома и симметрии электромагнитных моментов, которая происходит в такой конструкции автоматически. Заполнение электронами всего уровня орбиты создает для каждого отдельного электрона возможность длительного времени пребывания в идеальных для себя условиях кругового движения в пределах одного кольца без всяких флуктуаций, тогда химические свойства атома становятся инертными.
Второй 8-електронний уровень образуется на определенном расстоянии от первого. Радиус атома при этом увеличивается. Кольца обоих уровней располагаются друг против друга, но направление движения электронов в них противоположный, что обеспечивает полную магнитную компенсацию атома.
При невозможности построения в рамках 8-кольцевой орбиты симметричной и компенсированной по всем показателям конструкции с незаполненными полностью 8 кольцами, один или несколько электронов становятся слабо локализованными в определенном кольце. Тогда может происходить конформация в 6-кольцевую не спаренную модель, объясняющую аномально низкие первые потенциалы ионизации газообразных атомов бора и кислорода в ряду их роста во втором периоде к подобным потенциалам атомов в других периодах.
В отличие от атомов молекулы всегда создают спаренные кольцевые электронные орбиты. Этим можно объяснить, что в природе преобладают молекулы, а не атомы. Недостаточная заполненность электронами энергетических уровней единичного атома побуждает его к объединению с другими атомами для взаимного достижения идеальной электронной конфигурации. При этом одно из электронных кольцо атома встраивается в кольцо 8-кольцевого уровня другого атома. Так возникают химические реакции.
Учитывая направление движения электронов по кольцам 8-кольцевой модели атома углерода можно объяснить наличие противоположных кольцевых потоков совместных электронов над и под круговой молекулой бензола (если ее представить в горизонтальной плоскости), что придает молекуле дополнительную устойчивость именно в кольцеобразном варианте строения.
В свою очередь, спаривание больших электронных колец приводит к образованию пуриновыми и пиримидиновыми основаниями, которые являются производными бензола, спиральной молекулы нуклеиновой кислоты ДНК или РНК. Можно утверждать, что природа стала живой, то есть самовоспроизводимой, благодаря энергии, содержащейся в атоме. Молекула ДНК по сути концентрирует и направляет в определенных направлениях электронные потоки, она может создавать различные комбинации электромагнитных полей. Поэтому она может легко конформироваться для активизации определенных своих участков, выходящих наружу, а другие участки при этом скрываются внутри и становятся неактивными. Вероятно, что ДНК клеток под суммарным воздействием электромагнитных полей других ДНК постоянно конформируется в процессе роста зародыша и плода человека. Таким образом, каждая ДНК в клетке, как в голограмме несет информацию обо всем организме.