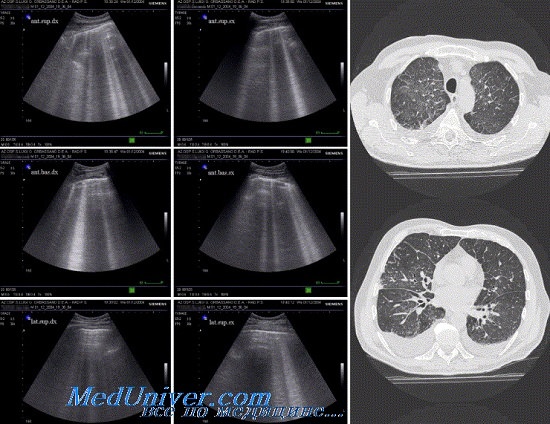
какая норма жидкости в легких
Какая норма жидкости в легких
Наиболее важными и универсальными для осумкованных и свободных выпотов являются два фактора, которые во многом обусловливают их эхокартину — объем и этиология содержимого плевральной полости. Объем определяет пространственную конфигурацию выпота, т.е. его форму и, отчасти, распространенность, а этиология — эхоструктуру и эхогенность плеврального содержимого, а также состояние листков плевры. В связи с этим изучение ультразвуковой картины выпотов должно проводиться по двум основным направлениям — оценка объема и оценка эхоструктуры.
Существуют различные способы математического расчета объема выпота, среди которых наиболее распространена формула, предложенная G. Mathis (1996): Объем (в мл) = (h + b)x 70, где h — максимальный кранио-каудальный размер выпота вдоль грудной стенки (см); Ь — базальнос периферическое расстояние от диафрагмы до нижнего края легкого (см); 70 — эмпирически выведенный коэффициент.
Для определения объема выпота мы используем не математические расчеты, а разработанную нами последовательность изменения эхокартины выпота в зависимости от его объема при условии свободного распространения жидкости в плевральной полости.
Все варианты эхокартины получены при продольном или поперечном сканировании преимущественно задних и заднебоковых отделов полости плевры в месте максимального скопления содержимого. Приводимые цифры объема жидкости ориентировочные, но достаточно точные и получены в результате многократного сопоставления эхокартины выпота с данными плевральных пункций. При оценке объема выпота обязательно следует учитывать эхогенные компоненты в виде фибриновых нитей и, особенно, перегородок, поскольку, кроме занимаемого объема, они могут ограничивать свободное перемещение жидкости и препятствовать ее эвакуации во время пункции. Особое внимание необходимо обращать на полные перегородки, разделяющие выпот на отдельные, возможно, не сообщающиеся между собой камеры, и на наличие эхогенной фибриновой сети.
При эхографии минимальное количество свободной жидкости определяется в заднем реберно-диафрагмальном плевральном синусе, начиная с объема около 5 мл.
При продольном сканировании из межреберья над проекцией синуса выпот имеет вид узкого, анэхогенного треугольника или клипа, вытянутого в вертикальном направлении вершиной вниз. По мере увеличения жидкости площадь анэхогенного пространства увеличивается, но клиновидная или остроконечная треугольная форма сохраняется. Оно лоцируется поверхностно, непосредственно позади мягких тканей грудной стенки и ограничено снаружи грудной стенкой, снизу и изнутри — эхогенной линией диафрагмы.
При использовании высокочастотного датчика лоцируются костальный и диафрагмальный листки париетальной плевры, выстилающие синус и отграничивающие аиэхогенное содержимое в нем. При перемещении датчика от заднего синуса вдоль латеральной поверхности грудной клетки к его переднему отделу площадь выпота уменьшается, что обусловлено меньшей анатомической глубиной синуса спереди.
При нормальной дыхательной подвижности нижнего края легкого на вдохе в синус достаточно глубоко проникает пристеночная гиперэхогенная линия. Реверберации позади нее обычно перекрывают верхнюю границу жидкости, поэтому для адекватной визуализации минимального выпота и правильной оценки его объема сканирование следует проводить в фазе глубокого выдоха с небольшим краниальным наклоном датчика. Выше синуса гиперэхогеппая поверхность легкого при дыхании скользит вплотную к грудной стенке, тогда как в самом синусе может частично отделяться от нее узким слоем анэхогенной жидкости.
Возникающие плевральные сращения часто приводят к ограничению дыхательных экскурсий легкого, что эхографически проявляется снижением дыхательной подвижности нижнего края легкого и уменьшением глубины его проникновения в синус на вдохе, а нередко и полным отсутствием такового.
При выраженных плевро-диафрагмальиых сращениях гиперэхогенная пристеночная линия отклоняется от грудной стенки внутрь, ее нижний край подтягивается ближе к диафрагме или вплотную соприкасается с ней. На вдохе он смещается незначительно и остается вне синуса. В таких случаях скопившаяся жидкость за пределами синуса распространяется преимущественно вдоль грудной стенки, в меньшей степени проникая под легкое. При нарастании объема выпота он будет иметь форму латинской буквы V, стороны которой соответствуют пристеночному и субпульмональному распространению жидкости.
При полной облитерации плеврального синуса жидкость не может в него проникнуть, поэтому плевральная полость в каудальном направлении завершается не его клиновидным остроконечным пространством, а закругленным дугообразным переходом утолщенной, с адгезивными изменениями костальной плевры в диафрагмальную выше заполненного эхогенными фибриновыми массами синуса.
Выпот не выходит за пределы синуса, пока его объем не превысит примерно 20—30 мл.
Вмещаемый объем жидкости во многом зависит от конституции пациента, наличия плевральных сращений и анатомического строения синуса. У астеников синусы более узкие и глубокие, вмещающие большее количество жидкости, у гиперстеников они более сглаженные, и жидкость из них раньше переходит в субпульмональное пространство. Возможен вариант анатомически глубокого синуса со значительным каудальным распространением. В таком случае следует проследить его на всю глубину. Плевральные сращения, наоборот, значительно уменьшают объем реберно-диафрагмального синуса, вплоть до полной его облитерации. В таких случаях жидкость первоначально скапливается не в синусе, а субпульмонально и пристеночно, и выпот приобретает приблизительно овальную форму, как при массивном осумковании.
Результативность медицинской помощи при наличии жидкости в плевральной полости: оценка пациентом выполненного лечебно-диагностического пособия
Жидкость в плевральной полости скапливается либо вследствие поражения выстилающей ее плевры, либо в связи с общими нарушениями водно-электролитного обмена в организме. Первое возникает при воспалениях плевры, вызванных возбудителями инфекционных болезней
Жидкость в плевральной полости скапливается либо вследствие поражения выстилающей ее плевры, либо в связи с общими нарушениями водно-электролитного обмена в организме. Первое возникает при воспалениях плевры, вызванных возбудителями инфекционных болезней, при поражении ее неопластическими процессами, инфильтрации лимфоидной или миелоидной тканью. Второе нередко наблюдается при травме, цинге, при болезнях, осложняющихся сердечной недостаточностью, нефротическим синдромом и при некоторых других.
Дифференциальный диагноз скопившейся жидкости в плевральной полости может быть подразделен на два этапа. Вначале производится идентификация синдрома, т. е. определяется его отличие от других синдромов со сходными клиническими признаками, после чего выясняется причина нарушения.
Физические признаки скопления жидкости в плевральной полости общеизвестны. При выраженном ее скоплении перкуссия по задней поверхности грудной клетки выявляет по акустическим свойствам три зоны. Над верхушкой легкого определяется ясный легочный звук, а над его основанием — тупой. Между ними определяется зона тимпанического перкуторного звука. Тимпанит обусловлен частичным ателектазом легкого, потерявшего в значительной мере свое напряжение.
Голосовое дрожание над зоной тупого перкуторного звука ослаблено или не определяется. Над зоной абсолютной тупости дыхательные шумы также не определяются или ослаблены. Над зоной тимпанического перкуторного звука выслушивается, как правило, ослабленное бронхиальное дыхание. Везикулярное дыхание определяется над зоной ясного легочного звука.
Несмотря на значительное число опознавательных признаков, диагноз «синдром жидкости в плевральной полости» нередко вызывает сомнения, большая часть которых исчезает после рентгенологического исследования. Диагностическую пункцию плевральной полости лучше производить после рентгенологического исследования. Она позволяет подтвердить наличие жидкости в плевральной полости и определить ее характер. Особенно часто дополнительные исследования приходится проводить для отличия синдрома жидкости в плевральной полости от пневмонии, опухоли легких и некоторых других болезней и синдромов.
Скопление жидкости в плевральной полости развивается вследствие повышенной проницаемости сосудов или механического нарушения их целостности. Повышенная проницаемость сосудов приводит к образованию транссудата. Воспалительное поражение плевры протекает с образованием экссудата. В зависимости от содержания форменных элементов крови экссудаты делятся на серозные, геморрагические и гнойные.
Причины скопления жидкости в плевральной полости:
Дифференциальный диагноз проводится с пневмонией, плевральными швартами, опухолью легкого или средостения, фибротораксом, эхинококковой кистой легкого, высоким стоянием диафрагмы.
Плевральная пункция относится к инвазивным методам диагностики и лечения. Процедура пункции достаточно болезненна и проводится под местной анестезией. К тому же данная манипуляция требует определенных практических навыков от медицинского персонала. Данный вид диагностики и лечения всегда вызывает эмоциональные переживания у пациента, его родственников и у медицинского персонала.
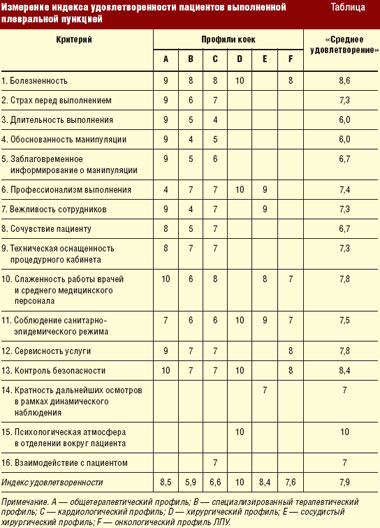
Нами выделены 16 показателей, связанных с оценкой больными деятельности медицинского персонала при проведении лечебно-дигностической плевральной пункции (табл.).
В процессе работы с больными нами разработан индекс удовлетворенности пациентов. Данный индекс отражает показатели, которые связаны с предлагаемыми медицинскими услугами и с взаимоотношениями между персоналом отделений и служб ЛПУ и пациентом.
Каждый пациент выбирает из предложенных показателей те, которые, по его мнению, являются наиболее важными. Эти показатели должны быть «взвешены», для того чтобы отразить относительные приоритеты и важность для определенных категорий пациентов. Затем, как показано в таблице, ежемесячно осуществляется процесс о6ратной связи в отношении удовлетворенности пациентов. Подразделения ЛПУ получают очки (от 1 до 10) по каждому из выбранных показателей; на основании полученных очков и подсчитывается степень удовлетворенности пациентов.
Пациенты хирургического, сосудистого хирургического и онкологического профилей оценивают преимущественно профессионализм выполнения манипуляции, слаженность работы врачей и среднего медицинского персонала, соблюдение санитарно-эпидемического режима и контроль безопасности инвазивного вмешательства.
Пациенты терапевтического, специализированного терапевтического и кардиологического профилей придают значение практически всем 16 предложенным для оценки критериям.
Самый высокий индекс удовлетворенности — 10,0 — имеют больные хирургических отделений.
Максимальное количество баллов выставляют пациенты по критериям «болезненность» и «контроль безопасности манипуляции» (среднее значение критериев соответственно 8,6 и 8,4), а так называемым лидером таблицы индекса удовлетворенности пациента стал критерий «психологическая атмосфера в отделении вокруг пациента» — 10,0.
Итак, следует отметить, что пациенты отделений различных профилей по-разному реагируют на те или иные аспекты выполнения пункции и по-разному их оценивают.
Больница же в целом постепенно «настраивается» на специфические показатели, которым придает значение пациент в процессе получения медицинской помощи.
Литература
А. Л. Верткин, доктор медицинских наук, профессор
И. В. Духанина, кандидат медицинских наук
МГМСУ, Москва
The measurement of lung water.
Neale R. Lange and Daniel P. Schuster
Статья опубликована в журнале Crit Care 1999, 3:R19–R24
РЕЗЮМЕ
Введение: в данном обзоре мы проводим сравнение современных методов количественной оценки отека легких.
Выводы: Стандартная рентгенограмма органов грудной клетки остается лучшим скрининговым методом для диагностики отека легких. Методы разведения индикатора, возможно, являются наилучшими для количественного определения содержания воды в легких.
ВВЕДЕНИЕ
EVLW=(Lp*S)[(Pc –Pi )–s(Пc – Пi)] – ток лимфы [1],
Это уравнение описывает формирование интерстициального отека. В последующем жидкость окажется уже в просвете альвеол, и такой отек легких уже будет называться альвеолярным (2,3). В норме ВСВЛ не превышает 500 мл (4-7). При альвеолярном отеке содержание воды в легких обычно на 75-100% превышает нормальные значения (8). Если это так, то начинает нарушаться функция легких. Итак, любой метод, который может использоваться в клинике для определения изменения содержания ВСВЛ, должен быть настолько чувствительным, чтобы выявлять эти изменения еще до развития альвеолярного отека.
Хотя пока не доказано, как исход отека легких зависит от его количественных характеристик (избытка воды и продолжительности), очень важно, чтобы мы и могли диагностировать отек легкого еще до того, как он перейдет в альвеолярную фазу, и проследить течение отека и его динамику при тех или иных методах лечения, в том числе и в эксперименте, и при исследовании новых лекарственных препаратов.
Идеальный метод диагностики отека легких должен быть точным, чувствительным, воспроизводимым, неинвазивным, практичным и недорогим (9). Но до сих пор такого метода изобретено не было. В эксперименте ВСВЛ можно определять с помощью гистологических и гравиметрических методов (10). В данном сравнительном обзоре мы уделили внимание тем методам, которые могут применяться в клинике.
МЕТОДЫ МЕДИЦИНСКОЙ ВИЗУАЛИЗАЦИИ
Общие рассуждения
Все методы медицинской визуализации способны давать дискретную информацию об объеме органа. Каждый двумерный (пиксел) или объемный (воксел) элемент изображения легких представляет собой также отражение определенного объема. Итак, можно ввести относительную единицу ВСВЛ (например, мл ВСВЛ на мл емкости легочной ткани). Так как легкие содержат воздух, количество легочной паренхимы, внутри которой может располагаться воксел, зависит от исходного состояния раздувания легочной ткани (объемов легких). Чтобы количественно оценить изменения ВСВЛ на изображения в абсолютных терминах, необходимо провести интегральную оценку сигнала со всего органа.
Рентгенография органов грудной клетки
2) По мере увеличения содержания ВСВЛ степень понижения прозрачности легочной ткани также возрастает (небольшой и умеренно тяжелый отек обычно занимает нижележащие отделы легких, в зависимости от положения тела больного, а тяжелый отек распространяется уже по всем легким (12)
3) По мере дальнейшего нарастания отека вода вытесняет воздух из альвеол, увеличивается плотность “инфильтратов” или “затенений” увеличивается, то есть легкие становятся все более “белыми”.
Хотя этот метод можно назвать неплохим в отношении качественной диагностики отека легких и обнаружения его причин, точность (то есть определение количества ВСВЛ) значительно ограничена режимами выполнения рентгеновского снимка и описанием (так как это не поддается стандартизации, особенно в условиях отделения интенсивной терапии) (13,14). Корреляция между количеством ВСВЛ, определенным на стандартных рентгенограммах, и результатами других методов, достаточно слаба (15).
Компьютерная рентгеновская томография
Главными преимуществами использования компьютерной рентгеновской томографии (КТ) перед конвенциональной рентгенографией является возможность количественной оценки плотности инфильтратов и естественно, более точное определение причины отека легких. Плотность легочной ткани можно определить количественно, так как при КТ используются такой количественный параметр, как единицы Хаунсфилда, которые калиброваны по объектам с известной плотностью. В эксперименте оказалось, что увеличение плотности легких на КТ в единицах Хаунсфилда соответствует увеличению плотности легочной ткани, измеренной гравиметрическим методом, на 250% (16) (эта разница в процентном отношении ничего не говорит о точности, так как единицы измерения были разными). КТ-денситометрия способна улавливать достаточно небольшие (в пределах 50%) степени увеличения ВСВЛ у экспериментальных животных (17). К сожалению, это исследование невозможно выполнить в отделении интенсивной терапии и он сопровождается довольно большой лучевой нагрузкой.
Метод ядерно-магнитного резонанаса, или магнитно-резонансная томография (МРТ)
Другой метод оценки содержания воды в легких основан на способности ядер водорода (протонов) молекул менять свою ориентацию в пространстве под действием внешнего магнитного поля (18). Когда человек находится в камере магнитно-резонансного томографа, и подвергается воздействию переменного (электромагнитного) или постоянного магнитного поля, возникает феномен “ядерно-магнитного резонанса”, так как атомы водорода поглощают и испускают энергию в зависимости от магнитного поля. Эту энергию можно зарегистрировать с помощью усилителей, расположенных определенным образом, в результате чего возникает сигнал различной интенсивности в зависимости от напряжения магнитного поля и его частоты. Этот параметр может использоваться для оценки содержания воды в легких.
Т1 и Т2-взвешенные изображения отличаются по виду тканей, который исследуется, что теоретически увеличивает возможность применения МРТ для выявления составляющих отека легких, а именно дифференцировки отека, возникающего вследствие повышения давления в сосудах малого круга (в отечной жидкости мало белка) и отека, вызванного увеличением сосудистой проницаемости (в отечной жидкости много белка), то есть с помощью неинвазивного метода отличить кардиогенный отек легких от респираторного дистресс-синдрома взрослых (РДСВ). У крыс эти исследования проводились с помощью контрастного вещества с молекулярной массой 40 000 дальтон (30).
Позитронно-эмиссионная томография
Содержание воды в легких можно измерить либо напрямую, либо при оценке измерений тканевой плотности (32,33). С помощью этого метода определяется водная фракция легкого (0,82-0,84 мл/г). Иногда вводят небольшую поправку (-2%) на разницу плотности крови и воды (34).
Исследования показали, что измерение ВСВЛ с помощью ПЭТ коррелирует с результатами гравиметрического метода достаточно хорошо (r=0,86-0,93), даже при отсутствии коррекции на гематокрит венозной крови и плотность периферической крови (36,37). Возможно, вследствие отсутствия такой коррекции результаты измерения ВСВЛ с помощью ПЭТ всегда ниже, чем результаты гравиметрического метода на 10-15%. Однако результаты ПЭТ имеют очень высокую воспроизводимость (коэффициент вариации для повторных измерений менее 5%) и линейность (r=0,99 для изменения содержания воды в легких в пределах увеличения и уменьшения в 20 раз) (37). Метод также обладает исключительной чувствительностью: с помощью ПЭТ можно обнаружить даже 1 мл лишней внесосудистой воды.
Несмотря на эти впечатляющие результаты, ПЭТ является очень дорогим методом (как и МРТ) и выполнение этого исследование возможно далеко не в каждом лечебном учреждении (в отличие от МРТ, которая все-таки более доступна). При позитронно-эмиссионной томографии существует ионизирующее излучение, а соответственно, и лучевая нагрузка (хотя она и невелика). Как при компьютерной рентгеновской или магнитно-резонансной томографии, больного везут к томографу, что для отделения интенсивной терапии представляет сложную задачу.
Электрическая импедансная томография (ЭИТ)
Воздух и жидкость обладают разными сопротивлениями току электричества через организм. Измерение торакального биоэлектрического импеданса, возникающего в ответ на переменный ток низкой амплитуды дает значение сопротивления, которое может коррелировать с результатами измерения ВСВЛ гравиметрическим методом после коррекции на массу тела (38-40). Недавно было проведено исследование с применением динамической реконструкции поперечного среза в соответствии с сердечным циклом, что позволило сделать этот метод более чувствительным и специфичным (41), а соответственно, более привлекательным для клиники. Еще одним преимуществом этого метода является легкость перемещения аппаратуры, отсутствие лучевой нагрузки и возможность выполнения у постели больного, в том числе и в отделении интенсивной терапии.
МЕТОДЫ РАЗВЕДЕНИЯ ИНДИКАТОРА
Измерение ВСВЛ может быть также проведено с помощью методов измерения индикаторов, в которых используются так называемые подходы “среднего времени транзита” или “кривая-объем”, которые позволяют анализировать зависимости температуры или концентрации от времени (42-45).
При использовании метода разведения индикатора применяются свободно диффундирующие (тепло/холод) и недиффундирующие (например, индоциановый зеленый, который связывается с альбумином крови) индикаторы, которые имеют один и тот же поток при разных объемах распределения. Разница среднего времени транзита двух индикаторов и будет внесосудистым термальным объемом (ВТО). При использовании метода “кривая-объем” строится кривая термодилюции индикатора при прохождении его через наибольший объем (легкие). Когда это значение умножается на сердечный выброс, можно рассчитать термальный объем легких (ТВЛ). Дальнейшая коррекция на объем крови внутри грудной клетки и даст нам значение ВСВЛ. Этого можно достигнуть путем однократной инъекции термального индикатора, что позволяет уйти от применения индоцианового зеленого (46,47).
Так как содержание внесосудистой воды в миокарде и нелегочных кровеносных сосудах по отношению к количеству внесосудистой воды в легких относительно невелико, ВТО и ВСВЛ обычно рассматриваются, как эквивалентные показатели. Многочисленные исследования показали, что ВТО обычно (но не всегда) практически равен ВСВЛ (43,44). Effros (43) и Allison с соавт. (44) указали, что измерение ВТО дает эквивалентные ВСВЛ результаты только тогда, когда принимаются во внимание относительное время транзита термального индикатора через эритроциты по сравнению с плазмой, относительная специфическая теплота внесосудистой ткани по сравнению с плазмой, плотность крови и фракция воды во внесосудистой жидкости. Без таких поправок ВТО превосходит ВСВЛ (а соответственно, может быть переоценка) на 24% даже в здоровых легких. Интересно, что при нарастании отека большую часть внесосудистого пространства занимает вода, и ошибка метода (которая характерна для коммерческих устройств) уменьшается.
Преимущества измерения ВСВЛ методом разведения одного или двух индикаторов следующие: методы относительно просты для выполнения, безопасны, воспроизводимы и легко повторяются. С другой стороны, они в некоторой степени инвазивны (требуется катетеризация центральных вен и артерий). Вдобавок, накопление внесосудистой воды в любом отделе легких ниже места обструкции сосуда выявить невозможно (44). Аналогичная проблема существует и для отделов легких с плохой перфузией, например, в результате применения такого режима вентиляции, как положительное давление в конце выдоха (ПДКВ) (42,44,52).
ВЫВОДЫ
Жидкость в плевральной полости – диагностика и лечение
Галина Кучма, врач УЗИ. Редактор А. Герасимова
Скопление жидкости в плевральной полости ежедневно диагностируют в среднем у 1 млн человек в мире. Наиболее частые причины – сердечная недостаточность (СН), пневмония, онкологические процессы, тромбоэмболия легочной артерии, туберкулез.
Классификация и диагностика плевральной жидкости
Объем жидкости в плевральной полости регулируется балансом между гидростатическим и онкотическим давлением в кровеносных сосудах висцеральной и париетальной плевры и лимфатическим дренажом. Норма составляет около 1,0–15 мл. Когда этот баланс нарушается, объем жидкости в плевральной полости увеличивается. Когда объем жидкости достигает 100-300 мл, это можно увидеть на линейной рентгенограмме грудной клетки.
Пункция плевральной полости
После аспирационной пункции плевральной полости в первую очередь оценивают цвет, прозрачность и запах плевральной жидкости. Очень важен характер жидкости: кровотечение (геморрагический плеврит и гематоракс), гнойная или хилозирующая. Плохой запах характерен для эмпиемы плевры, вызванной анаэробными бактериями.
Традиционно жидкость в плевральной полости подразделяется на транссудат и экссудат, диагностические критерии для которых были опубликованы в 1972 году RW Laitas et al. Эти критерии до сих пор используются во многих клиниках по всему миру. Чувствительность критериев составляет 98%, а специфичность – 83%.
Экссудат и транссудат
Диагностика экссудата и транссудата
Было замечено, что экссудат может быть неправильно диагностирован у пациентов, получающих диуретики, из-за повышенного уровня белка в плевральной жидкости. В таких случаях рекомендуется дополнительно исследовать уровни альбумина в плевральной жидкости и крови.
Если обнаруживается, что жидкость является транссудатом, дальнейшее исследование нецелесообразно. В этом случае необходимо уточнить, какая из 4 наиболее частых причин – сердечная недостаточность, цирроз печени, нефротический синдром или тромбоэмболия легочной артерии – преобладает.
Если жидкость представляет собой экссудат, требуется дополнительное исследование – цитологическое, биохимическое, бактериологическое.
Как и в случае с другими заболеваниями, важно оценить вышеуказанные причины плеврального выпота, целенаправленно собрать анамнез:
Другие более редкие заболевания можно исключить, собрав анамнез и вернувшись к ним, если ни одно из основных заболеваний не подтверждено.
Также важно время появления клинических признаков плеврита (после рецидивирующей пневмонии, травмы, медицинского вмешательства или по другим причинам).
Пациент может жаловаться на кашель, одышку и боли в плевре. Эти симптомы могут быть изолированными или их комбинацией, но они не являются специфическими и редко помогают определить причину скопления жидкости в плевральной полости.
Назначаются следующие исследования
Передняя рентгенограмма грудной клетки
Лечение при скоплении плевральной жидкости
Жидкость в плевральной полости является следствием других заболеваний, поэтому лечение также зависит от первопричины.
Если имеется большое количество жидкости, вызывающей дискомфорт и нарушение дыхания, ее следует удалить проколом или дренировать.
Уровень жидкости, вызванный приемом лекарств, невысок. Если есть подозрение на фармакологическое происхождение жидкости, обычно эффективно прекращение приема препарата (прокаинамид гидралазин, хинидин, нитрофурантоин, кордарон, прокарбазин, метотрексат и т. д.). Такое состояние не требует дальнейшего вмешательства.
В случае гнойной жидкости с pH меньше 7,2, если она инкапсулирована или обнаружены бактерии, необходимо срочное удаление толстым дренажем. У дренированных пациентов при адекватном антибактериальном лечении состояние обычно улучшается в течение недели.
Если по прошествии недели большое количество жидкости остается или увеличивается, что показывает УЗИ или другие методы, следует рассмотреть возможность дренирования плевральной полости и оценить другие причины появления жидкости. Пневмония может быть связана с опухолевым процессом или туберкулезом. В этом случае рекомендуется компьютерная томография.
Жидкость, выделяемая у онкологических больных, обычно является признаком прогрессирования процесса. Средняя выживаемость таких пациентов составляет около 1 года.
Жидкость обычно диагностируется впервые при развитии медленно прогрессирующей одышки. Поскольку этот процесс протекает медленно, пациенты объясняют эти недомогания основным заболеванием и обращаются за помощью, когда уровень жидкости очень высок.
После удаления жидкости пациент чувствует себя намного лучше. Правда, улучшение временное. Жидкость рецидивирует в течение 2-3 недель. Для удаления жидкости производятся повторные проколы плевральной полости. Было замечено, что жидкость лучше удаляется, если применяется плевральный дренаж. Иногда длительное дренирование приводит к самопроизвольному разрастанию плевральной полости. Это альтернатива плевродетической хирургии.
Туберкулезная жидкость обычно проходит спонтанно при адекватной противотуберкулезной терапии.
Хирургическое лечение при наличии жидкости в плевральной полости
Хирургическое вмешательство применяется для выяснения причин образования жидкости при отсутствии других вариантов или в чисто терапевтических целях.
Визуальная контролируемая торакоскопия
Визуальная контролируемая торакоскопия
Подбор медикаментозной терапии
Для лечения серьезных заболеваний назначаются лекарства. Если жидкость поступает из сердца, наиболее эффективны диуретики, вазодилататоры и другие препараты, влияющие на сердечно-сосудистую систему. Диуретики не помогут, если жидкость вызвана пневмонией, опухолью или туберкулезом.
При эмпиеме плевры, помимо дренажа плевры, наиболее важны антибиотики. Могут применяться комбинации цефалоспоринов и антианаэробных препаратов. В случае неосложненных парапневмонических жидкостей достаточно одного антибактериального агента, направленного против предполагаемого или указанного возбудителя.