какая общая формула соответствует классу алкенов
Алкены
Номенклатура и изомерия алкенов
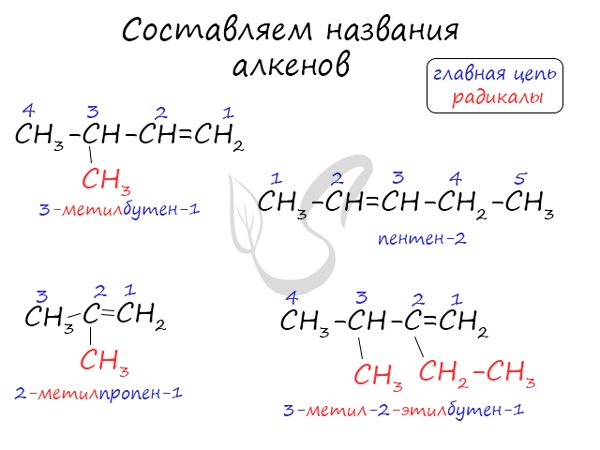
Названия алкенов формируются путем добавления суффикса “ен” к названию алкана с соответствующим числом: этен, пропен, бутен, пентен и т.д.
При составлении названия алкена важно учесть, что главная цепь атомов углерода должна обязательно содержать двойную связь. Принято начинать нумерацию атомов углерода с того края, к которому ближе двойная связь. В конце названия указывают атом углерода, у которого начинается двойная связь.
Атомы углерода, прилежащие к двойной связи находятся в sp 2 гибридизации.
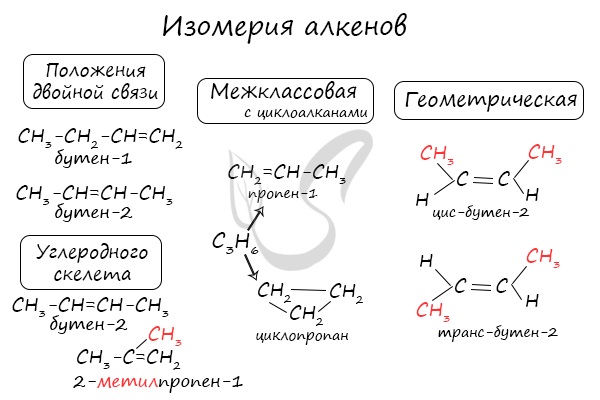
Для алкенов характерна изомерия углеродного скелета, положения двойной связи, межклассовая изомерия с циклоалканами и пространственная геометрическая изомерия в виде существования цис- и транс-изомеров.
Получение алкенов
В результате крекинга нефти образуется один алкан и один алкен.
В реакции галогеналкана со спиртовым(!) раствором щелочи образуется алкен. По правилу Зайцева, водород отщепляется от соседнего наименее гидрированного атома углерода.
Внутримолекулярная дегидратация спиртов происходит при t > 140 °C.
Химические свойства алкенов
Водород присоединяется к атомам углерода, образующим двойную связь. Пи-связь (π-связь) рвется, остается единичная сигма-связь (σ-связь).
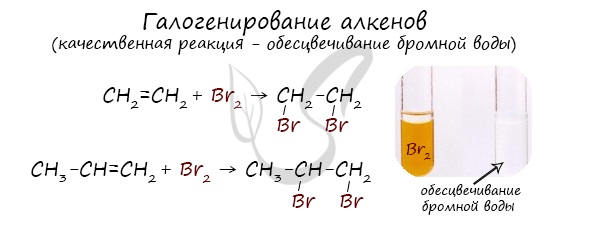
Реакция с бромной водой является качественной для непредельных соединений, содержащих двойные (и тройные) связи. В ходе такой реакции бромная вода обесцвечивается, что указывает на присоединение его по кратным связям к органическому веществу.
Реакция с хлором на свету протекает по свободнорадикальному механизму, так как на свету молекулы хлора расщепляются, образуя свободные радикалы.
Алкены вступают в реакции гидрогалогенирования, протекающие по типу присоединения.
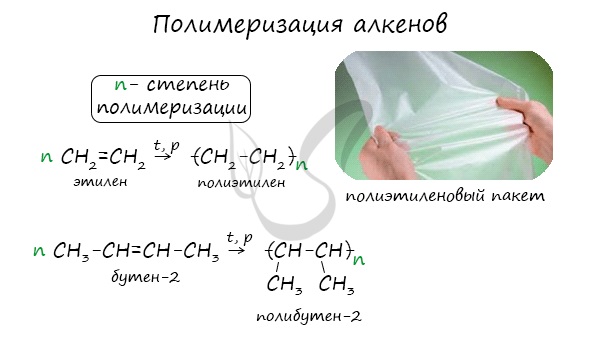
Индекс “n”, степень полимеризации, обозначает число мономерных звеньев, которые входят в состав полимера.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Алкены
Одновалентный радикал этилена СН2=СН – называется винилом.
Изомерия и номенклатура
Для алкенов возможны 3 типа изомерии: изомерия углеродной цепи, изомерия положения двойной связи, цис-транс-изомерия.
Первые 2 члена гомологического ряда – этен и пропен – изомеров, относящихся к классу алкенов, не имеют.
Алкены изомерны другому классу соединений – циклоалканам. Они имеют одинаковую общую формулу CnH2n.
Физические свойства
Плохо растворимы в воде.
Химические свойства
Алкены обладают большей реакционной способностью, чем алканы. Это обусловлено наличием в их молекулах двойной связи. π-связь менее прочная, чем σ-связь. Она легко разрушается под воздействием различных реагентов. Освободившиеся в результате разрыва π-связи валентности углеродных атомов используются для присоединения атомов или групп атомов молекулы реагента. Для алкенов характерны реакции присоединения.
I. Реакции присоединения
1. Присоединение водорода (+Н2) – гидрирование, образуются алканы:
2. Присоединение галогенов (+F2, Cl2, Br2, I2) – галогенирование, образуются дигалогеналканы:
Бромная вода (раствор Br2 в воде) имеет желтый цвет. При взаимодействии с алкенами бромная вода обесцвечивается, поэтому реакция с бромной водой используется для идентификации алкенов.
Как уже указывалось при изучении неорганической химии, реакции, которые используются для идентификации различных веществ, называются качественными реакциями.
Реакция с бромной водой является качественной реакцией на все непредельные углеводороды, в том числе на алкены.
3. Присоединение галогеноводородов (+HHal) — гидрогалогенирование, образуются моногалогеналканы:
Присоединение галогеноводородов к несимметричным алкенам происходит по правилу В. В. Марковникова.
Правило Марковникова. При присоединении веществ типа НХ (Х = Hal, ОН и т. д.) к несимметричным алкенам атом водорода присоединяется к атому углерода у кратной связи, связанному с большим числом атомов водорода. Например:
Механизм присоединения по правилу Марковникова
Ориентация присоединения объясняется поляризацией молекулы несимметричного алкена в результате действия индуктивного эффекта.
Алкильные группы как электронодонорные заместители определяют место присоединения протона.
При наличии в молекулах непредельных углеводородов заместителей, проявляющих значительный электроноакцепторный эффект, реакция идет против правила Марковникова:
4. Присоединение воды (+Н2О) — гидратация, образуются предельные одноатомные спирты (алканолы CnH2n+lOH). Присоединение воды происходит по правилу Марковникова:
II. Реакции окисления
б) неполное (недостаток О2)
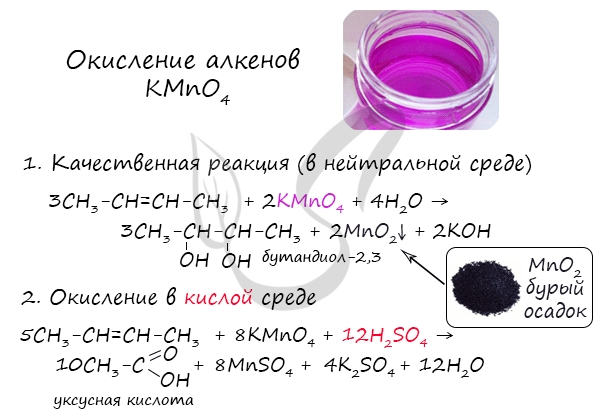
При действии разбавленного водного раствора KMnO4 в щелочной среде происходит гидроксилирование алкенов (введение гидроксогруппы) с образованием диолов (реакция Е.Е. Вагнера). Раствор KMnO4 при этом обесцвечивается:
Аналогично происходит реакция алкена с разбавленным раствором KMnO4 в кислой среде. Реакция с KMnO4 является качественной реакцией на непредельные УВ, в том числе на алкены.
III. Реакции полимеризации
Процесс полимеризации алкенов открыт А.М.Бутлеровым.
Полимеризацией называется процесс соединения одинаковых молекул (мономеров), протекающий за счет разрыва кратных связей, с образованием высокомолекулярного соединения (полимера).
Получение
В промышленности:
2) дегидрирование алканов
3) гидрирование алкинов
В лаборатории:
При дегидратации спиртов атом водорода отщепляется от атома углерода, связанного с наименьшим числом атомов водорода (правило А.М. Зайцева):
2) Дегидрогалогенирование моногалогеналканов (- HHal) действием твердой щелочи или ее спиртового раствора.
Происходит по правилу А.М. Зайцева:
3) Дегалогенирование (- 2Hal) дигалогеналканов с атомами галогена у соседних атомов «С» действием Zn или Mg:
Применение этилена
Скачать:
Скачать бесплатно реферат на тему: «Этилен и его производные в промышленном органическом синтезе» Этилен-и-его-производные-в-промышленном-органическом-синтезе.doc (192 Загрузки)
Скачать рефераты по другим темам можно здесь
Похожее
Добавить комментарий Отменить ответ
Репетитор по химии. Занятия проходят онлайн по Скайпу. По всем вопросам пишите в Ватсапп: +7 928 285 70 42
Алкины
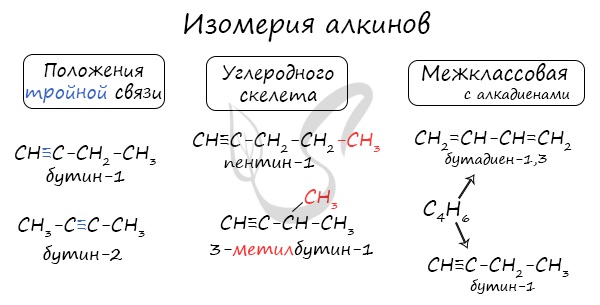
Номенклатура и изомерия алкинов
Названия алкинов формируются путем добавления суффикса “ин” к названию алкана с соответствующим числом: этин, пропин, бутин и т.д.
При составлении названия алкина важно учесть, что главная цепь атомов углерода должна обязательно содержать тройную связь. Нумерация атомов углерода в ней начинается с того края, к которому ближе тройная связь. В конце названия указывают атом углерода у которых начинается тройная связь.
Для алкинов характерна изомерия углеродного скелета, положения тройной связи, межклассовая изомерия с алкадиенами.
Пространственная геометрическая изомерия для них невозможна, ввиду того, что каждый атом углерода, прилежащий к тройной связи, соединен только с одним единственным заместителем.
Получение алкинов
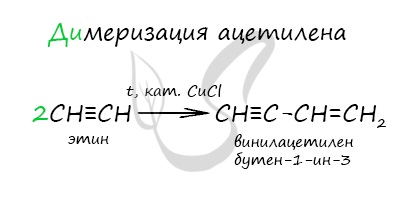
При нагревании метана до 1200-1500 °C происходит димеризация молекул метана, в ходе чего отщепляется водород.
Осуществляется напрямую, из простых веществ. Протекает на вольтовой (электрической) дуге, в атмосфере водорода.
2C + H2 → (t, вольтова дуга) CH≡CH
В результате разложения карбида кальция образуется ацетилен и гидроксид кальция II.
Получение гомологов ацетилена возможно в реакциях дегидрогалогенирования дигалогеналканов, в которых атомы галогена расположены у одного атома углерода или у двух соседних атомов.
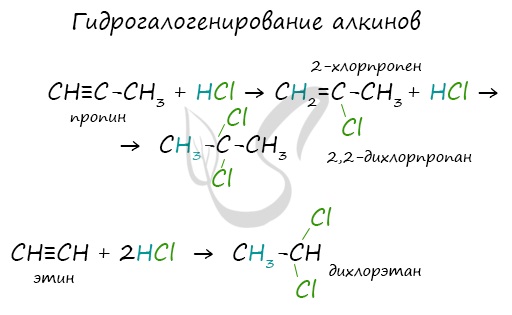
Химические свойства алкинов
Водород присоединяется к атомам углерода, образующим тройную связь. Пи-связи (π-связи) рвутся, остается единичная сигма-связь (σ-связь).
CH≡C-CH3 + H2 → (t, Ni) CH2=CH-CH3 (в реакции участвует 1 моль водорода)
CH≡CH + 2H2 → (t, Ni) CH3-CH3 (в реакции участвует 2 моль водорода)
Реакция с бромной водой является качественной для непредельных соединений, содержащих двойные (и тройные) связи. В ходе такой реакции бромная вода обесцвечивается, что указывает на присоединение его по кратным связям к органическому веществу.
Алкины вступают в реакции гидрогалогенирования, протекающие по типу присоединения.
Только в реакции с ацетиленом образуется уксусный альдегид. Во всех остальных реакциях (с гомологами ацетилена) образуются кетоны.
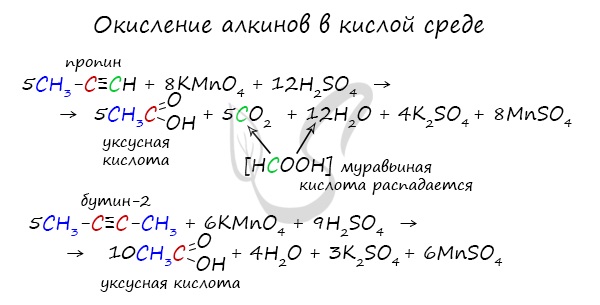
Так, при окислении пропина, образуется уксусная кислота и муравьиная кислота, окисляющаяся до угольной кислоты, которая распадается на углекислый газ и воду.
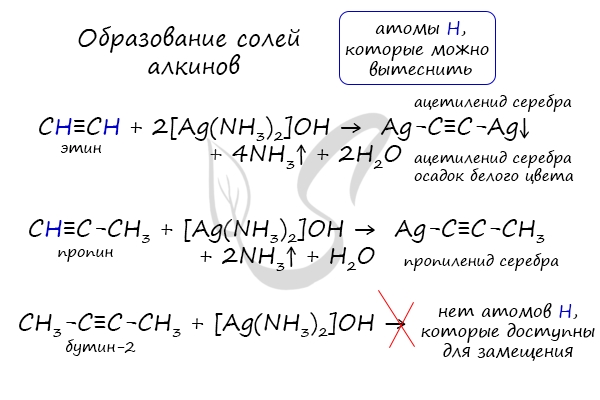
В случае если тройная связь прилежит к краевому атому углерода, то имеющийся у данного атома водород может быть замещен атомом металла. Если тройная связь спрятана внутри молекулы, то образование солей невозможно.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Тестирование по органической химии за курс 10класса
Ищем педагогов в команду «Инфоурок»


а) алканы б) алкены в) алкины г) арены
2. Какая общая формула соответствует классу алканов?
3. Реакции какого типа характерны для алканов?
а) присоединения б) замещения в) полимеризации г) гидратации
4. Какое название соответствует веществу СН 3 – СН – СН 2 – СН 3
а) бутан б) 2-метилбутан в) 2-метилпропан г) 3-метилбутан
5. Какой газ составляет основу природного газа?
7. Сколько π-связей в молекуле бутадиена-1,3
8. Гомологами являются
а) пентен и 2-метилбутан б) хлорэтен и дихлорэтан
в) пропанол и пропаналь г) 2,2-диметилпропан и 2,2-диметилбутан
9. Тип реакции взаимодействия этена с бромом
а) присоединения б) замещения в) гидрирования г) гидратации
10. Только σ – связи имеются в молекуле
а) этанола б) этаналя в) этена г) этина
11. Вещество СН 3 – СН – СН = СН 2 называется
а)2-метилбутан б) 3-метилбутен-2
в) 3-метилбутин-1 г) 3-метилбутен-1
а) глицерина и глюкозы б) фенола и пропанола
в) сахарозы и формальдегида г) фенола и формальдегида
угол 180 0 характерны для молекулы
а) бензола б) этана в) этина г) этена
а) альдегидов б) аминов в) карбоновых кислот г) спиртов
15. Карбоксильная группа содержится в молекуле
а) метанола б) ацетальдегида в) уксусной кислоты г) глицерина
16. Реактивом для распознавания многоатомных спиртов является
а) бромная вода б) оксид меди (+2)
в) гидроксид меди (+2) г) хлорид железа (+3)
17. Продуктами окисления предельных одноатомных спиртов являются
а) альдегиды б) кетоны в) простые эфиры г) сложные эфиры
18. Сложный эфир можно получить реакцией
а) гидрирования б) гидратации в) этерификации г) дегидратации
19. В реакцию «серебряного зеркала» вступают
а) альдегиды б) фенолы в) спирты г) одноатомные спирты
20. Из остатков молекул α – глюкозы состоят молекулы
а) фруктозы б) крахмала в) сахарозы г) целлюлозы
а) полимеризация б) присоединения
в) поликонденсации г) изомеризации
22. Для аминов характерны свойства
а) кислот б) оснований в) амфотерных соединений
23. Какое название у вещества СН 3 – СН – СН 2 – СООН
а) 3-аминобутановая кислота б) 2-аминобутановая кислота
в) α-аминомасляная кислота в) 4- аминомасляная кислота
24. В состав белков входят остатки
а) α-аминокислот б) β-аминокислот
в) γ-аминокислот г) δ-аминокислот
25. Химическая связь, образующая первичную структуру белков:
а) водородная б) ионная в) пептидная г) ковалентная неполярная
Н – 15,6%, N – 31,1% и относительная плотность по водороду 22,5
Для вещества СН 2 = СН-СН=СН 2 составьте структурные формулы одного изомера и одного ближайшего гомолога, назовите все вещества.
Напишите уравнения для осуществления превращений:
СаС 2 → С 2 Н 2 → С 6 Н 6 → С 6 Н 5 NO 2 Укажите условия реакций, назовите продукты.
Выберите, с какими из перечисленных веществ может взаимодействовать этанол, и напишите соответствующие уравнения реакций:
натрий, гидроксид натрия, хлорид натрия, хлороводород, уксусная кислота
При полном сгорании 3 г. углеводорода получилось 4,48 л. (н.у.) углекислого газа и 5,4 г. воды. Относительная плотность по воздуху равна 1,03. Выведите формулу углеводорода.
Алкены

Всего получено оценок: 1162.
Всего получено оценок: 1162.
Ациклические непредельные углеводороды с одной двойной связью между атомами углерода называются алкенами. Простейший алкен – этилен (C2H4), образующий гомологический ряд.
Описание
Алкены – класс веществ органической химии. Второе название класса – олефины. Общая формула алкенов – CnH2n.
Алкены, в зависимости от нахождения в гомологическом ряду, отличаются физическими свойствами. Первые три алкена в гомологическом ряду – газы. Вещества, содержащие от пяти до 17 атомов углерода, относятся к жидкостям. Высшие алкены, содержащие более 17 атомов углерода, являются твёрдыми веществами.
Номенклатура
Названия алкенов в гомологическом ряду соответствуют названиям алканов, но суффикс «-ан» заменён на «-ен». Названия и формулы веществ приведены в таблице алкенов.
Название
Формула
Название может содержать две цифры. В начале названия цифра указывает на расположение заместителей (в формуле записывается в скобках). Вторая цифра, стоящая в конце названия, указывает положение двойной связи. Нумерация атомов начинается с конца, к которому ближе расположена двойная связь. Например, название «5-метилгексен-2» указывает, что к пятому атому гексена присоединён метил, а двойная связь находится между вторым и третьим атомом.
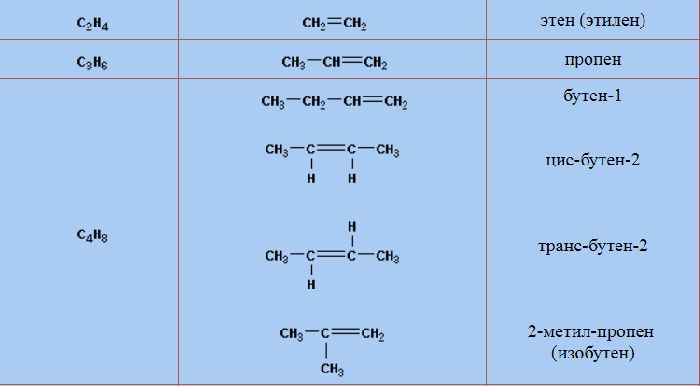
Алкены, кроме этилена, имеют изомеры. Пропилену свойственна межклассовая изомерия. Его единственным изомером является циклопропан (C3H6). Изменения углеродного скелета и положения двойной связи, а также структурная изомерия характерны веществам, начиная с бутилена (бутен-1, бутен-2, изобутилен, цис-бутен-2, транс-бутен-2).
Получение
Алкены в отличие от алканов практически не встречаются в природе. Небольшое количество этилена содержат растения. Некоторые феромоны насекомых относятся к классу алкенов.
Олефины синтезируют промышленным и лабораторным путём. В промышленности применяется крекинг – высокотемпературная переработка нефти, а также дегидратация (обезвоживание) спиртов.
В лабораториях используются:
Используются и другие методы. Например, реакция Бурда, Кнёвенагеля, Перкина, Кори-Винтера.
Химические свойства
Алкены – активные вещества. Они реагируют:
Алкены способны образовывать полимеры. Реакция полимеризации протекает в присутствии катализатора под действием давления и высокой температуры. Полимеризация помогает получить прочные материалы: полиэтилен, полипропилен, поливинилхлорид.
Что мы узнали?
Из темы урока узнали, что такое алкены. Это класс органических веществ, содержащий одну двойную связь между атомами углерода. Названия алкенов образуются путём присоединения суффикса «-ен». В зависимости от количества атомов углерода алкены могут находиться в газообразном, жидком или твёрдом состоянии. Алкены получают искусственными путями, т.к. в природе вещества практически не встречаются. Это активные соединения, вступающие в реакции с неорганическими веществами.