какая пробирка для гормонов
Правила забора биологического материала для иммунологических исследований
ГУЗ «Кемеровская областная клиническая больница»
Правила забора биологического материала
для иммунологических исследований
Н.Б. Миловидова – к.м.н. заведующая эпидемиологическим отделом ГУЗ КОКБ;
Е.Б. Лукоянычева–заведующая иммунологической лабораторией ГУЗ КОКБ.
© ГУЗ «Кемеровская областная клиническая больница», 2008г
Данное методическое пособие предназначено для медицинских сестер Кемеровской областной клинической больницы.
Методическое пособие поможет правильно произвести забор биологического материала и оформить сопроводительные документы.
Правильно произведенный забор биологического материала и правильно оформленные направления исключат ошибку на преаналитическом этапе исследования.
Формы сопроводительных документов составлены так, чтобы сократить время медицинской сестры, затрачиваемое на оформление направлений.
Необходимо, чтобы образцы крови были правильно взяты и вовремя доставлены в лабораторию. Нарушения, допущенные на преаналитическом этапе, могут повлиять на результат исследования и его дальнейшую интерпретацию.
Раздел 1.
Общие правила забора биологического материала и оформления сопроводительных документов
Перед забором крови пациенту следует сообщить:
1. На какой вид исследования будет проводиться забор крови.
2. Требования необходимые для данного исследования.
Порядок забора венозной крови
1. Исследование проводится утром натощак, последний прием пищи за 12 часов до взятия крови.
2. Исключение приема алкоголя не менее чем за 24 часа до взятия крови.
3. Утренний прием лекарственных препаратов, лечебно-диагностических процедур (массаж, ЭКГ, физиотерапевческое лечение и др.) проводится после взятия крови.
5. Пациент перед процедурой должен находиться в покое, сидеть или лежать не менее 5 минут.
6. Продолжительность пережатия сосудов жгутом должна составлять не более 1 минуты.
7. Нельзя просить работать пациента кулаком и массировать предплечье по ходу вен.
Раздел 2
Технология забора крови из периферической вены для лабораторного исследования
подготовить на манипуляционном столе стандартный набор для забора крови из периферической вены, проверив целостность упаковок и сроки годности:
1. лоток для использованных материалов;
2. пробирки для крови;
3. упаковка с 2-мя стерильными салфетками (5х5см) или 4-5 шариками;
5. кожный спиртовой антисептик во флаконе с дозатором;
сделать необходимые надписи на пробирках;
оформить сопроводительные документы в лабораторию;
обеспечить удобное освещение;
помочь пациенту найти удобное положение;
разъяснить пациенту суть предстоящей процедуры, создавая атмосферу доверия, предоставляя возможность задать вопросы;
обработать руки спиртовым антисептиком;
вскрыть упаковки со стерильными материалами;
руку больного уложить в положении максимального разгибания, для чего под руку следует положить валик, имеющий влагостойкое покрытие.
выбрать вену для венепункции;
обработать место венепункции кожным антисептиком и дать высохнуть самостоятельно;
Не пальпируйте вену повторно!
надеть на стерильный шприц иглу;
снять с иглы защитный колпачок;
пальцами левой руки фиксировать кожу над веной;
ввести под кожу иглу срезом вверх под углом 30-40 0 ;
установить иглу параллельно вене и быстрым движением проколоть ее стенку;
иглу продвинуть немного вверх по длине вены;
набрать необходимое количество крови в шприц
– запрещается забор крови свободным кровотоком из иглы в пробирку, а также присоединение к игле нового шприца;
– для безопасного забора крови предпочтительно использовать вакуумный шприц-контейнер.
иглу извлечь из вены;
прижать место венепункции стерильной салфеткой на 2-3 минуты;
осторожно, предупреждая разбрызгивание крови, вылить содержимое шприца через иглу в одну или несколько пробирок.
набрать из емкости «Для дезинфекции инструментов» дезинфицирующий раствор через иглу в шприц;
вставить иглу в специальное отверстие контейнера «Для дезинфекции режущего и колющего инструментария» и, повернув ее, отделить от шприца и оставить в нем в растворе дезинфектанта;
Раздел 3
Правила взятия венозной крови с помощью закрытой системы (вакуумного шприца-контейнера)
полностью исключается контакт медперсонала с кровью на всех этапах взятия крови и ее транспортировки;
особо прочный пластик закрытых систем позволяет осуществить безопасную доставку крови на любые расстояния;
благодаря наличию широкого спектра пробирок с заранее добавленными реагентами для различных видов анализов (ЭДТА для гематологии, цитрат натрия для коагулогии, активатор свертывания для получения сыворотки), значительно облегчается работа медсестер и лаборатории. Международная цветовая маркировка предотвращает их не правильное применение;
уменьшается количество ошибочных анализов, связанных с неправильным взятием проб крови и неверным соотношением реагентов.
закручивающаяся крышка предотвращает “аэрозольный эффект” при открывании;
1. Надеть иглу на контейнер и закрепить легким поворотом по часовой стрелке. Провести пункцию вены.
1. Провести пункцию вены иглой. Благодаря защитной мембране кровь из иглы не вытекает.
2. Медленно оттягивая поршень, наполнить контейнер кровью. После заполнения кровью контейнер вместе с иглой вынуть из вены. Поршень зафиксировать в конечном положении до характерного щелчка. В случае взятия нескольких образцов крови, контейнер отсоединить. Иглу оставить в вене и на нее надеть следующий контейнер.
2. Создать вакуум в контейнере.
Для этого отвести поршень в конечное положение (до характерного щелчка) и отломить его
3. По окончании взятия крови, шток поршня обломить. Вы получаете транспортный контейнер с кровью и антикоагулянтом или готовую пробирку для сепарации сыворотки.
3. Насадить контейнер на иглу. Взятие крови осуществляется под действием вакуума. В этом случае вы также получаете транспортный контейнер с кровью и антикоагулянтом или готовую пробирку для сепарации сыворотки.
Транспортировка образцов крови
Транспортировка образцов крови должна осуществляться при комнатной температуре (18-25 град. C). Избегайте замораживания или перегревания образцов, так как нарушение температурного режима может повлиять на результаты. После забора крови образцы должны быть доставлены в лабораторию как можно скорее. При транспортировке образцы должны находиться в вертикальном положении.
При транспортировке образца внутри лечебно-диагностического учреждения, пробирки с кровью должны находиться в контейнере, который в случае повреждения пробирки будет предотвращать разлитие крови.
Порядок доставки крови в лаборатории
наружные части контейнера двукратно с интервалом в 15 минут протереть дезинфицирующим средством (концентрация по режиму для вирусных гепатитов);
доставить контейнер в лабораторию;
вынимать образцы крови из контейнера только в перчатках!
после возвращения из лаборатории контейнер вновь двукратно с интервалом в 15 минут протереть дезинфицирующим средством (концентрация по режиму, предусмотренному для гемоконтактных вирусных гепатитов).
Требование к маркировке пробирок.
Маркировку пробирок и заполнение сопроводительных документов следует проводить аккуратно и четко.
Фамилию, имя, отчество пациента писать четко и разборчиво.
В направлении заполнять все графы.
Не допускается, чтобы этикетка на пробирке была размыта, порвана или плохо приклеена.
Направления заполнять в соответствии с приложениями № 1-12
Какая пробирка для гормонов
Данный материал взят из книги “Диагностические тест-системы: Радиоиммунный и иммуноферментный методы диагностики” Таранова Анатолия Григорьевича и размещен на сайте с любезного разрешения автора.
ТЕХНИКА ЛАБОРАТОРНЫХ РАБОТ
2.1. Условия взятия и хранения биологического материала
Подготовка к проведению лабораторных исследований содержит два основных момента: необходимость соблюдения стандартных условий взятия биологического материала и предотвращение деградации биологически активного вещества в образцах.
3) множество лекарственных веществ способны влиять на определяемые вещества, повышая или понижая их уровень в крови;
4) взятие исследуемого образца у пациентов в горизонтальном, в вертикальном положении или после физической нагрузки изменяет уровень биологически активных веществ иногда более чем на 10 %.
Желательно, чтобы кровь, предназначенная для исследования, забиралась в однотипные центрифужные пробирки. Такие пробирки должен готовить (мыть, высушивать, добавлять коагулянт или ингибитор ферментов) один сотрудник. Кровь без добавок отстаивают, а с добавками центрифугируют, полученную сыворотку или плазму разливают в такое количество мелких пластмассовых или стеклянных пробирок (стекло не всегда выдерживает низкую температуру), которое равно или превышает число разных типов тестирования.
Во время процедуры взятия крови следует избегать гемолиза, который некоторым возможен при длительном венозном застое, энергичной аспирации крови шприцем, попадании в просвет иглы воды и детергентов, действии на кровь высокой и низкой температур.
2.1.1. Получение сыворотки или плазмы крови
Цельная кровь (капиллярная и венозная) используется в основном в биохимических исследованиях (определение глюкозы, показателей КЩР, определение концентрации электролитов в эритроцитах) и гематологии (исследование LE-клеток, гематокрита, на малярию, проведение стандартного клинического анализа крови). Для радиоиммуиных и иммуноферментных методов получают сыворотку или плазму.
При выборе вида материала следует учитывать следующее:
1) При получении сыворотки крови возникает опасность того, что при отстаивании крови из эритроцитов интенсивно освобождаются протеолитические ферменты, которые могут разрушить определяемое вещество и повредить его меченый аналог во время инкубирования. Поэтому для определения содержания белковых соединений предпочтительно готовить плазму крови.
2) При получении плазмы часто используют гепарин или цитрат. Первый блокирует связывание антитела с антигеном, второй существенно изменяет кислотность среды, к которой чрезвычайно чувствительны некоторые вещества. Поэтому в сухую центрифужную пробирку желательно насыпать 50 мг ЭДТА на 5 мл крови (1:100). Сразу же после забора кровь перемешать с ЭДТА и отцентрифугировать. ЭДТА является слабым антикоагулянтом, блокатором протеолитических ферментов и составной частью многих буферных смесей.
2.1.2. Обработка крови для лабораторных исследований
Полученная и доставленная в лабораторию кровь должна быть быстро обработана, или подвергнута исследованию. Длительное стояние сыворотки над эритроцитами может привести к сдвигам концентраций составляющих, поэтому время стояния сыворотки над сгустком должно быть ограничено. Кроме того, биологический полураспад некоторых исследуемых веществ настолько мал, что стояние сыворотки при высокой комнатной температуре может полностью исказить полученные результаты исследования.
Полученную сыворотку (плазму) необходимо быстро отделить от форменных элементов крови и плотно закрыть пробирки крышкой. Если получена липемическая или гемолизированная сыворотка, образец, как правило, выбрасывается.
2.1.3. Хранение крови (плазмы, сыворотки)
Для определения большинства биологического материала считается возможным хранение его при комнатной температуре не более 6-8 часов.
При работе с кровью общим правилом должно являться немедленное отделение плазмы или сыворотки от форменных элементов, так как некоторые вещества могут поглощаться и инактивироваться эритроцитами и лейкоцитами. Но даже в простых водных растворах они спонтанно окисляются (например, кортизол превращается в 21-дезоксикортизол).
Образцы крови необходимо хранить в хорошо закрытых пробирках, так как потеря в образце влаги в замороженном состоянии может привести к концентрированию исследуемого вещества и получению в итоге ошибочного результата.
По экономическим соображениям важно до госпитализации и до любых терапевтических вмешательств взять образцы плазмы или сыворотки и поместить их в банк сывороток. После установления диагноза, если нет нужды в исследовании биологического материала, и образец не нужен для исследований, он может быть изъят из банка сывороток или плазм, однако, в наличия патологического процесса (особенно опухоли) возможно повторное определение уровня исследуемых веществ или их комбинаций. Кроме того, исследуемый образец рекомендуется оставлять в банке сывороток с тем, чтобы при модификации наборов фирмой-поставщиком, можно было корректно продолжить мониторинг больного. Этот подход также может оказаться полезным, если появится новый маркер, отличающийся более высокой чувствительностью и специфичностью.
Размораживание и повторное замораживание повреждает практически все биологические пробы. Существует ошибочное мнение о том, что такое воздействие не влияет на тиреоидные и стероидные гормоны. Действительно, структура молекул этих гормонов лучше сохраняется в таких ситуациях. Однако следует помнить, что основной пул стероидных и тиреоидных гормонов циркулирует под “защитой” транспортных белков, которые, как и все другие белки, не выдерживают температурных перепадов и, разрушаясь, перестают “защищать” гормоны. Последние, освобождаясь, немедленно включаются в метаболическую цепь, что, в конечном итоге, ведет к искажению истинной картины.
Химическое окружение, в котором находится препарат, также является важным фактором. При хранении белков в растворах концентрация этих белков всегда должна быть больше 1 мг/мл. Известно, например, что разбавленная антисыворотка теряет активность намного быстрее, чем неразбавленная. Молекулы некоторых веществ биологического происхождения особенно легко разрушаются при окислении, поэтому их надо хранить в присутствии какого-нибудь восстановителя или в атмосфере, не содержащей кислорода.
Учитывая высокую скорость разрушения биологически активных веществ в органах и тканях, извлечение их и приготовление навесок анализа необходимо проводить в условиях постоянного охлаждения, хранить образцы только в замороженном состоянии. Предварительная обработка материала позволяет значительно увеличить его срок хранения. Например, после обработки гипофиза ацетоном первоначальный уровень гонадотропной активности сохраняется в нем при хранении в холодильнике без замораживания не менее года. Экстракты гормонов и чистые препараты сохраняются гораздо дольше, чем нативные образцы.
Известно, например, что в тканях гипоталамуса рилизинг-фактор к лютеинизирующему гормону подвергается сравнительно быстрому метаболическому разрушению. В то же время при хранении в стерильных условиях растворов синтетического ЛГ-рилизинг-гормонов в течение 18 месяцев при 40 °С он полностью сохранял свою биологическую активность и иммунореактивные свойства.
2.1.4. Получение, обработка и хранение мочи
Сбор мочи для определения биологически активных веществ проводят в течении заданных интервалов времени, чаще всего за сутки. На протяжении суток скорость образования и экскреции вещества с мочой колеблется весьма значительно, но эти колебания нивелируются при исследовании суточной порции мочи. В последнее время появляется возможность определять не в суммарной суточной моче и не суммарные вещества, а конкретные вещества и в любое время суток. Например, определение андрогена надпочечникового происхождения дегидроэпиандростерона-сульфата, или 17-окси-прегненолона, предназначенного для выявления адреногенитального синдрома.
Из рациона человека, по меньшей мере, за трое суток до сбора мочи
необходимо исключить продукты и лекарственные препараты, влияющие на
секрецию и метаболизм ряда веществ. Присутствие в моче некоторых
веществ эндогенного и экзогенного происхождения может искажать
результаты определения веществ. Сбор мочи производят в сосуды из дифферентного материала (стекла, пластмассы) во избежание разрушения вещества.
При сборе мочи также соблюдают определенные предосторожности, ли моча не содержит стабилизаторов, как, например, при определении стероидов и их метаболитов, она должна храниться до анализа в замороженном виде (как правило, не более 10 дней). Замороженную мочу со стабилизатором, предназначенную для определения катехоламинов, допускается хранить не более трех дней.
2.1.5. Получение экссудатов и транссудатов
Перед сбором экссудатов и транссудатов в посуду для сбора рекомендуется добавить 2 капли гепарина или на кончике ножа сухого цитрата натрия для предотвращения свертывания. Жидкость собирается в чистую сухую посуду и немедленно доставляется в лабораторию.
2.1.6. Сбор и хранение кала
Для исключения возможных погрешностей в диагностике запрещено доставлять кал после использования клизм, введения свечей, приема внутрь касторового и вазелинового масел и красящих веществ. Кал, взятый для исследования на дисбактериоз, должен быть срочно доставлен в лабораторию, или поставлен в холодильник при 4°С. При исследовании на простейшие запрещено сохранять кал в термостате или теплой воде, поскольку при этом происходит гибель и регенеративные изменения простейших.
2.1.7. Сбор и хранение мокроты
Мокроту рекомендуется собирать при кашле в сухую чистую посуду не более суток, так как при длительном хранении происходит разложение флоры и аутолиз элементов мокроты. Кратковременное хранение ее рекомендуется проводить в холодильнике при 4°С. Для бактериологических исследований мокрота не должна стоять более 4 часов с момента получения.
2.1.8. Сбор и хранение ликвора
Спинномозговая жидкость (ликвор), полученная при люмбальной пункции или пункции желудочков мозга, собирается в сухую чистую посуду и доставляется в лабораторию немедленно, так как при хранении в связи с разрушением клеточных элементов результат исследования может быть недостоверным.
2.2. Обработка лабораторной посуды
В специальных пособиях приводится много советов по тех лабораторных работ, поэтому мы ограничимся лишь некоторыми рекомендациями, имеющими существенное значение для постановки реакции и получения высококачественного результата в радиоиммунных и иммуноферментных методах диагностики. При работе с буферными системами, органическими растворителями и другими веществами, применяемыми для постановки реакции, особое внимание нужно обращать на чистоту реактивов. Вода для буферного раствора должна быть бидистиллированной и деионизированной. Органические растворители, как правило, подлежат очистке (например, эфир пропускается через колонку с оксидом алюминия) и двойной перегонке с дефлегматором (напр., при получении абсолютного этанола).
Лабораторная посуда должна быть тщательно обрабатывается механическими и химическими способами.
Приготовление моющего раствора:
на 1 л дистиллированной воды 20 г порошка типа “Лотос”.
Приготовление хромовой смеси:
в фарфоровом стакане растворяют 50 г бихромата калия (K 2 Cr 2 O 7 ) в 100 мл воды. Раствор сливают в сосуд большего размера и добавляют (очень осторожно) 1 л серной кислоты (концентрированной).
Внимание! Добавлять серную кислоту в раствор, но не наоборот!
2.2.1. Обработка посуды с низкой радиоактивностью
2.2.2. Обработка посуды с высокой радиоактивностью
Все вышеописанные работы проводить только в вытяжном шкафу при полном отсутствии открытого огня.
Для выполнения биохимических исследований в лаборатории посуда проходит определенный цикл обработки в соответствии с требованиями санитарно-гигиенических и противоэпидемических служб. При выполнении в лабораториях коагулологических исследований или проведения исследований определения ряда пептидных гормонов биологическими методами помимо обычной чистой стеклянной посуды используют силиконированную посуду для взятия и хранения крови и плазмы.
2.2.3. Силиконирование посуды
Силиконирование посуды осуществляют для предотвращения контаминации исследуемого образца со стеклом, в котором проводят химическую реакцию. Силиконирование тормозит активацию свертывания крови, предохраняя распад некоторых веществ (например, пептидных гормонов) при инкубации их со встряхиванием.
Стекло покрывается мономолекулярной пленкой силикона:
5% раствор дихлордиметилсилана в толуоле. Чистая сухая посуда заполняется раствором и сразу же выливается. Силиконирование проводят в вытяжном шкафу, затем проводят сушку посуды в сушильном шкафу 180°С в течение часа.
Раствор для силиконирования хранят в посуде с притертой пробкой
в вытяжном шкафу.
Использовать силиконированную посуду не более 5 раз, затем силиконирование необходимо повторить.
Цветовая кодировка вакуумных пробирок VACUETTE
Цветовая кодировка вакуумных пробирок VACUETTE
В современном мире все больше внимания уделяется лабораторным исследованиям и качеству их проведения.
На что больше всего обращает внимания любой человек, увидевший пробирку? Яркий цвет колпачка! Это не просто дизайнерское решение, это удобство медсестер и лаборантов. Данные требования отражены в ГОСТ ISO 6710-2011 «Контейнеры для сбора образцов венозной крови одноразовые. Технические требования и методы испытаний» и ГОСТ Р 53079.4-2008 «Технологии лабораторные клинические. Обеспечение качества клинических лабораторных исследований. Часть 4. Правила ведения преаналитического этапа».
Итак, что же означают эти яркие колпачки. Каждая пробирка имеет определенный реагент или же не имеет его, что тоже кодируется определенным цветом. Рассмотрим подробнее, каждый цвет и реагент.
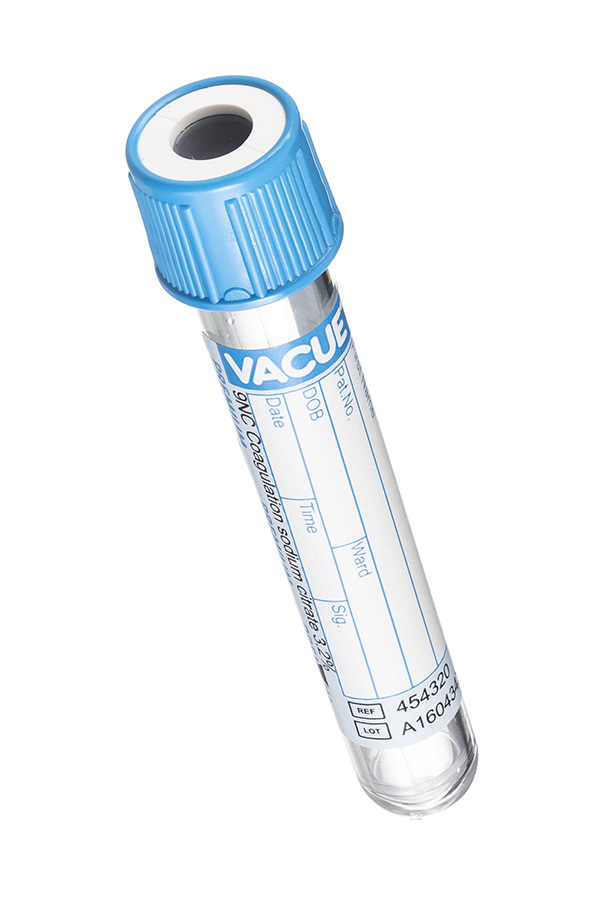
1. Пробирка с голубой крышкой (с цитратом натрия).
В данной пробирке имеется забуференный раствор натрия цитрата в возможных процентных соотношениях 3,2 и 2,8. Этот тип пробирок используется для исследования системы гемостаза (коагулограмма). В данный тип исследования входят такие показатели, как: АЧТВ, протромбин, фибриноген, тромбиновое время и другие.
Также пробирки с голубой крышкой могут содержать в себе реагент CTAD. Настоящий реагент используется для тех же исследований, но его применяют при исследовании пациентов, получающих антикоагулянтную терапию. В состав реагента входит забуференный цитрат натрия, теофиллин, аденозин и дипиридамол.
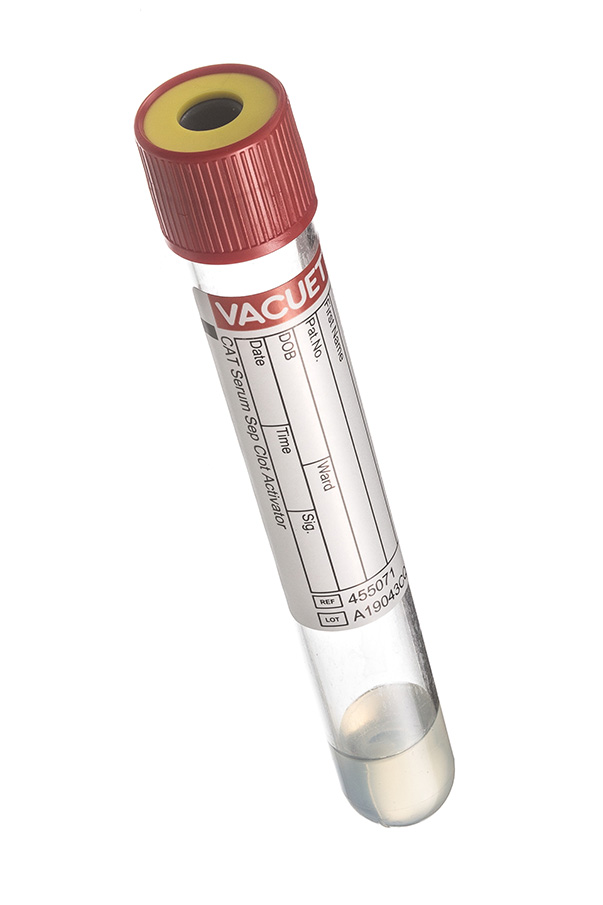
2. Пробирка с красной крышкой (с диоксидом кремния и разделительным гелем).
Данные пробирки используют для исследования сыворотки крови. Сыворотка крови, в отличие от плазмы, не содержит фибриногена, следовательно, чтобы получить пробу сыворотки, нужно активировать процесс свертывания пробы.
В пробирках с красной крышкой происходит активация данного процесса за счет диоксида кремния (SiО2) нанесенного на внутренние стенки в виде микрочастиц. Помимо реагента, в пробирках данного типа может содержаться разделительный гель. Он создает надежный барьер между сгустком и сывороткой, что важно во время хранения и транспортировки пробы. Пробирки с активатором свертывания используют для исследований в: биохимии, иммунологии, микробиологии, серологии и другие.
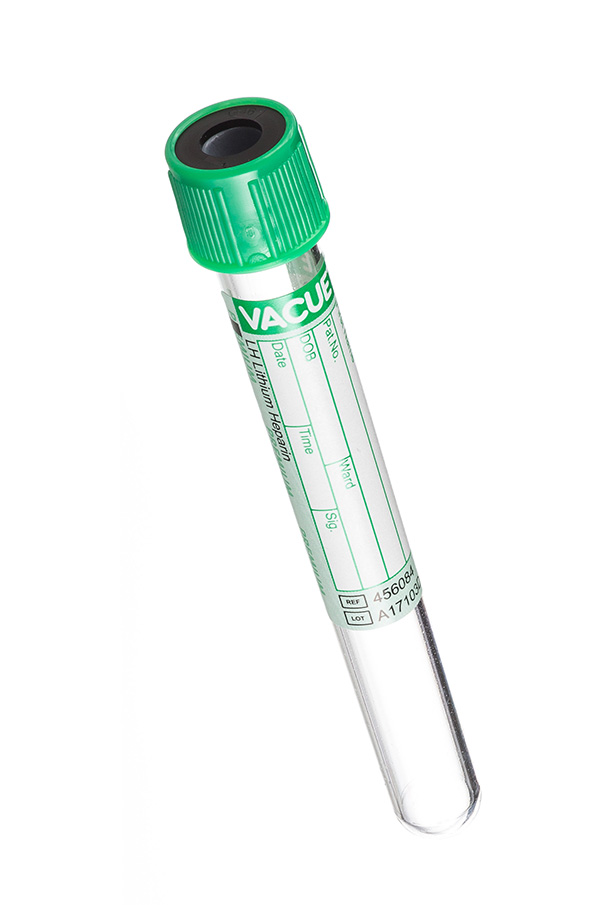
3. Пробирка с зеленой крышкой (с гепарином).
В отличие от пробирок с красной крышкой, служат для получения плазмы.
В них должен содержаться реагент, блокирующий процесс свертывания. В пробирках с зелеными крышками содержится антикоагулянт гепарин (натрий гепарин, литий гепарин, аммоний гепарин). В пробирках этого типа, также может содержаться гель для большей стабильности образца. Он создает надежный барьер между плазмой и форменными элементами во время транспортировки. Пробирки с антикоагулянтом могут использоваться для таких исследований как: электролитный состав крови, газовый состав крови, содержание алкоголя в крови.
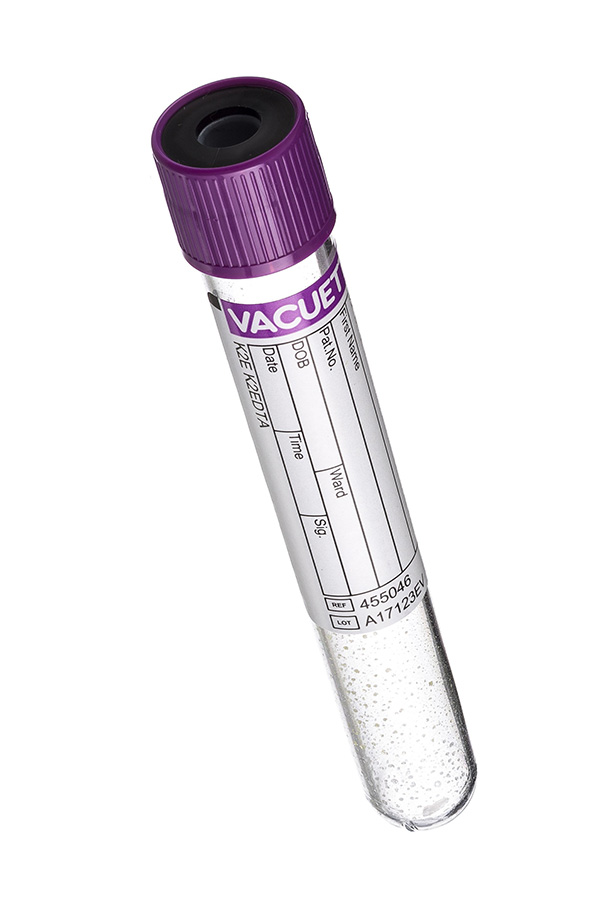
4. Пробирка с фиолетовой крышкой (ЭДТА).
Реагент, содержащийся в данных пробирках связывает ионы кальция и блокирует процесс свертывания. Реагент состоит из этилендиаминуксусной кислоты (ЭДТА). ЭДТА-к2 или ЭДТА-к3 нанесена на внутренние стенки пробирки. Эти пробирки переназначены для гематологических исследований (качественный и количественный состав крови). Для молекулярно-генетических исследований и определения вирусной нагрузки применяются пробирки с ЭДТА и разделительным гелем.
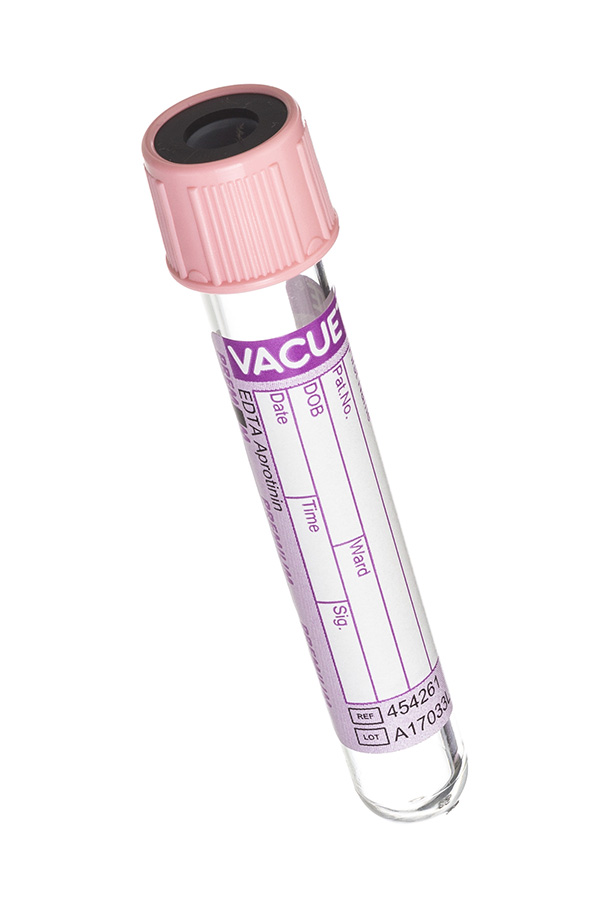
5. Пробирка с розовой крышкой (с апротинином и КЭДТА)
В данной пробирке содержится реагент КЭДТА и апротинин (устойчивый белок, выделенный из бычьих легких) – ингибитор тканевых и сывороточных протеолитических ферментов (трипсин, хемитрипсин, плазмин, калликреин). Этот реагент помогает стабилизировать нестабильные и проблемные аналиты (например, некоторые гормоны).
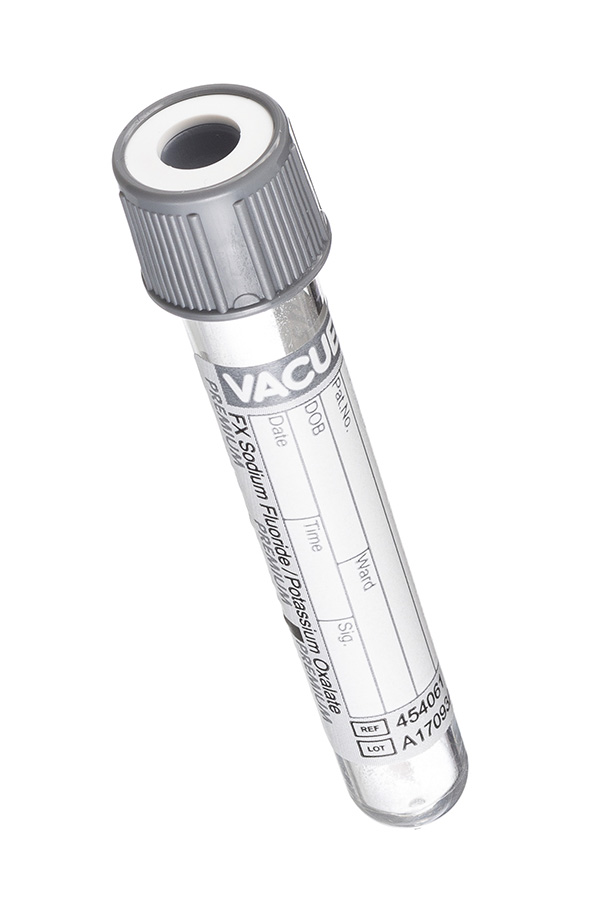
6. Пробирка с серой крышкой (с разными реагентами: лития гепарин и монойодацетат или натрия фторид и калия оксалат).
Специальные пробирки для исследования глюкозы с несколькими вариантами реагентов: монойодацетат и лития гепарин, натрия фторид и калия оксалат, натрия фторид и КзЭДТА. Благодаря тому, что реагент в своем составе содержит не только антикоагулянт, но и стабилизатор уровня глюкозы, проба может сохранять свою стабильность до 48 часов при комнатной температуре.
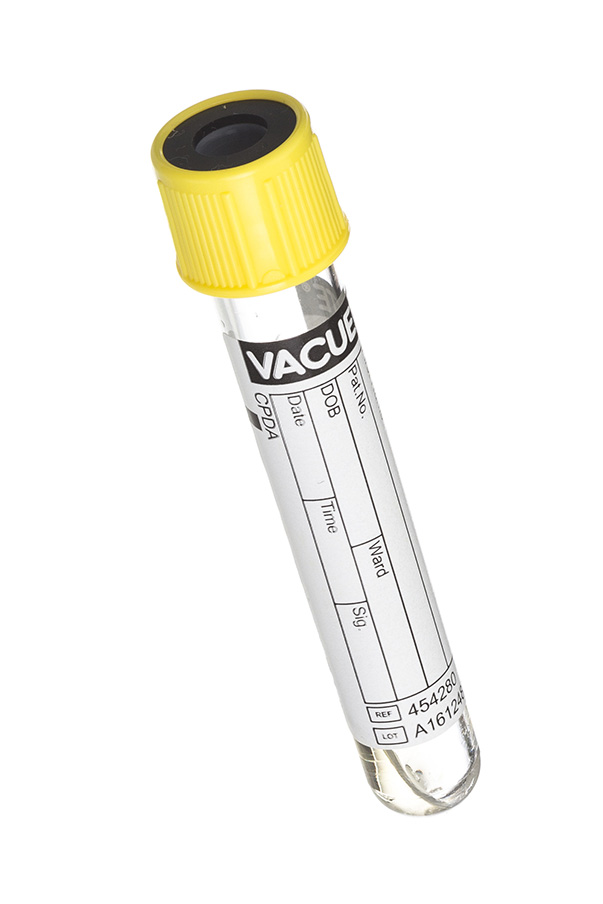
7. Пробирки с желтой крышкой (с лимонной кислотой, натрия цитратом, декстрозой).
8. Пробирки с черной крышкой (с цитратом натрия).
Используются для определения СОЭ и в составе реагента имеют 3,2% цитрат натрия.
Данный материал носит ознакомительный характер и не может использоваться в качестве обучающего.