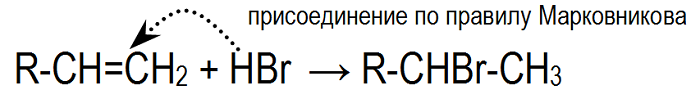какая реакция идет против правила марковникова
Правило Марковникова
При протекании любой реакции, необходимо, чтобы разорвались старые связи между атомами и образовались новые. По типу разрыва химической связи в исходной молекуле различают гомолитические и гетеролитические реакции.
Гомолитическими называются реакции, при которых в результате разрыва связей образуются частицы, имеющие неспаренный электрон — свободные радикалы:
А : В →А• + •В
Гетеролитическими называют реакции, протекающие через образование ионных частиц — катионов и анионов:
А : В → А + + :В —
Положительный ион в реакциях будет стремиться присоединить к себе электрон, т. е. будет вести себя как электрофильная частица. Отрицательный ион – так называемая, нуклеофильная частица будет атаковать центры с избыточными положительными зарядами.
Как определить по какому типу будет протекать разрыв?
1) Чем полярнее связь (чем больше разность ЭО атомов А и В), тем больше вероятность гетеролитического разрыва. Менее ЭО атом будет иметь +заряд – электрофильная частица, более электроотрицательный — отриц заряд – нуклеофильная частица.
2) Условия проведения реакции. Температура, свет способствует гомолитическому разрыву, образованию радикалов. А проведение реакций в полярном растворителе (вода) – способствует гетеролитическому разрыву. Наличие специальных катализаторов (кислот Льюиса), поляризующих химические связи, также обеспечивает гетеролитический разрыв.
Механизм электрофильного присоединения
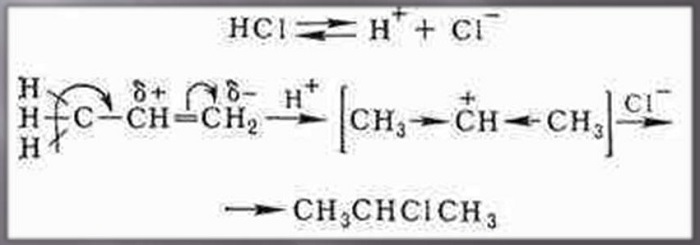
Реакция гидрогалогенирования алкенов идет по механизму электрофильного присоединения с гетеролитическим разрывом связей.
Электрофилом в данном случае является протон Н + в составе молекулы галогеноводорода HX (X — галоген). К одному атому углерода присоединяется водород, к другому – хлор. В случае этилена нет разницы к какому атому присоединится водород, а к какому – хлор. А в случае пропена и других несимметричных УВ это имеет большое значение – т.к. получаются разные вещества.
Направление реакции присоединения галогеноводородов к алкенам несимметричного строения (например, к пропилену CH2=CH–СН3) определяется правилом Марковникова:
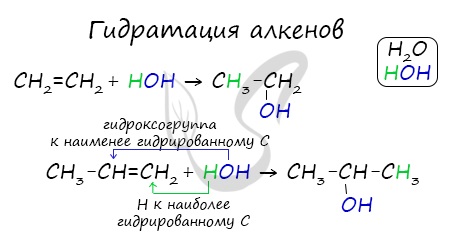
В реакциях присоединения полярных молекул типа НХ к несимметричным алкенам водород присоединяется к более гидрогенизированному атому углерода при двойной связи (т.е. атому углерода, связанному с наибольшим числом атомов водорода).
Так, в реакции HCl c пропиленом из двух возможных структурных изомеров 1-хлорпропана и 2-хлорпропана, образуется последний.
Правило Марковникова можно объяснить другим способом – с точки зрения смещения электронной плотности в молекуле или электронных эффектов. Алкильные группы обладают так называемым положительным индуктивным электронным эффектом (+I-эффектом).
Индуктивный эффект — смещение электронной плотности по цепи σ-связей, которое обусловлено различиями в электроотрицательностях атомов.
Поэтому присоединение электрофильной частицы Н + происходит к более гидрогенизированному углеродному атому, а электроотрицательная группа Х присоединяется к менее гидрогенизированному атому углерода. По этому катион водорода H + присоединяется к первому атому углерода, Сl — — ко второму, т.е к противоположным зарядам.
Присоединение против правила Марковникова
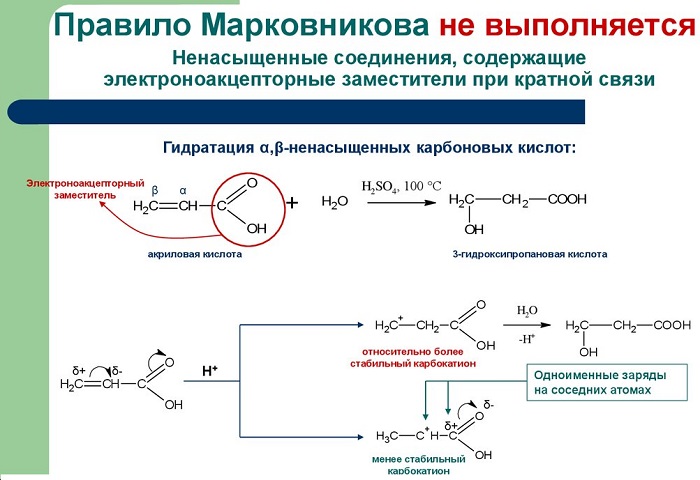
отмечается в случаях, когда заместитель при двойной связи оттягивает электронную плотность на себя, т.е. проявляет электроноакцепторные свойства (–I и/или –М-эффект).
Например, в реакции трихлорпропена Сl3C-CH=CH2 с HХ водород присоединяется к менее гидрогенизированному атому углерода, а Х – к более гидрогенизированному. Это обусловлено тем, что группа СCl3 проявляет отрицательный индуктивный эффект и электронная плотность пи-связи С=С смещена к менее гидрогенизированному атому углерода.
Сперва ответим на вопрос, почему алкены вступают в реакцию с электрофильными реагентами. Способность алкенов вступать в реакцию с электрофильными реагентами обусловлена повышенной электронной плотностью в области двойной связи (облако π-электронов над и под плоскостью молекулы).
Электрофильное присоединение протекает в несколько стадий.
I стадия: образование π-комплекса. π-Электронное облако двойной связи С=С взаимодействует с электрофилом (катион водорода).
II стадия (лимитирующая): образование карбокатиона.
Электрофил (Н+) присоединяется к одному из атомов углерода за счет электронной пары π-связи. На втором углеродном атоме, лишенном π-электронов, появляется положительный заряд.
III стадия: взаимодействие карбокатиона с анионом (например Cl-, образовавшемся при диссоциации HCl) которое приводит к продукту реакции.
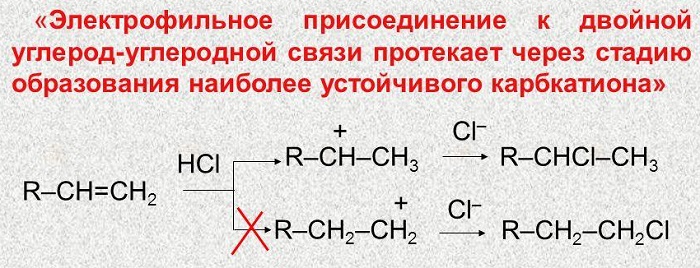
Правило Марковникова по другому можно выразить так — присоединение электрофила происходит таким образом, чтобы образовался наиболее стабильный (устойчивый) каброкатион. Это и есть современная формулировка правила Марковникова: электрофильное присоединение к двойной связи идет через образование наиболее устойчивого карбокатиона.
Теперь давайте посмотрим, какие карбокатионы устойчивые и почему.
Устойчивость карбокатионов увеличивается в данном ряду слева направо.

Реакции электрофильного присоединения к алкенам
Электрофильные реагенты являются наиболее характерными атакующими частицами в реакциях алкенов, идущих по С-Сπ связи.
Многочисленные экспериментальные данные свидетельствуют о том, что в отличие от реакций гидрирования электрофильное присоединение осуществляется по асинхронному типу.
Механизм реакции электрофильного присоединения к алкенам
Рассмотрим типичную реакцию электрофильного присоединения к алкенам — реакцию бромирования этилена:
Механизм реакции электрофильного присоединения к алкенам, в частности бромирования, в настоящее время представляется следующим
Доказательства механизма электрофильного присоединения к алкенам основаны на следующих фактах.
Циклический «неклассический» карбокатион, например норборнильный, образуется в некоторых реакциях мостиковых бициклических углеводородов и их производных. В таких «неклассических» карбокатионах атом углерода становится пентакоординированным. По В. А. Бархату [104, с. 227-411], «неклассический ион есть положительно заряженная частица, обладающая минимумом свободной энергии при данных межъядерных расстояниях, в которой делокализация положительного заряда осуществляется с помощью многоцентровой молекулярной орбитали, образованной, по меньшей мере частично, σ-перекрыванием атомных орбиталей атомов, по крайней мере часть из которых не связана между собой σ-остовом». Примерами таких ионов являются:
Направление электрофильного присоединения к алкенам. Правило Марковникова
Присоединение реагентов типа НХ к несимметричным алкенам идет по аналогичному бромированию механизму, но в данном случае возникает проблема направления присоединения.
В. В. Марковников в 1870 г. сформулировал правило, согласно которому кислоты присоединяются к несимметричным алкенам таким образом, что водород кислоты присоединяется к атому углерода, несущему наибольшее число атомов водороду. Это правило легко понять, если принять во внимание механизм реакции электрофильного присоединения, например:
Положительный конец диполя НВr ориентируется к атому углерода с наибольшей электронной плотностью, то есть к концевому. Из двух возможных карбокатионов А и Б первый, несомненно, более устойчив (стабилизация за счет положительных индуктивных эффектов трех метильных групп) и образуется быстрее. В результате при электрофильном присоединении в основном образуется mpem-бутилбромид. Следовательно, в современной трактовке правило Марковникова можно сформулировать следующим образом: присоединение НХ к алкену идет с образованием наиболее стабильного карбокатиона. Правило Марковникова в такой формулировке объясняет редкие случаи электрофильного присоединения к алкенам против классически сформулированного правила Марковникова. Например, в реакции присоединения НСl к алкену с сильной электроноакцепторной группой образуется более стабильный карбокатион А, а протон присоединяется к менее гидрогенизированному атому углерода:
Примеры реакций электрофильного присоединения
Естественное предположение о возможности присоединения к алкенам самых разнообразных электрофильных реагентов находит экспериментальное подтверждение. Необходимо, однако, помнить, что поляризация С-Сπ связи происходит в момент химической реакции, то есть реагент должен быть достаточно сильным электрофилом. Слабые электрофилы или, тем более, нуклеофилы должны быть «электрофилизированы» добавлением сильного электрофила (кислоты).
Среди типичных реагентов отметим:
Галогенирование.
Расчеты тепловых эффектов реакций галогенирования алкенов дают следующие результаты:
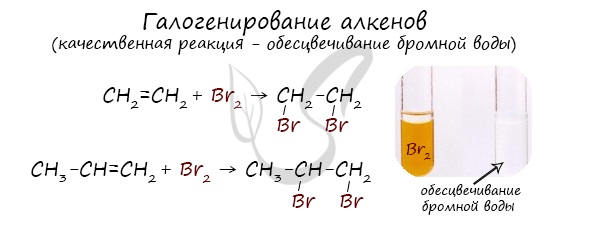
Все реакции галогенирования принципиально возможны и практически осуществимы, за исключением фторирования. Эта реакция вследствие очень высокой экзотермичности не поддается контролю. Легкость осуществления реакций галогенирования, например бромирования, в обычных органических растворителях, таких, как хлороформ, четыреххлористый углерод, широко используют в аналитических целях для качественного определения наличия двойной связи в органических соединениях.
Присоединение кислот к алкенам.
Механизм и особенности присоединения к алкенам рассмотрены выше. Отметим среди реакций этого типа взаимодействие с серной кислотой, которое лежит в основе важных технических процессов:
Гипогалогенирование.
Реакция гипохлорирования лежит в основе промышленного синтеза глицерина. Пропилен после пр вращения в хлористый аллил или аллиловый спирт подвергают действию хлорноватистой кислоты, которая взаимодействует по механизму электрофильного присоединения к алкенам.
Акцепторное влияние двух атомов хлора приводит к образованию обоих карбокатионов А и Б и, соответственно, смеси дихлорпропанолов. Собственно глицерин получают щелочным омылением дихлорпропанолов:
Гидратация алкенов (присоединение воды).
Вода является слабым электрофилом, и по этой причине ее прямое присоединение к алкенам осуществить не удается. Однако в присутствии сильных минеральных кислот в результате гидратации образуются спирты. Так получают синтетический этиловый спирт, техническую потребность в котором промышленность удовлетворяет гидратацией этилена, выделяемого из газов крекинга или продуктов пиролиза легких алканов (этана, пропана, бутана).
При сернокислотном методе пропусканием этилена через концентрированную серную кислоту получают этил сульфат (этил серную кислоту), который реагирует с водой, давая в итоге спирт и кислоту:
С фосфорной кислотой гидратация осуществляется под давлением. Спирт в данном случае образуется сразу при взаимодействии карбокатиона с водой.
Реакцию гидратации можно осуществить и в газовой фазе — при высоких температуре и давлении. В качестве катализаторов обычно применяют оксид алюминия ( Аl2O3 ), хлористый цинк ( ZnCl2 ) и др. Гомологи этилена образуют вторичные и третичные спирты.
Образование простых эфиров.
Присоединение спиртов к алкенам в присутствии сильных кислот приводит к образованию простых эфиров:
Образование сложных эфиров.
Карбоновые кислоты образуют с алкенами сложные эфиры. Реакция ускоряется сильными минеральными кислотами:
Алкены с галогенангидридами и ангидридами карбоновых кислот в присутствии кислот Льюиса дают продукт присоединения, который в зависимости от условий реакции далее превращается в непредельный кетон, насыщенный кетон и др.:
Непредельный кетон может образоваться и в результате отщепления протона от карбокатиона [46, т. 3].
Комплексы с переходными металлами.
В промышленности алкены из крекинг-газов выделяют с помощью раствора CuCl в аммиаке, а лучше — этаноламине.
Сорбция осуществляется при повышенном давлении, десорбция — при пониженном.
Алкилирование.
Одной из важнейших в практическом плане реакций алкенов является алкилирование — введение алкильной группы, которое приводит к алканам и может быть осуществлено различными методами.
Синтез изоалканов — высокооктанового бензина — реализован в промышленности в нескольких модификациях.
Сернокислотное алкилирование осуществляют действием 60%-ной серной кислоты на низшие алкены, выделяемые из газов крекинга или пиролиза пропан-бутановой фракции.
Трет-Бутилкатион реагирует с алкеном смеси (на схеме представлен один из вариантов). Стабилизация карбокатиона А отщеплением протона (вода прерывает процесс полимеризации) приводит к смеси алкенов, гидрирование которой дает изооктан.
Процесс, разработанный В. Н. Ипатьевым, в котором взаимодействие изобутилен-изобутановой смеси осуществляется в присутствии «твердой фосфорной кислоты» (фосфорная кислота на оксиде алюминия) или фторида бора, является примером катионоцепной реакции (см. раздел 9.5.5). Крупнотоннажное производство по этой схеме успешно реализовано самим Ипатьевым в США в 30-е годы. Взаимодействие алкенов с аренами (ароматическими углеводородами) рассмотрено в главе XV.
Правило Марковникова в химии имеет большое значение в случаях взаимодействия воды или протонных кислот с такими органическими веществами как алкены и алкины. Примером может служить уравнение реакции: пропен + вода.
Суть этого правила в направлении разных типов реакций в зависимости от химического строения с участием реагентов, в структуре которых есть двойная связь. За этим правилом могут протекать реакции присоединения, отщепления, замещения, а также — реакции изомеризации.
Кратко о жизни и деятельности ученого-органика Марковникова
Ученый Владимир Васильевич Марковников занимался исследованиями в таких отраслях как органический синтез, нефтехимия и теоретическая органическая химия.
Марковников Владимир Васильевич (1838-1904)
В период с 1862 по 1867 гг. он смог пополнить багаж знаний человечества об изомерах спиртов и жирных кислот, открыть в ряду олефиновых углеродов оксиды, в первый раз в истории синтезировать оксо- и галогенопроизводные изомеры масляной кислоты.
На основании знаний, полученных в результате этих исследований, учёный смог сформулировать новое учение про взаимное влияние атомов, которое впоследствии получило имя автора. Сделал он это в 1869 г.
Современная формулировка правила Марковникова
Механизм реакции взаимодействия электрофильных реагентов с молекулами органических веществ, в которых есть двойная связь (электрофильное присоединение), происходит с образованием наиболее устойчивых карбокатионов.
Но если в строении алкена есть неконцевая двойная связь, то в этом случае будет иметь место правило Зайцева.
В соответствии с ним — тогда будет менее выражена ориентация присоединения.
Механизм электрофильного присоединения
Направление реакций этого типа происходит благодаря такому явлению как электронный эффект. То есть, благодаря смещению электронной плотности в молекуле.
На первой стадии образуется комплекс в результате взаимодействия электронов двойной связи с электрофильной частицей (чаще всего это ион водорода).
Вторая стадия — стадия гетеролитического разрыва связи — характеризуется образованием ковалентной связи между одним из атомов углерода и электрофильной частицей, в итоге образуется карбокатион.
На третьей стадии происходит образование второй связи за счёт второй электронной пары аниона (карбокатион реагирует с анионом).
Простыми словами, общая схема действия этого правила заключается в том, что присоединение иона водорода происходит к тому атому углерода (он обязательно должен находится возле двойной связи), который заряжен более отрицательно.
Исключение из правила
Вопреки правилу протекают реакции, в которых заместителем, стоящим при двойной связи, производится оттягивание электронной плотности в свою сторону. Этим осуществляется проявление электроноакцепторных свойств.
Пример такой реакции есть взаимодействие хлороводорода с 3,3,3-трихлорпропеном.
Вторым случаем, когда реакция присоединения происходит против этого правила, есть протекание реакций за радикальным механизмом (в реакции присутствуют атакующие свободные радикалы).
Примером может служить присоединение олефинов к бромоводороду. В таких реакциях происходит гомолитический разрыв связи.
Где применяется правило Марковникова
Правило нашло своё применение:
В производстве различных смесей, использующихся как на производствах, так и в быту. Например, оно применяется в изготовлении химического сырья, топлива и каучука.
Также его применяют для упрощения производства масел для смазки, спирта и полимеров.
Кроме всего вышеперечисленного, правило используется для изготовления смесей, входящих в состав горючего для бензинных двигателей самолетов и автомобилей, и для производства сажи, из которой потом делается топографическая краска.
Алкены
Номенклатура и изомерия алкенов
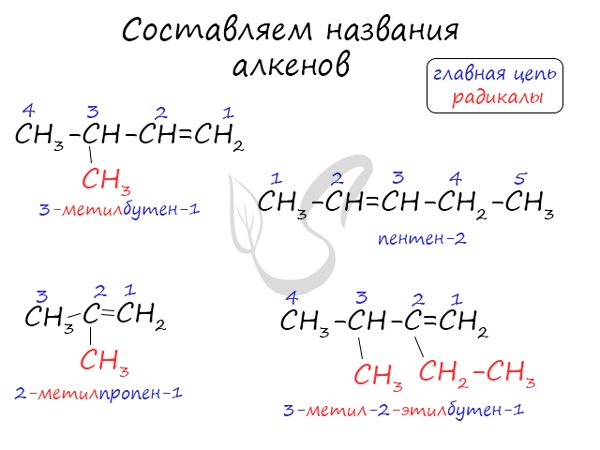
Названия алкенов формируются путем добавления суффикса “ен” к названию алкана с соответствующим числом: этен, пропен, бутен, пентен и т.д.
При составлении названия алкена важно учесть, что главная цепь атомов углерода должна обязательно содержать двойную связь. Принято начинать нумерацию атомов углерода с того края, к которому ближе двойная связь. В конце названия указывают атом углерода, у которого начинается двойная связь.
Атомы углерода, прилежащие к двойной связи находятся в sp 2 гибридизации.
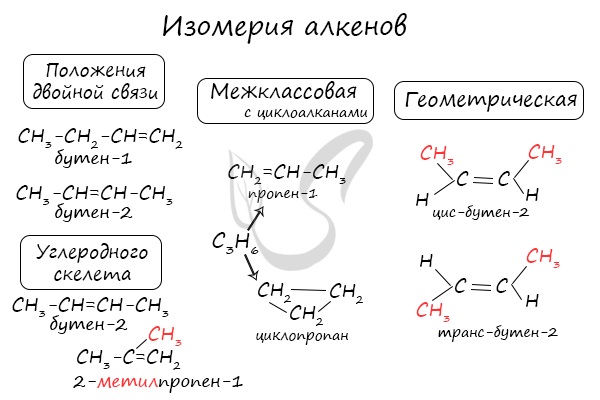
Для алкенов характерна изомерия углеродного скелета, положения двойной связи, межклассовая изомерия с циклоалканами и пространственная геометрическая изомерия в виде существования цис- и транс-изомеров.
Получение алкенов
В результате крекинга нефти образуется один алкан и один алкен.
В реакции галогеналкана со спиртовым(!) раствором щелочи образуется алкен. По правилу Зайцева, водород отщепляется от соседнего наименее гидрированного атома углерода.
Внутримолекулярная дегидратация спиртов происходит при t > 140 °C.
Химические свойства алкенов
Водород присоединяется к атомам углерода, образующим двойную связь. Пи-связь (π-связь) рвется, остается единичная сигма-связь (σ-связь).
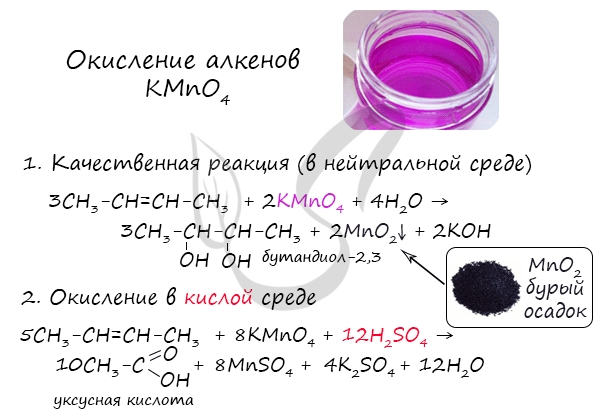
Реакция с бромной водой является качественной для непредельных соединений, содержащих двойные (и тройные) связи. В ходе такой реакции бромная вода обесцвечивается, что указывает на присоединение его по кратным связям к органическому веществу.
Реакция с хлором на свету протекает по свободнорадикальному механизму, так как на свету молекулы хлора расщепляются, образуя свободные радикалы.
Алкены вступают в реакции гидрогалогенирования, протекающие по типу присоединения.
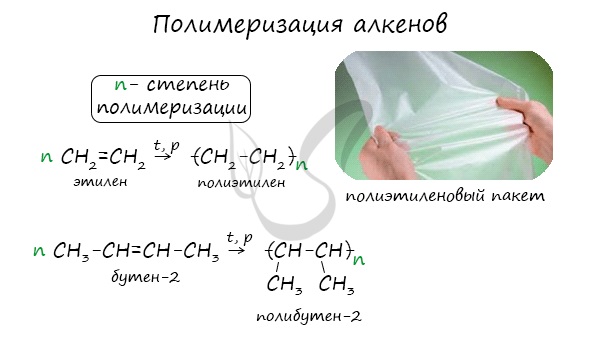
Индекс “n”, степень полимеризации, обозначает число мономерных звеньев, которые входят в состав полимера.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.