какая реакция не является характерной на катион цинка
Качественная реакция на цинк
Какая качественная реакция на цинк наиболее часто используется для определения этого катиона в анализируемой пробе? Каким образом осуществляют выбор метода и методики для анализа различных объектов? Что такое избирательность метода?
Гидроксиды щелочных металлов осаждают из растворов солей цинка белый студнеобразный осадок 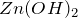
Сероводород при рН > 2,2, а также сульфиды щелочных металлов и аммония осаждают из растворов солей цинка белый осадок сульфида цинка, растворимый в минеральных кислотах – вторая качественная реакция на цинк.
При проведении анализа имеют дело с самыми разнообразными объектами — продуктами промышленного и сельскохозяйственного производства, объектами окружающей среды, космическими объектами, произведениями искусства и т.д. Естественно, что выбор метода и методики анализа при этом определяется не только задачей анализа, но также свойствами и особенностями образца. Необходимо учитывать физические свойства анализируемого объекта: его агрегатное состояние, летучесть, гигроскопичность, механическую прочность и т.д. Определяющими при выборе метода анализа являются химические свойства образца. При этом важно знать и принимать во внимание: химические свойства основы образца, часто называемой матрицей анализируемого объекта; качественный химический состав образца; химические свойства определяемого компонента и сопутствующих ему примесей.
Зная химические свойства основы и ожидаемых компонентов анализируемого объекта, оценив возможные помехи, выбирают как можно более избирательный метод, т.е. метод, с помощью которого в данных условиях можно обнаружить или определить нужные компоненты без помех со стороны других присутствующих компонентов. В химической литературе наряду с термином «избирательность» используют термин «селективность». Если метод или методика позволяют обнаруживать или определять только один компонент, то их называют специфичными.
Общая характеристика IV группы



Хорошо растворимы в воде сульфаты, нитраты, хлориды, бромиды и иодиды алюминия, цинка и хрома (III). Ионы Аl 3+ и Zn 2+ бесцветны, соединения хрома (III) окрашены в зеленый или фиолетовый цвет.
Гидроксиды катионов четвертой группы труднорастворимы и являются слабыми электролитами. Кроме того, они обладают амфотерными свойствами. Это свойство гидроксидов используется в систематическом ходе анализа.
Групповым реагентом является NaOH в избытке. Гидроксиды алюминия, хрома (III) и цинка растворяются в избытке щелочи и при действии группового реактива переходят в раствор в виде соединений Na[Al(OH)4], Na2[Zn(OH)4], Na3[Cr(OH)6].
Так как гидроксиды катионов четвертой аналитической группы являются очень слабыми основаниями, соли этих катионов в водных растворах гидролизованы. Соли очень слабых кислот, например сульфиды, карбонаты алюминия и хрома (III), подвергаются необратимому гидролизу и не могут существовать в водном растворе.
Частные реакции катионов четвертой аналитической группы
Реакции катиона хрома (III) Сг 3+
1. Гидроксиды щелочных металлов NaOH и КОН из раствора соли хрома (III) выделяют серо-зеленый аморфный осадок гидроксида хрома (III):
СгС13 + ЗКОН → Сг(ОН)з ↓ + ЗКС1
Осадок растворяется в разбавленных кислотах, а также в избытке растворов щелочей с образованием комплексного соединения:
Сг(ОН)3 + ЗКОН → Кз[Сг(ОН)6], что указывает на амфотерность гидроксида хрома (III).
Если полученный раствор хромата подкислить разбавленной серной кислотой, то пероксид водорода окисляет хромат в надхромовую кислоту H2CrO6 синего цвета, легко переходящую в эфирный слой.
Реакции катиона цинка Zn 2+
1. Гидроксиды щелочных металлов NaOH или КОН из раствора солей цинка выделяют белый студенистый осадок гидроксида цинка:
Гидроксид цинка обладает амфотерными свойствами и поэтому растворяется в разбавленных кислотах и в избытке щелочей:
2. Гексацианоферрат (III) калия Кз[Fе(СN)6] с солями цинка дает коричневато-желтый осадок гексациано-феррата (III) цинка:
Осадок растворяется в хлороводородной кислоте и растворе аммиака.
3. Гексацианоферрат (II) калия K4[Fe(CN)6 ] реагирует с солями цинка с образованием белого осадка гексацианоферрата(П) цинка-калия:
Осадок нерастворим в разбавленной хлороводородной, растворяется в щелочах, поэтому реакцию нельзя проводить в щелочной среде.
Реакция является фармакопейной.
4. Сульфид натрия Na2S осаждает из нейтрального раствора ион цинка в виде белого аморфного сульфида цинка:
Осадок не растворяется в уксусной кислоте, но растворяется в минеральных кислотах. Реакция является фармакопейной.
5. Микрокристаллоскопическая реакция. Тетрароданохидраргират (II) аммония (NH4)2[Hg(SCN)4] образует в нейтральном или слабокислом растворе с ионами цинка бесцветные кристаллы в виде крестов или дендритов Если в растворе находилось большое количество минеральной кислоты, а солей цинка небольшое количество, то кристаллы выпадают в виде клиньев
6. Образование «зелени Ринмана». Кусочек фильтровальной бумаги, смоченной раствором соли цинка и раствором нитрата кобальта, высушивают и озоляют в фарфоровом тигле на газовой горелке. При сжигании дает золу, окрашенную в зеленый цвет цинкатом кобальта («зелень Ринмана»).
При этом происходит реакция:
Реакции катиона алюминия А1 3+
1. Гидроксиды щелочных металлов NaOH или КОН с солями алюминия образуют белый осадок гидроксида алюминия:
Вследствие амфотерного характера гидроксида алюминия осадок растворяется в разбавленных кислотах и в избытке щелочи:
2. Сухой хлорид аммония NH4CI выделяет из тетрагидроксоалюмината калия гидроксид алюминия:
 |
LiveInternetLiveInternet
–Метки
–Музыка
–Поиск по дневнику
–Подписка по e-mail
–Интересы
–Постоянные читатели
–Статистика
Реакции ионов цинка Zn2+
1. Реактив – гидроксиды щелочных металлов
Гидроксиды щелочных металлов осаждают из водных растворов осадок Zn(OH)2 белого цвета, растворимы в избытке реактива с образованием цинкатов:
Zn(OH)2 + 2OH–ZnO22– + 2H2O
2. Реактив – раствор аммиака NH3•H2O
Раствор аммиака осаждает белый осадок Zn(OH)2, который растворяется в избытке реактива с образованием комплексного соединения гидроксида тетраамминцинка:
Zn2+ + 3NH3 + 2H2OZn(OH)2 + 2NH4+
Zn(OH)2 + 4NH3[Zn(NH3)4]2+ + 2OH–
3. Реактив – сульфид натрия Na2S
Сульфид-ионы при взаимодействии с катионами цинка образуют белый осадок ZnS, нерастворимый в уксусной кислоте, но растворимый в соляной кислоте:
4. Реактив – гексацианоферрат(II) калия K4[Fe(CN)6]
При взаимодействии водных растворов солей цинка с K4[Fe(CN)6] образуется белый осадок гексацианоферрата(III) калия-цинка, нерастворимый в 2 н растворе HCl:
3Zn2+ + 2K4[Fe(CN)6]K2Zn[Fe(CN)6]2Ї + 6K+
Эта реакция позволяет отличить ионы Al3+ от ионов Zn2+.
5. Реактив – гексацианоферрат(III) калия K3[Fe(CN)6]
С ионами цинка гексацианоферрат(III) калия образует желто-коричневый осадок гексацианоферрата(III) цинка:
Zn2+ + 2K3[Fe(CN)6]Zn3[Fe(CN)6]2Ї + 6K+
Кроме указанных реакций на катионы цинка существуют, хотя и менее чувствительные, но специфические реакции.
6. Реактив – тетрароданомеркурат аммония (NH4)2[Hg(SCN)4]
Тетрароданомеркурат аммония в присутствии катионов кобальта с ионами цинка в кислой среде образует фиолетово-голубой осадок тетрароданомеркуратов кобальта и цинка:
2[Hg(SCN)4]2– + Zn2+ + Co2+Co[Hg(SCN)4]•Zn[Hg(SCN)4]Ї
В присутствии же ионов меди этот реактив с катионами цинка в кислой среде образует кристаллический осадок оливково-зеленого цвета смеси тетрароданомеркуратов меди и цинка:
2[Hg(SCN)4]2– + Zn2+ + Cu2+Cu[Hg(SCN)4]•Zn[Hg(SCN)4]Ї
К 5 каплям раствора соли цинка приливают 2-3 капли 2 н раствора серной кислоты, затем равный объем 0,1%-ного раствора сульфата меди(II) или 0,02% раствор хлорида кобальта(II) и 5-7 капель тетрароданомеркурата аммония.
7. Реактив – нитрат кобальта(II) Co(NO3)2
Открытие цинка в виде «риммановой зелени» полоску фильтровальной бумаги смачивают раствором соли цинка и раствором нитрата кобальта Co(NO3)2, затем сжигают. При наличии в растворе катионов цинка, образующийся после сжигания бумаги пепел приобретает темно-зеленую окраску («риманова зелень»), которая обусловлена образованием цинката кобальта, обладающего зеленой окраской:
Zn2+ + Co2+ + 2H2OCoZnO2Ї + 4H+
Чувствительность реакции невысокая – не менее 100 мг/л цинка.
8. Реактив – дитизон
Раствор дитизона в хлороформе (CHCl3) в щелочной среде образует с ионами цинка Zn2+ внутрикомплексную соль, окрашенную в малиновый цвет:
В отличие от аналогичных дитизонатов других элементов соль окрашивает в щелочной среде не только органический, но и водный слой.
К 2-3 каплям соли цинка добавляют 2 н раствор NaOH до растворения образующегося осадка, затем приливают равный объем дитизона и энергично встряхивают содержимое пробирки. Появление красной окраски в органическом и в водном слоях после их разделения указывает на наличие дитизоната цинка.
Урок №56. Цинк
ЦИНК И ЕГО СОЕДИНЕНИЯ
СТРОЕНИЕ АТОМА
Цинк – элемент IIБ подгруппы четвертого периода. Цинк относится к семейству d-элементов, поскольку электронное строение цинка отражается конфигурацией.
Нахождение в природе
Цинковую обманку считают первичным минералом, из которого образовались другие минералы цинка:
§ каламин 2ZnO · SiO 2 · Н 2 O
В организме взрослого человека содержится в среднем около 2 г цинка, в виде его соединений, который концентрируется преимущественно в простате, мышцах, печени и поджелудочной железе.
Недостаток цинка в организме приводит к ряду расстройств — раздражительность, утомляемость, потеря памяти, депрессивные состояния, снижение остроты зрения, уменьшение массы тела, снижение уровня инсулина, аллергические заболевания, анемия и др.
ЦИНК
СФАЛЕРИТ
Способы получения
Цинк получают из сульфидной руды. Сульфид цинка обжигают в печи кипящего слоя:
Чистый цинк из оксида получают двумя способами.
При пирометаллургическом способе оксид цинка восстанавливают углём или коксом при 1200—1300 °C:
Получаемый раствор сульфата цинка очищают от примесей (осаждением их цинковой пылью) и подвергают электролизу. При электролизе чистый цинк осаждается на алюминиевых катодах, с которых его удаляют и подвергают плавлению в индукционных печах. Таким образом можно получить цинк с высокой чистотой (до 99,95 %).
Качественные реакции
При дальнейшем добавлении избытка щелочи амфотерный гидроксид цинка растворяется с образованием комплексной соли тетрагидроксоцинката :
Химические свойства
2. Цинк взаимодействует со сложными веществами:
§ с парами воды при температуре красного каления с образованием оксида цинка и водорода:
§ с минеральными кислотами (с соляной, фосфорной и разбавленной серной кислотой и др.).
§ Аналогично: при нагревании с азотной кислотой образуются различные продукты в зависимости о концентрации кислоты – N 2 O, N 2 и др. :
Цинк реагирует с расплавом щелочи с образованием цинката и водорода :
С газообразным аммиаком при 550–600°С образует нитрид цинка:
растворяется в водном растворе аммиака, образуя гидроксид тетраамминцинка:
Оксид цинка
Способы получения
1. Окислением цинка кислородом:
2. Разложением гидроксида цинка при нагревании:
3. Оксид цинка можно получить разложением нитрата цинка:
Химические свойства
Оксид цинка растворяется в избытке раствора щелочи с образованием тетрагидроксоцинката :
3. Оксид цинка не взаимодействует с водой.
7. Оксид цинка — твердый, нелетучий. А следовательно, он вытесняет более летучие оксиды (как правило, углекислый газ) из солей при сплавлении.
Гидроксид цинка
Способы получения
Химические свойства
3. Гидроксид цинка взаимодействует с растворимыми основаниями (щелочами).
В расплаве образуются соли — цинкаты:
Гидроксид цинка растворяется в избытке щелочи с образованием тетрагидроксоцинката :
4. Гидроксид цинка разлагается при нагревании:
Соли цинка
Нитрат и сульфат цинка
Комплексные соли цинка
§ с кислотными оксидами
§ Под действием избытка сильной кислоты осадок не выпадает, т.к. амфотерный гидроксид цинка реагирует с сильными кислотами.
§ Под действием небольшого количества ( недостатка ) сильной кислоты осадок все-таки выпадет, для растворения гидроксида цинка кислоты не будет хватать:
§ Аналогично с недостатком азотной кислоты выпадает гидроксид цинка:
§ Если выпарить воду из раствора комплексной соли и нагреть образующееся вещество, то останется обычная соль-цинкат:
Цинкаты
Соли, в которых цинк образует кислотный остаток (цинкаты) — образуются из оксида цинка при сплавлении с щелочами и основными оксидами:
§ цинкаты реагируют с кислотами с образованием солей цинка :
§ под действием избытка воды цинкаты переходят в комплексные соли:
Сульфид цинка
Сульфид цинка — так называемый «белый сульфид». В воде сульфид цинка нерастворим, зато минеральные кислоты вытесняют из сульфида цинка сероводород (например, соляная кислота):
Под действием азотной кислоты сульфид цинка окисляется до сульфата:
(в продуктах также можно записать нитрат цинка и серную кислоту).
Концентрированная серная кислота также окисляет сульфид цинка:
При окислении сульфида цинка сильными окислителями в щелочной среде образуется комплексная соль:
Аналитические реакции катионов цинка Zn (II).  13711
13711
а) Реакция с тетрароданомеркуратом (II) аммонияобразует с ионами цинка в слабокислой среде белый кристаллический осадок Zn[Hg(SCN)4]:
Выполнение реакции. К 2-3 каплям раствора, содержащего ионы цинка, добавляют каплю разбавленного раствора соли кобальта и 2-3 капли реагента. Слегка потирают палочкой по стенкам пробирки. В присутствии цинка образуется голубой осадок. Рекомендуется провести контрольный опыт. Для приготовления разбавленного раствора соли кобальта в пробирку помещают 1-2 капли 0,1 М раствора кобальта и разбавляют дистиллированной водой (3-5 см³).
б) Реакция с дитизоном (дивинилтиокарбазоном).В пробирку вносят 5-10 капель раствора ZnCl2, прибавляют несколько капель раствора гидроксида натрия до растворения выпавшего белого осадка гидроксида цинка и 5 капель хлороформного раствора дитизона, встряхивают. Раствор окрашивается в красный цвет.
Выполнение реакции. В пробирку вносят 5-10 капель раствора ZnCl2, прибавляют постепенно несколько капель раствора NaOH до растворения выпавшего белого осадка гидроксида цинка и
5 капель хлороформного раствора дитизона. Пробирку встряхивают несколько раз.
в) Реакция с сероводородом или сульфидом аммония.Поместите в пробирку 3-5 капель раствора какой-либо соли цинка, добавьте несколько капель предварительно нейтрализованной формиатной буферной смеси (вместо формиатной буферной смеси можно добавить 0,05моль/дм³ раствор НCl – ¼ от объема раствора) и пропустите через раствор сероводород или свежеприготовленный сульфид аммония. Выпадает белый осадок сульфида цинка:
Выполнение реакции. 1. Осаждение может быть выполнено в широком интервале значений рН: от 2 до 9.
2. Осаждение лучше проводить при нагревании в ацетатном или формиатном буферном растворе; при этом осадок получается крупнозернистый, легко отделяющийся фильтрованием и промывающийся.
4. Катионы, образующие в тех же условиях осадки с сульфид-ионами, должны быть предварительно удалены.
г) Реакция с гексацианоферратом (II) калия K4[Fe(CN)6].Поместите в пробирку 2-3 капли раствора какой-либо соли цинка, прибавьте 3 капли раствора K4[Fe(CN)6] и нагрейте смесь до кипения.
Выполнение реакции. 1. Значение рН £ 7, так как осадок в щелочной среде растворяется.
2. При действии избытка реактива может получиться более растворимый осадок Zn2 [Fe(CN)6].
3. Ионы алюминия и хрома не мешают этой реакции, другие катионы третьей аналитической группы должны быть удалены.
4. Окислители, окисляющие К4[Fe(CN)6] в К3[Fe(CN)6], должны отсутствовать.
д) Реакция с гидроксидом натрия NaOH и аммиаком NH3. При осторожном прибавлении по каплям щелочей или аммиака выделяется белый осадок гидроксида цинка:
Он растворим как в кислотах, так и в щелочах, так как гидроксид цинка амфотерен:
Выполнение реакции. В пробирку вносят 5-6 капель раствора хлорида цинка, прибавляют 1-2 капли раствора NaOH. Выпадает белый осадок гидроксида цинка. Продолжают прибавлять по каплям раствор NaOH при перемешивании содержимого пробирки. Осадок растворяется.
е) Реакция с нитратом кобальта Со(NО3)2.
Выполнение реакции 1.При нагревании оксида цинка с небольшим количеством нитрата кобальта Со(NО3)2 образуется цинкат кобальта, так называемая зелень Ринмана:
Выполнение реакции 2. Осадок Zn(ОН)2 или Zn(NО3)2 помещают на крышке микротигля на полоску фильтровальной бумаги, смоченной предварительно каплей раствора Со(NО3)2 и осторожно нагревают до озоления. Получается зеленая зола вследствие образования зелени Ринмана.
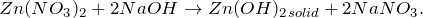
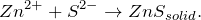




 13711
13711