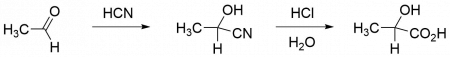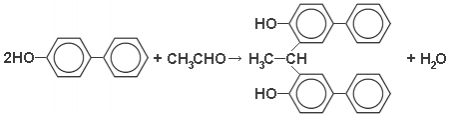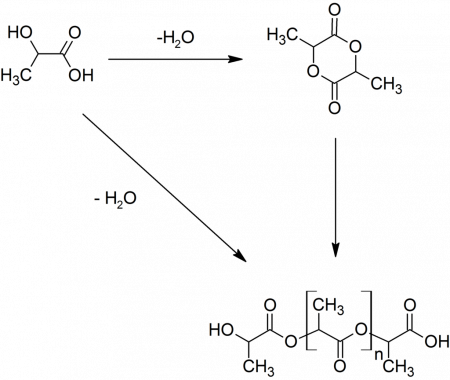какая реакция является качественной на молочную кислоту
Молочная кислота

Молочная кислота — международное непатентованное наименование лекарственного средства
Молочная кислота в желудочно-кишечном тракте
В норме в желудочном соке молочная кислота отсутствует. Молочная кислота образуется в желудке человека в большом количестве при различных патологических процессах: стенозе привратника с задержкой эвакуации пищи из желудка, отсутствии соляной кислоты, раковом процессе (Рапопорт С.И. и др.).
Молочную кислоту продуцируют многие анаэробные бактерии, обитающие в кишечнике человека, в частности, представители родов Bifidobacterium, Lactobacillus, Actinomyces, Ruminococcus (Ардатская М.Д., Минушкин О.Н.), Collinsella. В свою очередь, пропионовокислые и другие бактерии — представители нормальной микрофлоры кишечника, используют молочную кислоту в качестве исходного вещества и в процессе своей жизнедеятельности превращает её в пропионовую и уксусную кислоты, углекислый газ и другие метаболиты.
Молочная кислота в ротовой полости
Молочная кислота во влагалище
Оптические изомеры молочной кислоты
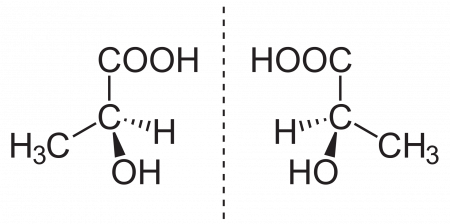
Молекула молочной кислоты ассиметрична и поэтому может существовать в двух оптически изомерных формах: правовращающаяся (L-молочная) и левовращающаяся (D-молочная). Смесь двух оптических изомеров одного вещества в равных количествах называют рацематом.
Получаемая в результате молочнокислого брожения чаще всего содержит равное количество обоих стереоизомеров и представляет собой густую жидкость. Такая молочная кислота иногда называется «молочной кислотой брожения». По химическим свойствам она отличается от L- и D-молочных кислот и является не простым рацематом, а рацемическим соединением двух изомеров молочной кислоты.
Правовращающаяся молочная кислота иногда называется парамолочная или мясомолочная кислота, так как она всегда присутствует в мышцах млекопитающих.
Исследование уровня молочной кислоты в организме человека
Качественное определение молочной кислоты в желудочном соке проводят с помощью реакции Уффельмана (пробы с карболовой кислотой). Проба основана на изменении окраски раствора за счет образования молочнокислого железа желтого цвета. К 2–3 мл однопроцентного раствора карболовой кислоты приливают 1 каплю 10 % раствора хлорного железа. Раствор приобретает фиолетовый цвет. Затем по каплям добавляют профильтрованный желудочный сок. В присутствии молочной кислоты появляется желтое окрашивание.
Молочная кислота — ингридиент косметических средств, вспомогательное вещество ряда лекарств и пищевая добавка

Молочная кислота, L–, D– и DL–, как пищевая добавка, имеет код Е270 и является согласно СанПиН 2.3.2.1293-03 регулятором кислотности. В этом качестве она используется при приготовлении нектаров, джемов, мармеладов и других подобных продуктов, включая низкокалорийные, неэмульгированных растительных и животных масел и жиров (кроме масел, полученных прессованием и оливкового масла), специально предназначенных для кулинарных целей, сыров сывороточных, консервированных фруктов и овощей, хлеба, макаронных изделий и пива.
Определение физико-химических показателей молока. Химия. 10 класс. Практическая работа
Пояснительная записка
Данная практическая работа проводится в курсе органической химии, после изучения тем: «Жиры», «Углеводы», «Белки». Практическая работа включает в себя только качественные реакции на данные классы соединений.
Исследовать молоко можно выбирая критерии:
Практическая работа «Определение физико-химических показателей молока»
Качество молока бывает разным. Оно зависит от породы и возраста животного, периода лактации, условий кормления и содержания, техник и доения, здоровья животного и его индивидуальных особенностей, а также от способов консервации молока, условий его хранения и добросовестности производителей ( которые в некоторых ситуациях могут сознательно вводить в молоко добавки, скрывающие истинное качество молока).
1. ОПРЕДЕЛЕНИЕ КИСЛОТНОСТИ МОЛОКА
Оборудование и реактивы: бюретка, пипетки на 10 и 20 мл., колба коническая на 100 мл, децинормальный раствор щелочи, 1% спиртовой раствор фенолфталеина.
Пояснения к заданию. О свежести и натуральности молока можно судить по кислотности. Свежевыдоенное молоко обладает бактерицидными свойствами, имеет амфотерную реакцию на лакмус (красная лакмусовая бумажка синеет, а синяя краснеет).
Через некоторое время в молоке начинают развиваться микроорганизмы, прежде всего молочнокислые бактерии, которые сбраживают молочный сахар и образуют молочную кислоту, что повышает кислотность молока. Кроме того, кислотность молока связана с кислотным характером белков. Кислотность молока тем выше, чем дольше хранится оно неохлажденным. Титруемую кислотность молока определяют в условных градусах Т (Тернера). Под условным градусом Т понимают количество миллилитров децинормального раствора (0,1 Н) щелочи, необходимое для нейтрализации 100 мл молока. Индикатором служит 1% раствор фенолфталеина. При повторном или параллельном определении кислотности одного и того же молока расхождение не должно превышать 1Т.
Ход работы
1. Налейте в бюретку децинормальный раствор щелочи.
2. В колбу вместимостью 100 мл отмерьте 10 мл исследуемого молока и 20 мл
дистиллированной воды (воду добавляют для того, чтобы более отчетливо уловить розовый оттенок при титровании).
3. Добавьте в смесь 2-3 капли 1% раствор фенолфталеина и тщательно взболтайте.
4. Из бюретки (предварительно отметив уровень щелочи) по капля м прибавляйте в колбу при постоянном взбалтывании 0,1Н раствор щелочи до появления слабо-розового окрашивания, не исчезающего в течение одной минуты.
5. Отсчитайте количество миллилитров щелочи, пошедшей на титрование 10 мл молока.
6. Произведите расчет кислотности молока. (для выражения кислотности исследуемого молока в условных градусах Тернера (Т) количество мл щелочи, израсходованной на титрование 10 мл молока, умножьте на 10, т.е. сделайте перерасчет на 100 мл молока. Например, на титрование пошло 1,8 мл щелочи, титруемая кислотность составит 1,8*10= 18Т
7. Полученные данные запишите в сводную таблицу. (Приложение 1)
2. ОПРЕДЕЛЕНИЕ БЕЛКА В МОЛОКЕ
Оборудование и реактивы: пробирки, растворы сульфата меди (II), щелочи, азотной кислоты.
Ход работы
1. Биуретовая реакция – качественная реакция на пептидные связи. В чистую пробирку добавить 1 мл медного купороса и 2 мл щелочи, после чего добавить небольшое количество молока до появления фиолетово-синего окрашивания раствора.
2. Ксантопротеиновая реакция – качественная реакция на содержание ароматических и гетероядерных циклов в составе амикислот.
3. Полученные данные запишите в сводную таблицу. (Приложение 1)
3. ОПРЕДЕЛЕИЕ НАЛИЧИЯ СОДЫ В МОЛОКЕ
Оборудование и реактивы: пробирки, фенолфталеин, раствор соляной кислоты.
Пояснение к заданию. Для того, чтобы намеренно скрыть повышенную кислотность молока, в него может быть добавлена сода. Нейтрализуя молочную кислоту, сода не задерживает развитие гнилостных микроорганизмов и способствует разрушению витамина С. Молоко, в которое добавлена сода, не пригодно для употребления в пищу.
Ход работы
1. В сухую пробирку налейте 5 мл молока.
2. Осторожно по стенке добавьте несколько капель фенолфталеина.
3. Наблюдайте за изменением окраски кольца на границе слоев в течение 10 минут. Бесцветная окраска кольца свидетельствует об отсутствии в молоке соды, фиолетовая окраска – о наличии даже незначительных следов соды. Полученный результат подтвердите раствором соляной кислоты.
4. Полученные данные запишите в сводную таблицу. (Приложение 1)
4. ОПРЕДЕЛЕНИЕ НАЛИЧИЯ КРАХМАЛА В МОЛОКЕ
Оборудование и реактивы: пробирки, спиртовка, спички, пробиркодержатель, раствор Люголя (раствор йода в глицерине).
Пояснения к заданию. Крахмал или муку добавляют в молоко, чтобы придать ему более
густую консистенцию после разбавления водой.
Ход работы
1. В пробирку наливают 5-10 мл молока и доводят до кипения.
2. После охлаждения в молоко наливают 1 мл раствора Люголя. Появление синей
окраски указывает на присутствие крахмала.
3. Полученные данные запишите в сводную таблицу. (Приложение 1)
5. ОПРЕДЕЛЕНИЕ НАЛИЧИЯ ПЕРОКСИДА ВОДОРОДА
Оборудование и реактивы: Пробирки, пипетки, крахмальный раствор йодида калия, серная кислота.
Пояснения к заданию. Определение основано на взаимодействии перекиси водорода с йодидом калия, в результате которого выделяется йод, дающий с крахмалом синее окрашивание.
Ход работы
1. В пробирку налейте 1 мл молока.
2. Добавьте 2 капли раствора серной кислоты и 10 капель крахмального раствора йодида калия.
3. Через 10 минут оцените окрашивание раствора. Появление синего окрашивания свидетельствует о присутствии в молоке пероксида водорода.
4. Полученные данные запишите в сводную таблицу. (Приложение 1)
Молочная кислота
| Молочная кислота | |||
|---|---|---|---|
| |||
| Систематическое наименование | 2-гидроксипропановая кислота | ||
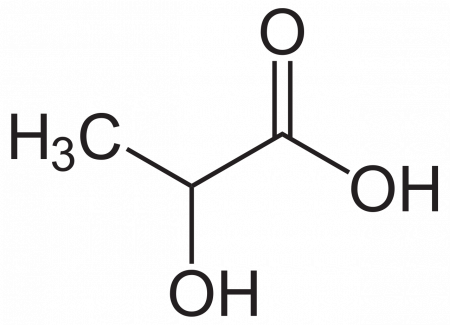
| Хим. формула | CH3CH(OH)COOH | ||
| Рац. формула | C3H6O3 | ||
| Молярная масса | 90,08 г/моль | ||
| Плотность | 1,225 г/см³ | ||
| Температура | |||
| • плавления | 18 °C | ||
| • кипения | 122 °C | ||
| Константа диссоциации кислоты pKa | 3,86 (при 25 °C) | ||
| ГОСТ | ГОСТ 490-2006 ГОСТ 490-79 | ||
| Рег. номер CAS | 50-21-5 | ||
| PubChem | 612 | ||
| Рег. номер EINECS | 200-018-0 | ||
| SMILES | |||
| Кодекс Алиментариус | E270 | ||
| ChEBI | 78320 | ||
| ChemSpider | 592 | ||
| Сигнальное слово | Опасно | ||
| Пиктограммы СГС |  | ||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
Молочная кислота (α-оксипропионовая, 2-гидроксипропановая кислота) CH3CH(OH)COOH — одноосновная карбоновая кислота с тремя атомами углерода, содержащая гидроксильную группу. Соли и эфиры молочной кислоты называются лактатами. Молочная кислота образуется при молочнокислом брожении сахаров и играет важную роль в метаболизме.
Содержание
История
Молочную кислоту открыл шведский химик Карл Шееле. В 1780 году он выделил её из прокисшего молока в виде коричневого сиропа. Французский химик Анри Браконно обнаружил, что она образуется при молочнокислом брожении.
В 1807 году Йенс Якоб Берцелиус выделил из мышц цинковую соль молочной кислоты.
Физические свойства
Молочная кислота является простейшей хиральной карбоновой кислотой и может существовать в виде двух энантиомеров: L-(+)-молочной кислоты, D-(-)-молочной кислоты или их рацемической смеси — DL-молочной кислоты. Если в смеси энантиомеров один находится в избытке, его можно выделить дробными перекристаллизациями из смеси диэтилового эфира и диизопропилового эфира. Чистые энантиомеры имеют температуру плавления 52,7-52,8 °С.
Молочная кислота очень гигроскопична и обычно существует в виде водного раствора с концентрацией до 90 мас. %. В связи с этим очень сложно установить её температуру плавления; литература приводит значения от 18 до 33 °С. Кроме того, в таких растворах присутствует значительное количество лактоилмолочной кислоты и других олигомеров молочной кислоты.
Молочная кислота растворима в воде, этаноле, диэтиловом эфире и других органических растворителях, смешивающихся с водой. Она практически нерастворима в бензоле и хлороформе.
Химические свойства
При взаимодействии с окислителями молочная кислота разлагается. При окислении кислородом воздуха или азотной кислотой в присутствии железа или меди она превращается в муравьиную кислоту, уксусную кислоту, щавелевую кислоту, уксусный альдегид, углекислый газ и пировиноградную кислоту. Молочную кислоту можно восстановить до пропионовой кислоты действием иодоводорода
Промышленный интерес представляет дегидратация молочной кислоты до акриловой кислоты и её восстановление до пропиленгликоля.
Поскольку молочная кислота является одновременно карбоновой кислотой и спиртом, она вступает в межмолекулярную этерификацию, давая лактоилмолочную кислоту. При дальнейшей конденсации образуется лактид — циклический сложный эфир. Также при конденсации могут образовываться линейные полилактиды. Эти соединения являются примесями в молочной кислоте. Так, в 6,5%-й молочной кислоте содержится около 0,2 % лактоилмолочной кислоты, 88%-я молочная кислота содержит меньше 60 % свободной молочной кислоты, а 100%-я — только 32 %.
Получение
Ферментативное получение
В промышленности молочную кислоту получают либо ферментативным способом, либо синтетическим. Первый из них имеет преимущество, поскольку приводит к молочной кислоте с более высокой стереохимической чистотой, поэтому новые производства, открывавшиеся с 1995 года, пользуются этим способом.
Во время процесса вырабатывается кислота, поэтому необходимо поддерживать pH в области 5,0–6,5: для этого используют гидроксид кальция, карбонат кальция, аммиак и гидроксид натрия. Из-за этого в процессе ферментации образуются соответствующие соли молочной кислоты. Разработка новых подходов к ферментации связана с выведением бактерий, способных работать в области низких pH: это позволило бы получать саму молочную кислоту, а не её соли, снизило бы затраты на подщелачивающие реагенты и на серную кислоту, используемую для выделения молочной кислоты из солей.
После ферментации молочную кислоту подвергают очистке. Микроорганизмы отделяют флокуляцией в щелочной среде либо ультрафильтрацией. Образовавшиеся соли молочной кислоты переводят в саму кислоту под действием серной кислоты. При этом образуется также малополезный сульфат кальция. Ведётся поиск других методов очистки, при которых образование это побочной соли не происходило бы. Для некоторых пищевых целей смесь пропускают через активированный уголь и ионообменную колонну.
Для фармацевтической промышленности и получения полимеров необходима более глубокая очистка. Интерес представляет экстракция молочной кислоты в органическую фазу длинноцепными третичными аминами, а затем обратная экстракция в воду. Этот метод позволяет эффективно очистить продукт от остаточных углеводов и белков. Также возможна перегонка молочной кислоты, если предпринимаются меры против её олигомеризации.
Выход молочной кислоты в процессе ферментации составляет 85–95 %. Побочными продуктами являются муравьиная и уксусная кислота.
Синтетическое получение
С 1960-х гг. рацемическую молочную кислоту производят в промышленности также синтетически. Подход основан на реакции ацетальдегида с циановодородом и последующем гидролизе образовавшегося лактонитрила. Недостатком синтетического подхода является то, что получаемая молочная кислота является рацемической, а подходящий и дешёвый хиральный катализатор пока не найден. Последним крупным производителем синтетической молочной кислоты является фирма «Musashino».
Экономические аспекты
Годовая потребность в молочной кислоте составляет примерно 450 тыс. тонн. Крупнейшим производителем молочной кислоты является компания NatureWorks LLC: её завод, размещённый в штате Небраска (США), имеет приблизительную мощность 180 тыс. тонн в год. Это в 3-4 раза больше, чем у следующего завода по порядку. Рынок молочной кислоты очень чувствителен к потребности в полилактиде, поскольку его производство является либо вскоре станет крупнейшим направлением использования молочной кислоты.
Молочная кислота в организме человека и животных
Молочная кислота формируется при распаде глюкозы. Иногда называемая «кровяным сахаром» глюкоза является главным источником углеводов в нашем организме. Это основной источник энергии для мозга и нервной системы, так же как и для мышц во время физической нагрузки. Когда расщепляется глюкоза, клетки производят АТФ (аденозинтрифосфат), который обеспечивает энергией большинство химических реакций в организме. Уровень АТФ определяет, как быстро и как долго мышцы смогут сокращаться при физической нагрузке.
Производство молочной кислоты не требует присутствия кислорода, поэтому этот процесс её синтеза часто называют «анаэробным метаболизмом» (см. Анаэробная тренировка). Ранее считалось, что мышцы производят молочную кислоту при нехватке кислорода в крови. Другими словами, организм находится в анаэробном состоянии. Однако современные исследования показывают, что молочная кислота образуется и в мышцах, получающих достаточно кислорода. Увеличение количества молочной кислоты в кровотоке свидетельствует лишь о том, что уровень её поступления превышает уровень удаления. Резкое увеличение (в 2—3 раза) уровня лактата в сыворотке крови наблюдается при тяжёлых расстройствах кровообращения, таких как геморрагический шок, острая левожелудочковая недостаточность и др., когда одновременно страдает и поступление кислорода в ткани, и печёночный кровоток.
Зависимое от лактата производство АТФ очень незначительно, но имеет большую скорость. Это обстоятельство делает идеальным его использование в качестве источника энергии, когда нагрузка превышает 50 % от максимальной. При отдыхе и умеренной нагрузке организм предпочитает расщеплять жиры для получения энергии. При нагрузках в 50 % от максимума (порог интенсивности для большинства тренировочных программ) организм перестраивается на преимущественное потребление углеводов. Чем больше углеводов человек использует в качестве топлива, тем больше производство молочной кислоты.
Исследования показали, что у престарелых людей в головном мозге количество солей кислоты (лактатов) имеет повышенный уровень.
Регулятор обмена
Чтобы глюкоза могла проходить через клеточные мембраны, ей необходим инсулин. Молекула же молочной кислоты в два раза меньше молекулы глюкозы, и гормональная поддержка ей не нужна — она с лёгкостью сама проходит через клеточные мембраны.
Анализ
Количественный анализ молочной кислоты обычно проводят титрованием гидроксидом натрия в присутствии фенолфталеина. Этот способ не подходит для концентрированных растворов, потому что в них молочная кислота частично находится в виде лактоилмолочной кислоты. Если такой раствор нужно оттитровать, используют приём обратного титрования: молочную кислоту обрабатывают избытком щёлочи (лактоилмолочная кислота при этом гидролизуется), а затем остаток щёлочи оттитровывают соляной кислотой.
В промышленности и исследовательских лабораториях молочную кислоту анализируют методом ВЭЖХ. Содержание энантиомерных форм в молочной кислоте можно определить ферментативным методом либо ВЭЖХ на хиральной колонке. Такие колонки, как и образцы высокочистых энантиомеров молочной кислоты коммерчески доступны.
Молочную кислоту можно обнаружить по следующим качественным реакциям:
При осторожном нагревании молочной кислоты с концентрированной серной кислотой она вначале образует уксусный альдегид и муравьиную кислоту; последняя немедленно разлагается:
CH3CH(OH)COOH → CH3CHO + HCOOH (→ H2O + CO)
Уксусный альдегид взаимодействует с n-оксидифенилом, причём, по-видимому, происходит конденсация в o-положении к OH-группе с образованием 1,1-ди(оксидифенил)этана:
В растворе серной кислоты медленно окисляется в фиолетовый продукт неизвестного состава. Поэтому, как и при обнаружении гликолевой кислоты с помощью 2,7-диоксинафталина, в данном случае происходит взаимодействие альдегида с фенолом, при котором концентрированная серная кислота действует как конденсирующий агент и окислитель. Такую же цветную реакцию дают α-оксимасляная и пировиноградная кислоты.
Выполнение реакции: В сухой пробирке нагревают в течение 2 минут на водяной бане при 85 °C каплю исследуемого раствора с 1 мл концентрированной серной кислоты. После этого охлаждают под краном до 28 °C, добавляют небольшое количество твёрдого n-оксидифенила и, перемешав несколько раз, дают постоять 10-30 минут. Фиолетовое окрашивание появляется постепенно и через некоторое время становится более глубоким. Открываемый минимум: 1,5⋅10 −6 г молочной кислоты.
Выполнение реакции: В пробирку прилить 1 мл молочной кислоты, а затем немного подкисленного серной кислотой раствора перманганата калия. Нагревать в течение 2 минут на слабом огне. Ощущается запах уксусной кислоты. C3H6O3 + [O] = C3H4O3 + H2O↑ Продуктом данной реакции может быть пировиноградная кислота C3H4O3, которая тоже имеет запах уксусной кислоты. C 3H6O3 + [O] = C3H4O3 + H2O↑ Однако пировиноградная кислота при обычных условиях неустойчива и быстро окисляется до уксусной кислоты, поэтому реакция протекает согласно суммарному уравнению: C 3H6O3 + 2[O] = CH3COOH + CO2↑ + H2O
Описание реакции: Эта реакция называется реакцией Уффельмана и используется, например, в клинической медицине для определения присутствия молочной кислоты в желудочном соке, открыта Юлиусом Уффельманом в 1880-х гг. Для проведения реакции нужно растворить одну каплю хлорида железа и 0,4 грамма фенола в 50 см 3 воды. Затем добавить тестируемую жидкость, если в ней есть молочная кислота, то синий цвет раствора сменится жёлтым, поскольку образуется лактат железа.
Применение
Молочная кислота используется преимущественно в трёх сферах: пищевой промышленности, производстве полимеров и других промышленных целях.
В пищевой промышленности молочная кислота используется как консервант и подкислитель. Благодаря тому, что её соли хорошо растворимы в воде, их также можно использовать в тех продуктах, где важно значение pH. Молочная кислота и её соли используются в напитках, конфетах, мясных изделиях и соусах. Лактат кальция добавляется в продукты как источник кальция.
В полимерной промышленности из молочной кислоты получают полилактид. Производится он из лактида полимеризацией с раскрытием цикла. Сам же лактид получают конденсацией молочной кислоты.
Также молочная кислота используется в покрытии металлов, косметике, текстильной и кожевенной промышленности. Её эфиры находят применение в производстве красок и чернил, электроники и чистке металлов.
Безопасность
Молочная кислота — это органическая карбоновая кислота, которая присутствует во многих организмах и является безопасной для окружающей среды. Увеличение производства молочной кислоты и, соответственно, полилактида оказывает положительное влияние тем, что вытесняет использование полимеров, производимых из нефти, снижает выбросы углекислого газа и предоставляет более широкие возможности по утилизации отходов.
Молочная кислота также используется в пищевой промышленности и не является токсичной. Тем не менее при попадании в глаза или на повреждённую кожу она вызывает раздражение. Полулетальная доза для крыс при оральном приёме составляет 3,73 г/кг.