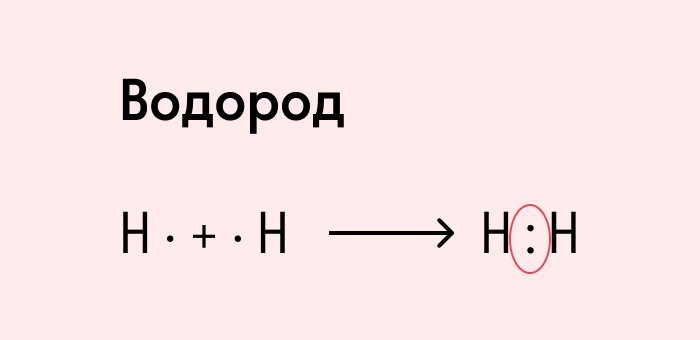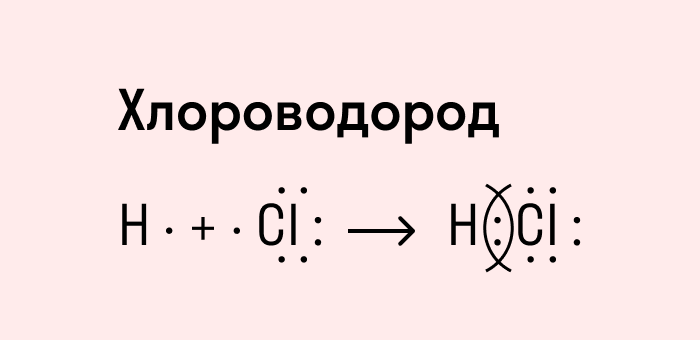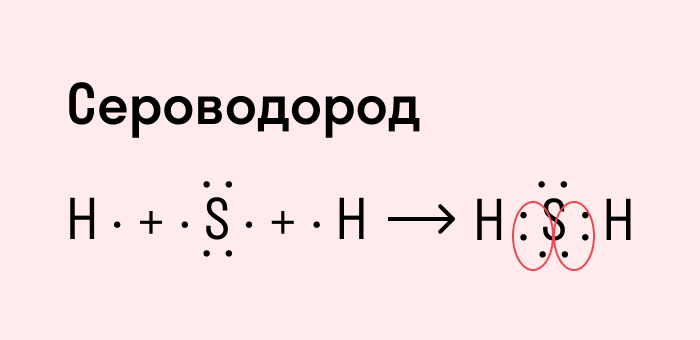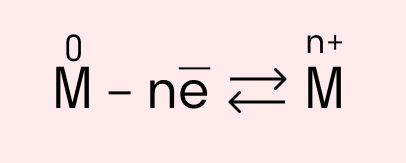какая связь в молекуле br2
Химические связи
Различают несколько типов химических связей: ковалентная, ионная, металлическая, водородная.
Ковалентная связь возникает между двумя атомами по обменному механизму (обобществление пары электронов) или донорно-акцепторному механизму (электронов донора и свободной орбитали акцептора).
Ковалентной связью соединены атомы в молекулах простых веществ (Cl2, Br2, O2), органических веществ (C2H2), а также, в общем случае, между атомами неметалла и другого неметалла (NH3, H2O, HBr).
Существует донорно-акцепторный механизм образования ковалентной связи, при котором один атом выступает в качестве донора неподеленной электронной пары. Другой атом не тратит свои электроны, а только лишь предоставляет орбиталь (ячейку) для этой электронной пары.
Ионная связь
В наиболее частом случае ионная связь образуется между типичным металлом и типичным неметаллом. Примеры:
Большой подсказкой служит таблица растворимости, ведь все соли имеют ионные связи: CaSO4, Na3PO4. Даже ион аммония не исключение, между катионом аммония и различными анионами образуются ионные связи, например в соединениях: NH4I, NH4NO3, (NH4)2SO4.
Часто в химии встречаются несколько связей внутри одной молекулы. Рассмотрим, например, фосфат аммония, обозначив тип каждой связи внутри этой молекулы.
Металлическая связь
«Облако» электронов в металлах способно приходить в движение под различным воздействием. Именно оно является причиной электропроводности металлов.
Водородная связь
Водородные связи возникают между атомом водорода и другим более электроотрицательным атомом (O, S, N, C).
Отчасти за счет водородных связей наблюдается то самое исключение, связанное с усилением кислотных свойств в ряду галогеноводородных кислот: HF → HCl → HBr → HI. Фтор является самым ЭО-ым элементов, сильно притягивает к себе атом водорода другой молекулы, что снижает способность кислоты отщеплять водород и снижает ее силу.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Химическая связь
Химическая связь и строение вещества
Все системы стремятся к равновесию и к уменьшению свободной энергии — так гласит один из постулатов химической термодинамики. Атомы, взаимодействующие в молекуле вещества, тоже подчиняются этому закону. Они стремятся образовать устойчивую конфигурацию — 8-электронную или 2-электронную внешнюю оболочку. Этот процесс взаимодействия называется химической связью, благодаря ему получаются молекулы и молекулярные соединения.
| Химическая связь — это взаимодействие между атомами в молекуле вещества, в ходе которого два электрона (по одному от каждого атома) образуют общую электронную пару либо электрон переходит от одного атома к другому. |
Как понятно из определения химической связи, при взаимодействии двух атомов один из них может притянуть к себе внешние электроны другого. Эта способность называется электроотрицательностью (ЭО). Атом с более высокой электроотрицательностью (ЭО) при образовании химической связи с другим атомом может вызвать смещение к себе общей электронной пары.
Механизм образования химической связи
Существует два механизма взаимодействия атомов:
обменный — предполагает выделение по одному внешнему электрону от каждого атома и соединение их в общую пару;
донорно-акцепторный — происходит, когда один атом (донор) выделяет два электрона, а второй атом (акцептор) принимает их на свою свободную орбиталь.
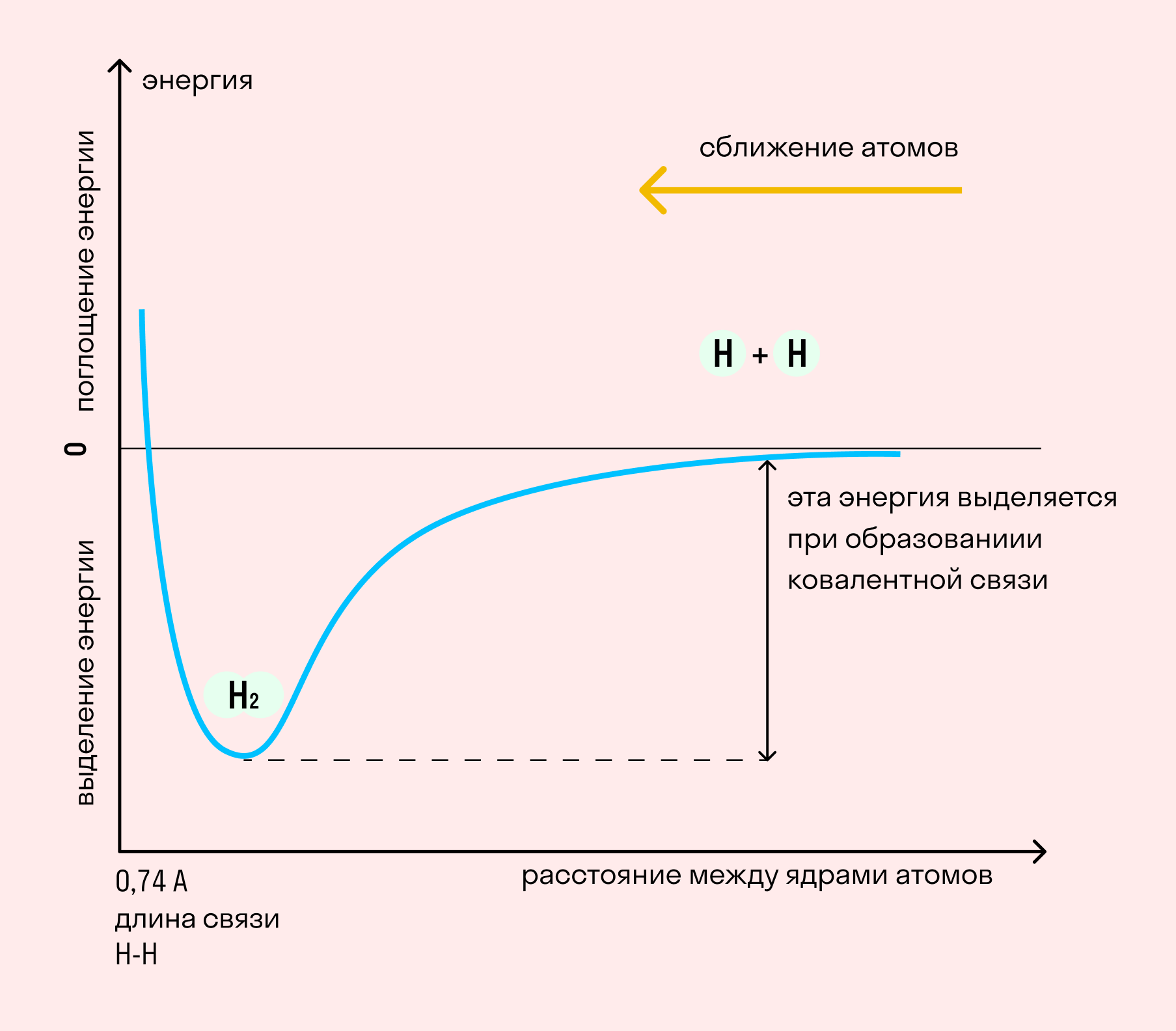
Независимо от механизма химическая связь между атомами сопровождается выделением энергии. Чем выше ЭО атомов, т. е. их способность притягивать электроны, тем сильнее и этот энергетический всплеск.
| Энергией связи называют ту энергию, которая выделяется при взаимодействии атомов. Она определяет прочность химической связи и по величине равна усилию, необходимому для ее разрыва. |
Также на прочность влияют следующие показатели:
Длина связи — расстояние между ядрами атомов. С уменьшением этого расстояния растет энергия связи и увеличивается ее прочность.
Кратность связи — количество электронных пар, появившихся при взаимодействии атомов. Чем больше это число, тем выше энергия и, соответственно, прочность связи.
На примере химической связи в молекуле водорода посмотрим, как меняется энергия системы при сокращении расстояния между ядрами атомов. По мере сближения ядер электронные орбитали этих атомов начинают перекрывать друг друга, в итоге появляется общая молекулярная орбиталь. Неспаренные электроны через области перекрывания смещаются от одного атома в сторону другого, возникают общие электронные пары. Все это сопровождается нарастающим выделением энергии. Сближение происходит до тех пор, пока силу притяжения не компенсирует сила отталкивания одноименных зарядов.
Основные типы химических связей
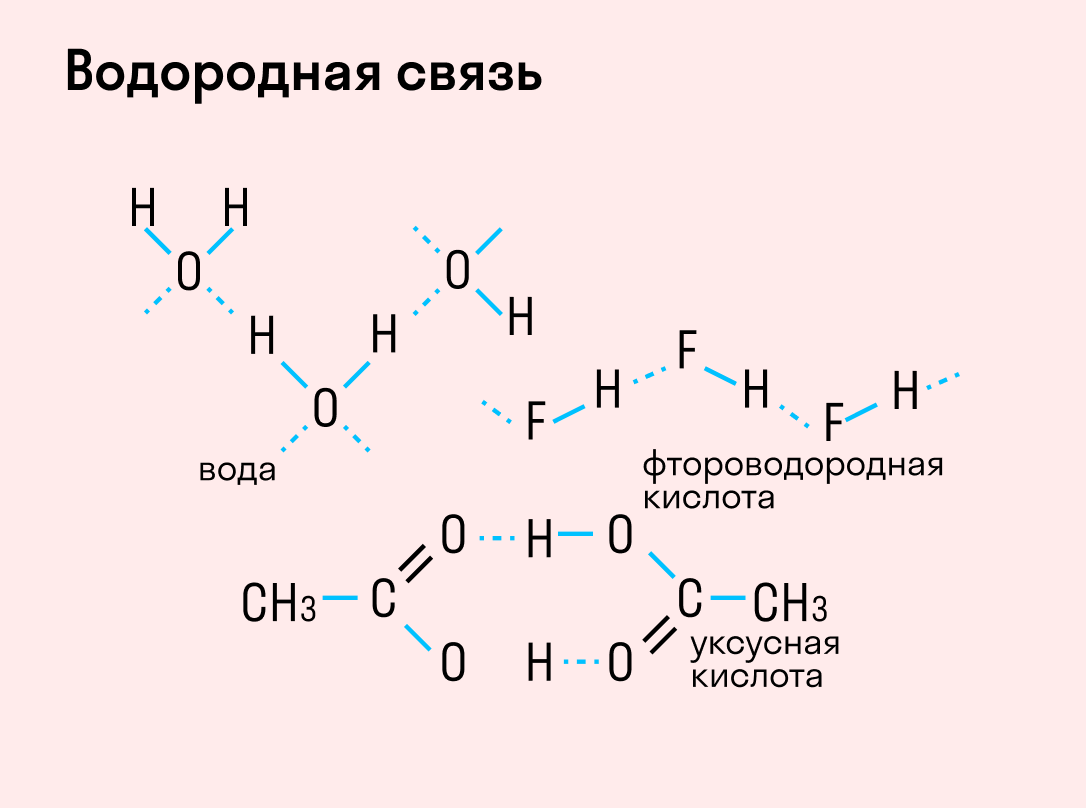
Различают четыре вида связей в химии: ковалентную, ионную, металлическую и водородную. Но в чистом виде они встречаются редко, обычно имеет место наложение нескольких типов химических связей. Например, в молекуле фосфата аммония (NH4)3PO4присутствует одновременно ионная связь между ионами и ковалентная связь внутри ионов.
Также отметим, что при образовании кристалла от типа связи между частицами зависит, какой будет кристаллическая решетка. Если это ковалентная связь — образуется атомная решетка, если водородная — молекулярная решетка, а если ионная или металлическая — соответственно, будет ионная или металлическая решетка. Таком образом, влияя на тип кристаллической решетки, химическая связь определяет и физические свойства вещества: твердость, летучесть, температуру плавления и т. д.
Основные характеристики химической связи:
насыщенность — ограничение по количеству образуемых связей из-за конечного числа неспаренных электронов;
полярность — неравномерная электронная плотность между атомами и смещение общей пары электронов к одному из них;
направленность — ориентация связи в пространстве, расположение орбиталей атомов под определенным углом друг к другу.
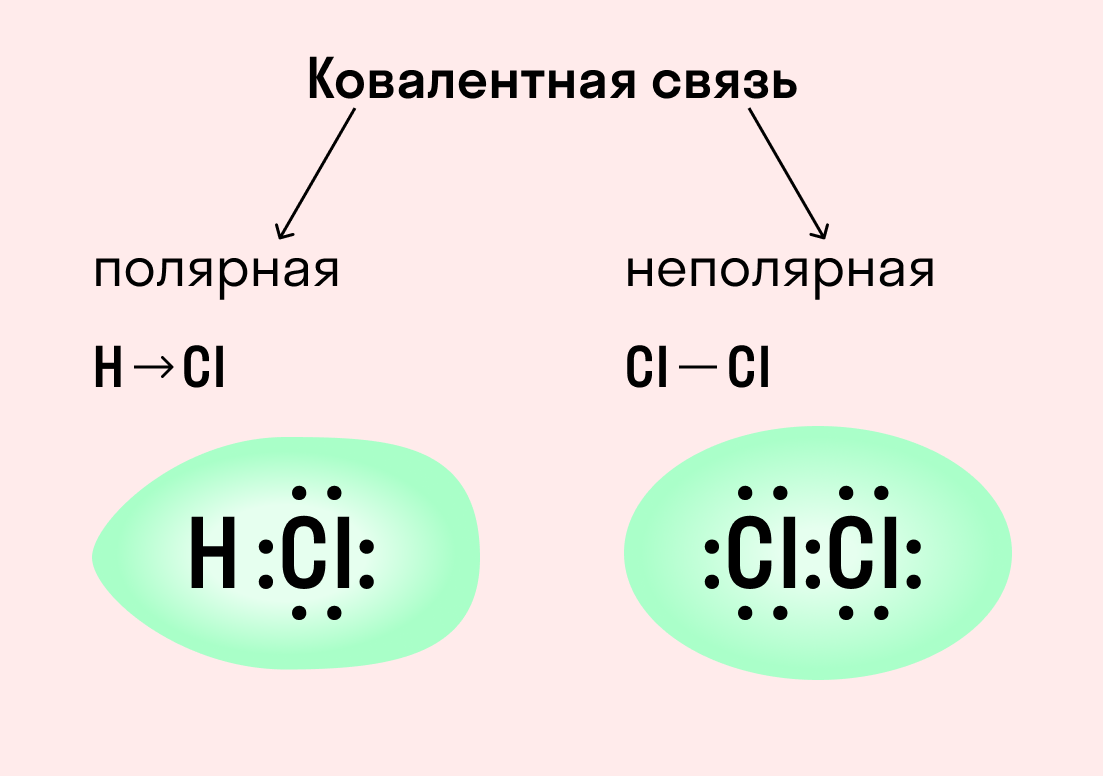
Ковалентная связь
Как уже говорилось выше, этот тип связи имеет два механизма образования: обменный и донорно-акцепторный. При обменном механизме объединяются в пару свободные электроны двух атомов, а при донорно-акцепторном — пара электронов одного из атомов смещается к другому на его свободную орбиталь.
| Ковалентная связь — это процесс взаимодействия между атомами с одинаковыми или близкими радиусами, при котором возникает общая электронная пара. Если эта пара принадлежит в равной мере обоим взаимодействующим атомам — это неполярная связь, а если она смещается к одному из них — это полярная связь. |
Как вы помните, сила притяжения электронов определяется электроотрицательностью атома. Если у двух атомов она одинакова, между ними будет неполярная связь, а если один из атомов имеет большую ЭО — к нему сместится общая электронная пара и получится полярная химическая связь.
Ковалентная неполярная связь образуется в молекулах простых веществ, неметаллов с одинаковой ЭО: Cl2, O2, N2, F2 и других.
Посмотрим на схему образования этой химической связи. У атомов водорода есть по одному внешнему электрону, которые и образуют общую пару.
Ковалентная полярная связь характерна для неметаллов с разным уровнем ЭО: HCl, NH3,HBr, H2O, H2S и других.
Посмотрим схему такой связи в молекуле хлороводорода. У водорода имеется один свободный электрон, а у хлора — семь. Таким образом, всего есть два неспаренных электрона, которые соединяются в общую пару. Поскольку в данном случае ЭО выше у хлора, эта пара смещается к нему.
Другой пример — молекула сероводорода H2S. В данном случае мы видим, что каждый атом водорода имеет по одной химической связи, в то время как атом серы — две. Количество связей определяет валентность атома в конкретном соединении, поэтому валентность серы в сероводороде — II.
Число связей, которые могут быть у атома в молекуле вещества, называется валентностью.
Характеристики ковалентной связи:
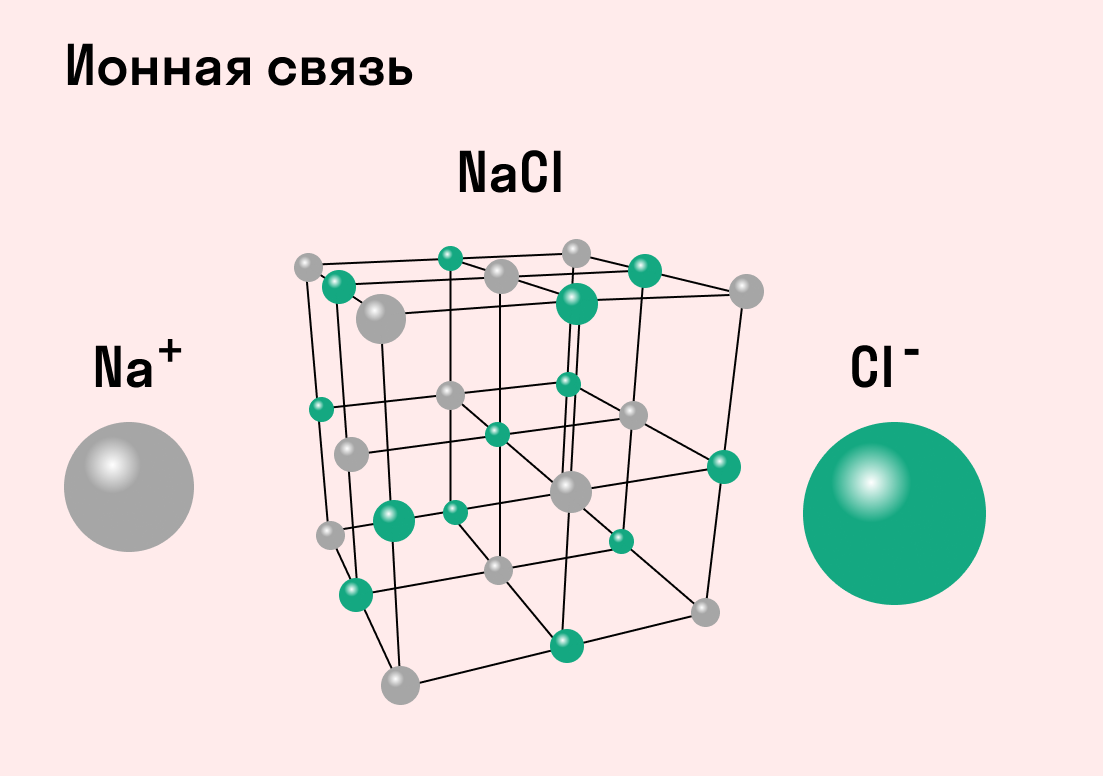
Ионная связь
Как понятно из названия, данный тип связи основан на взаимном притяжении ионов с противоположными зарядами. Он возможен между веществами с большой разницей ЭО — металлом и неметаллом. Механизм таков: один из атомов отдает свои электроны другому атому и заряжается положительно. Второй атом принимает электроны на свободную орбиталь и получает отрицательный заряд. В результате этого процесса образуются ионы.
| Ионная связь — это такое взаимодействие между атомами в молекуле вещества, итогом которого становится образование и взаимное притяжение ионов. |
Разноименно заряженные ионы стремятся друг к другу за счет кулоновского притяжения, которое одинаково направлено во все стороны. Благодаря этому притяжению образуются ионные кристаллы, в решетке которых заряды ионов чередуются. У каждого иона есть определенное количество ближайших соседей — оно называется координационным числом.
Обычно ионная связь появляется между атомами металла и неметалла в таких соединениях, как NaF, CaCl2, BaO, NaCl, MgF2, RbI и других. Ниже схема ионной связи в молекуле хлорида натрия.
Характеристики ионной связи:
не имеет направленности.
Ковалентная и ионная связь в целом похожи, и одну из них можно рассматривать, как крайнее выражение другой. Но все же между ними есть существенная разница. Сравним эти виды химических связей в таблице.
Характеризуется появлением электронных пар, принадлежащих обоим атомам.
Характеризуется появлением и взаимным притяжением ионов.
Общая пара электронов испытывает притяжение со стороны обоих ядер атомов.
Ионы с противоположными зарядами подвержены кулоновскому притяжению.
Имеет направленность и насыщенность.
Ненасыщенна и не имеет направленности.
Количество связей, образуемых атомом, называется валентностью.
Количество ближайших соседей атома называется координационным числом.
Образуется между неметаллами с одинаковой или не сильно отличающейся ЭО.
Образуется между металлами и неметаллами — веществами со значимо разной ЭО.
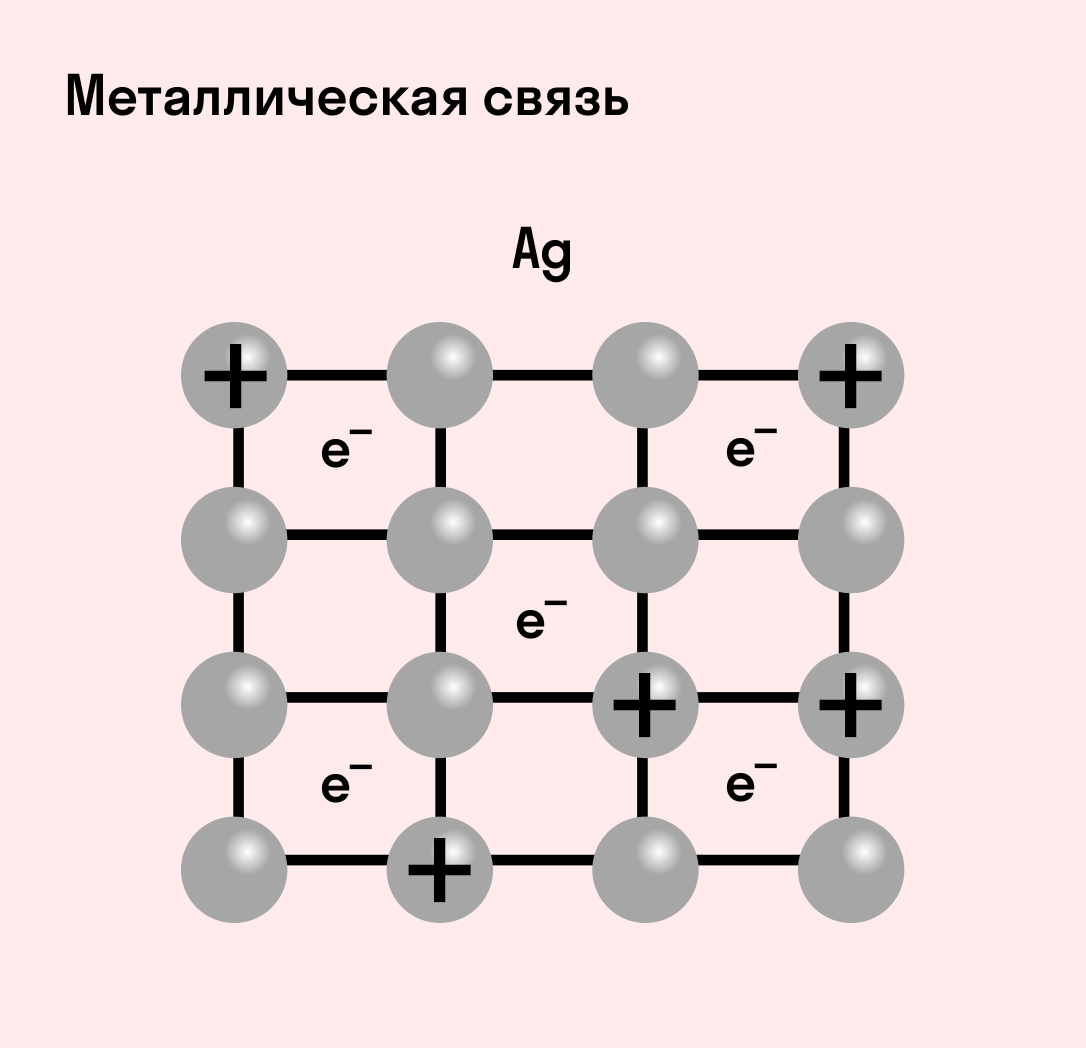
Металлическая связь
Отличительная особенность металлов в том, что их атомы имеют достаточно большие радиусы и легко отдают свои внешние электроны, превращаясь в положительно заряженные ионы (катионы). В итоге получается кристаллическая решетка, в узлах которой находятся ионы, а вокруг беспорядочно перемещаются электроны проводимости, образуя «электронное облако» или «электронный газ».
Свободные электроны мигрируют от одного иона к другому, временно соединяясь с ними и снова отрываясь в свободное плавание. Этот механизм по своей природе имеет сходство с ковалентной связью, но взаимодействие происходит не между отдельными атомами, а в веществе.
| Металлическая связь — это взаимодействие положительных ионов металлов и отрицательно заряженных электронов, которые являются частью «электронного облака», рассеянного по всему объему вещества. |
Наличие такого «электронного облака», которое может прийти в направленное движение, обусловливает электропроводность металлов. Другие их качества — пластичность и ковкость, объясняются тем, что ионы в кристаллической решетке легко смещаются. Поэтому металл при ударном воздействии способен растягиваться, но не разрушаться.
Характеристики металлической связи:
Металлическая связь присуща как простым веществам — таким как Na, Ba, Ag, Cu, так и сложным сплавам — например, AlCr2, CuAl11Fe4, Ca2Cu и другим.
Схема металлической связи:
M — металл,
n — число свободных внешних электронов.
К примеру, у железа в чистом виде на внешнем уровне есть два электрона, поэтому его схема металлической связи выглядит так:
Обобщим все полученные знания. Таблица ниже описывает кратко химические связи и строение вещества.
Типы химической связи и их основные отличительные признаки
Водородная связь
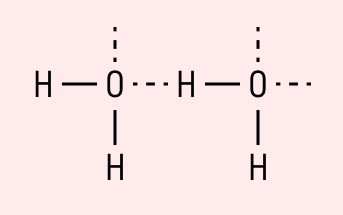
Данный тип связи в химии стоит отдельно, поскольку он может быть как внутри молекулы, так и между молекулами. Как правило, у неорганических веществ эта связь происходит между молекулами.
| Водородная связь образуется между молекулами, содержащими водород. Точнее, между атомами водорода в этих молекулах и атомами с большей ЭО в других молекулах вещества. |
Объясним подробнее механизм этого вида химической связи. Есть молекулы А и В, содержащие водород. При этом в молекуле А есть электроотрицательные атомы, а в молекуле В водород имеет ковалентную полярную связь с другими электроотрицательными атомами. В этом случае между атомом водорода в молекуле В и электроотрицательным атомом в молекуле А образуется водородная связь.
Такое взаимодействие носит донорно-акцепторный характер. Донором электронов в данном случае выступают электроотрицательные элементы, а акцептором — водород.
Графически водородная связь обозначается тремя точками. Ниже приведена схема такого взаимодействия на примере молекул воды.
Характеристики водородной связи:
Кратко о химических связях
Итак, самое главное. Химической связью называют взаимодействие атомов, причиной которого является стремление системы приобрести устойчивое состояние. Во время взаимодействия свободные внешние электроны атомов объединяются в пары либо внешний электрон одного атома переходит к другому.
Образование химической связи сопровождается выделением энергии. Эта энергия растет с увеличением количества образованных электронных пар и с сокращением расстояния между ядрами атомов.
Основные виды химических связей: ковалентная (полярная и неполярная), ионная, металлическая и водородная. В отличие от всех остальных водородная ближе к молекулярным связям, поскольку может быть как внутри молекулы, так и между разными молекулами.
Как определить тип химической связи:
Ковалентная полярная связь образуется в молекулах неметаллов между атомами со сходной ЭО.
Ковалентная неполярная связь имеет место между атомами с разной ЭО.
Ионная связь ведет к образованию и взаимному притяжению ионов. Она происходит между атомами металла и неметалла.
Металлическая связь бывает только между атомами металлов. Это взаимодействие положительных ионов в кристаллической решетке и свободных отрицательных электронов. Масса рассеянных по всему объему свободных электронов представляет собой «электронное облако».
Водородная связь появляется при условии, что есть атом с высокой ЭО и атом водорода, связанный с другой электроотрицательной частицей ковалентной связью.
Химическая связь и строение молекулы: типом химической связи определяется кристаллическая решетка вещества: ионная, металлическая, атомная или молекулярная.
Определить тип химической связи в 8 классе поможет таблица.
Типы химической связи.
Ионная связь
Являяcь многие годы вашим подписчиком, всегда с интересом знакомлюсь с публикациями разработок уроков, внеклассных мероприятий, дидактических материалов. Из многих публикаций удается почерпнуть интересные идеи, на основе которых разрабатываю собственные уроки.
Имея возможность самостоятельно определять последовательность изучения материала в курсе химии, после изучения темы «Периодический закон и периодическая система химических элементов Д.И.Менделеева на основе строения атомов» считаю необходимым изучение материала по теме «Строение вещества». Рассмотрение темы «Строение вещества» в 8-м классе позволяет на более глубоком уровне изучать последующие темы курса, например «Галогены», «Щелочные металлы» и др.
Предлагаю вашему вниманию разработку урока по теме «Ионная связь». Урок построен таким образом, чтобы учащиеся, повторив ранее изученный материал, успешно освоили новый. Надеюсь, что разработка урока будет полезна коллегам – учителям химии, позволит сделать уроки интересными, организовать самостоятельную творческую работу ребят.
Задачи урока. Образовательные: повторение, коррекция и закрепление знаний по теме «Строение атомов»; закрепление понятий «электроотрицательность», «ковалентная полярная связь» и «ковалентная неполярная связь»; введение понятий «ионы», «ионная связь»; изучение нового типа химической связи – ионной связи, ее природы и условий образования; обучение навыкам сравнения схем строения нейтральных атомов и ионов.
Развивающие: развитие навыков составления электронных схем образования химических связей, соединений с ионным типом связи и определения количества электронов в ионах; развитие умений определения типа связи на основании анализа состава химического соединения.
Оборудование. Периодическая система химических элементов, карточки с формулами веществ (H2O, Br2, CO2, O3, HCl, HNO3, P4, CS2, H2SO4, S8), раздаточные материалы, цветные сигнальные карточки с цифрами: красная – 1, синяя – 2, фиолетовая – 3.
Тип урока. Комбинированный (80 мин.)
Повторение ранее изученного материала
Учитель. Сегодня нам с вами предстоит покорить одну из важнейших вершин науки химии – вершину «Химическая связь». Чтобы начать восхождение, нужно к нему подготовиться, собрать рюкзаки, в которые сложить все необходимые знания. Для начала посмотрим, как вы это делаете самостоятельно.
Собираем рюкзаки. Учащимся предлагается выполнить самостоятельную работу с последующей самопроверкой. Самостоятельная работа решает задачу актуализации знаний, играет роль входной диагностики (определение готовности учащихся к дальнейшей работе по теме).
Задание учащиеся получают на карточках. Два ученика с хорошим уровнем подготовки работают за отдельным столом, выполняя работу маркерами на листах формата А4. По окончании работы они вывешивают их на доску. Два хорошо подготовленных ученика комментируют выполненную работу, отвечают на уточняющие вопросы учителя и одноклассников. Остальные ученики класса проверяют свою работу самостоятельно, по ходу комментирования.
Ученики, выполнившие работу и прокомментировавшие ее, получают оценки.
Задание 1. По электронной формуле определите положение элемента в периодической системе, назовите его.
Задание 3. Определите количество электронов на внешнем уровне в атомах.
В а р и а н т I. Cl, K, P.
В а р и а н т II. Ca, S, F.
Задание 4. Определите, сколько электронов не хватает каждому атому до завершения внешнего уровня.
В а р и а н т I. C, S, Cl.
В а р и а н т II. O, P, I.
Задание 5. Закончите предложение.
В а р и а н т I. Электронная формула 1s 2 2s 2 2p 6 3s 2 3p 4 соответствует атому серы. Элемент находится в 3-м периоде в VI группе.
В а р и а н т II. Электронная формула 1s 2 2s 1 соответствует атому лития. Элемент находится во 2-м периоде в I группе.
2. На основании положения элементов в периодической системе расположите их в порядке возрастания электроотрицательности их атомов:
а) S, Cl, O, K; б) F, P, Сa, N.
2. На основании положения элементов в периодической системе расположите их в порядке возрастания электроотрицательности их атомов: а) Cl, I, Li, Al; б) C, N, Si, Ba.
2-я группа. Учащиеся, допустившие ошибки, составляют рассказ, заполняя пропуски предложенными словами и фразами. В случае затруднения пользуются учебником, записями в тетради.
Ц е л ь. Повторение, коррекция и закрепление знаний.
С л о в а и ф р а з ы:
1) между атомами одного химического элемента-неметалла,
2) число электронов на внешнем уровне элементов главных подгрупп,
4) порядковому номеру элемента,
5) восемь электронов,
7) количеству энергетических уровней,
8) между разными атомами химических элементов-неметаллов.
1-я группа сдает работы на проверку учителю, оценки будут объявлены на следующем уроке.
2-я группа проверяет свои работы при прослушивании ответа одного из учеников. При необходимости даются пояснения.
Электронные схемы образования.
2. На основании положения элементов в периодической системе электроотрицательность возрастает в следующем порядке: а) K, S, Cl, O; б) Ca, P, N, F.
1. Электронные формулы соответствуют а) 1s 2 2s 2 2p 6 3s 2 3p 4 – атому серы; б) 1s 1 – атому водорода. Эти элементы образуют следующие соединения: S2, H2, Н2S. В молекулах S2, H2 – ковалентная неполярная связь; в молекуле Н2S – ковалентная полярная связь.
Электронные схемы образования.
S2 * :
2. На основании положения элементов в периодической системе электроотрицательность возрастает в следующем порядке: а) Li, Al, I, Cl; б) Ba, Si, C, N.
В периодической системе элементы расположены по группам и периодам. Общее количество электронов в атоме равно порядковому номеру элемента. Номер периода соответствует количеству энергетических уровней. Номер группы показывает число электронов на внешнем уровне для элементов главных подгрупп. Завершенный внешний уровень содержит восемь электронов.
Электроотрицательность – это способность атомов притягивать к себе электроны от других атомов. В периодах слева направо электроотрицательность увеличивается, в главных подгруппах сверху вниз – уменьшается.
Ковалентная неполярная связь образуется между атомами одного химического элемента-неметалла. Ковалентная полярная связь образуется между разными атомами химических элементов-неметаллов.
Учитель. Итак, рюкзаки собраны, начинаем наше восхождение. Однако в пути нас поджидают препятствия. И первое препятствие – «водопад» веществ.
На доске картина с изображением водопада. На водопаде прикреплены карточки с химическими формулами: H2O, Br2, CO2, O3, HCl, HNO3, P4, CS2, H2SO4, S8.
Задание. Чтобы преодолеть водопад, предлагается распределить вещества по типам химической связи.
В а р и а н т I. Выписать в тетрадь вещества с ковалентной полярной связью.
В а р и а н т II. Выписать вещества с ковалентной неполярной связью.
Проверка осуществляется фронтально.
Учитель. Замечательно, мы успешно преодолели водопад, но впереди нас поджидает новое препятствие. На узкой горной тропе образовался «завал» из электронных схем.
Задание. Определить, какая из схем правильно отражает механизм образования химической связи.
В а р и а н т I. OF2
В а р и а н т II. BCl3
Электронные схемы написаны на обратной стороне доски. У каждого учащегося три цветные сигнальные карты с номерами. Учащиеся поднимают карточки с номером правильного ответа. Если допущены ошибки, проводится коррекционная работа.
Учитель. Молодцы, нам удалось пройти по узкой горной тропе, и мы продолжаем восхождение. Внимание! Впереди возникла пещера. Любопытные альпинисты обнаружили в ней интересную находку – ларчик и загадочное письмо.
Продолжить путешествие мы сможем только тогда, когда отгадаем, что находится в этом ларчике. Что ж, давайте остановимся на привал и прочитаем письмо.
На столе учителя «ларчик», запечатанный сургучной печатью. Рядом с ним свернутое письмо. Ученику предлагается прочитать письмо.
Ученик (читает текст письма). Из вещества, спрятанного в этой коробке, можно получить металл, который легко режется ножом, мнется как пластилин и хранится только под слоем керосина. Из него можно также получить удушливый и ядовитый газ желто-зеленого цвета, который используют для обеззараживания воды. Но обычно мы используем это вещество иначе. Оно в каждом доме, на каждом столе. В древние времена говорили, что оно дороже золота, поскольку без золота можно прожить, а без него нельзя. По русскому обычаю дорогих гостей встречают этим веществом, тем самым желают им здоровья, а просыпать его – значит потерять здоровье, потерпеть неудачу.
Учитель. О каком таинственном веществе идет речь в письме? Какие вещества из него получают?
Учащиеся угадывают вещество, дают ему химическое название – поваренная соль, хлорид натрия. Указывают, что из него можно получить металлический натрий и газообразный хлор. Из «ларчика» достается образец минерала, показывается учащимся.
Учитель. Какое отношение это вещество имеет к нашему уроку?
Ученик. Поскольку мы изучаем тему «Химическая связь», то необходимо выяснить, как она образуется между атомами в хлориде натрия и к какому типу ее следует отнести.
Изучение нового материала
Учитель. Молодцы. Цель нашего урока – познакомиться с новым типом химической связи – ионной, выяснить ее природу и условия образования. Мы научимся строить электронные схемы образования соединений с ионным типом химической связи, определять общее количество электронов в ионах.
Тема урока и формула поваренной соли записываются в тетрадь.
Учитель. Рассмотрим на примере хлорида натрия образование ионной связи. Запишем уравнение, отражающее взаимодействие атомов натрия и хлора:
Составьте самостоятельно в тетрадях схемы строения атомов натрия и хлора. Определите число спаренных и неспаренных электронов на последнем уровне в атомах.
Na +11 
Атомы натрия и хлора имеют по одному неспаренному электрону. При сближении этих атомов до определенного расстояния происходит перекрывание электронных облаков неспаренных электронов и образуется общее для двух атомов электронное облако. Но поскольку электроотрицательность хлора намного больше, чем натрия, то общая электронная пара полностью смещается к атому хлора. В результате перехода электрона от атома натрия к атому хлора появляются противоположно заряженные частицы: атом хлора приобретает отрицательный заряд, атом натрия – положительный.
(Вводится понятие «ион», «ионная связь», определения записываются в тетрадь.)
Частицы, которые образуются в результате перехода электронов от одного атома к другому, называются ионами.
Заряд иона определяется количеством отданных или принятых электронов. Отрицательно заряженный ион заключается в квадратные скобки.
Химическая связь, которая возникает между ионами в результате электростатического взаимодействия, называется ионной.
Давайте рассмотрим схемы строения ионов натрия и хлора и определим общее количество электронов в каждом ионе:
Na 1+ +11 
Cl 1– +17 
Проверим наши главные выводы.
• Ионы – это заряженные частицы, в которые превратились атомы в результате отдачи или присоединения электронов.
• Связь, которая возникает в результате электростатического взаимодействия между ионами, называется ионной.
• Ионная связь возникает между атомами металлов и неметаллов, электороотрицательность которых сильно отличается (более чем на две единицы). Ионная связь – это крайний случай ковалентной полярной связи.
В пути наш багаж знаний пополнился. Продолжим движение к вершине. Но неожиданно возникает новая преграда. Впереди густые «заросли» из химических формул, через которые можно пробраться, если удалить вещества с ионным типом химической связи.
На доске написаны формулы:
Учащимся предлагается выписать в тетрадь соединения с ионным типом связи.
Проверка фронтальная. Один ученик зачитывает формулы, которые записал в тетрадь, остальные ученики – проверяют. Учителем даются пояснения по веществам, состоящим из трех химических элементов и имеющим два вида связи.
Учитель. Нам удалось проложить тропинку сквозь густые заросли, мы очень близки к цели. Давайте соберем все наши знания и поднимемся на вершину.
Под руководством учителя закрепляется умение составлять схемы образования ионной связи, определять заряды ионов, количество электронов в ионах на примере соединений: а) KF; б) Na2S; в) BeO.
Далее учащиеся выполняют подобную работу самостоятельно, выбрав из предложенных формул две любые: а) LiBr; б) CaCl2; в) MgS; г) Мg3N2*. Одновременно у доски работают три ученика. Задание со звездочкой (*) на данном уроке не объясняется и не проверяется, объяснение будет дано на заседании химического кружка.
Проверка результатов проводится фронтально.
Учитель. Мы проделали трудный, но интересный путь, вершина «Химическая связь» покорена. Я поздравляю вас, вы приложили много усилий, чтобы ее достичь, показали ваши знания, проявили находчивость, были дружными, помогали друг другу в трудный момент. А теперь пора в обратный путь.
Учащимся предлагается выполнить проверочную работу. Ц е л ь: оперативный контроль знаний. Результаты выполнения будут использованы при планировании индивидуальной коррекционной работы с учащимися.
1. Определите количество электронов на внешнем уровне в атомах.
В а р и а н т I. F, B, Ca.
В а р и а н т II. Se, Al, C.
2. Укажите количество электронов, которое примет атом для завершения своего внешнего уровня.
В а р и а н т I. S, P, Si.
В а р и а н т II. F, N, O.
3. Укажите тип химической связи в соединениях.
4. Составьте электронные схемы образования химической связи, укажите заряды ионов и определите количество электронов в каждом виде атомов и ионов.
В а р и а н т I. а) KBr; б) AlCl3.
В а р и а н т II. а) MgI2; б) NaBr.
5*. Проанализируйте рисунок и впишите недостающие формулы.
В а р и а н т I. F – 7, B – 3, Ca – 2.
В а р и а н т II. Se – 6, Al – 3, C – 4.
В а р и а н т I. S – 2, P – 3, Si – 4.
В а р и а н т II. F – 1, N – 3, O – 2.
В а р и а н т I. В соединениях: CH4 – ковалентная полярная химическая связь, K2O – ионная связь, F2 – ковалентная неполярная связь.
В а р и а н т II. В соединениях: PCl3 – ковалентная полярная связь, O3 – ковалентная неполярная связь, Al2O3 – ионная связь.
а) Для KBr:
| Атом | Количество электронов | Ион | Количество электронов |
| Al 0 | 13 | Al 3+ | 10 |
| Cl 0 | 17 | Cl 1– | 18 |
| K 0 | 19 | K 1+ | 18 |
| Br 0 | 35 | Br 1– | 36 |
а) Для MgF2:
б) Для NaBr:
| Атом | Количество электронов | Ион | Количество электронов |
| Mg 0 | 12 | Mg 2+ | 10 |
| I 0 | 53 | I 1– | 54 |
| Na 0 | 11 | Na 1+ | 10 |
| Br 0 | 35 | Br 1– | 36 |
Задание 5* (рассматривается на заседании химического кружка).
Ответы могут быть следующие: KCl, KH, Na2O, NaCl (могут быть и другие соединения металлов с приведенными в центральной части рисунка неметаллами, т.е. соединения с ионной связью).
Домашнее задание. Гузей Л.С. Химия. Вопросы. Задачи. Упражнения. 8–9 классы. § 18.3, упр. 1, 2, 3 – письменно.
* Двухатомные молекулы S2 образуются при нагревании паров серы до высокой температуры. – Прим. ред.