какая связь в перекиси водорода
Пероксид водорода
Из Википедии — свободной энциклопедии
наименование
(при 20 °C)

Перокси́д водоро́да (пе́рекись водоро́да), H2O2 — простейший представитель пероксидов. Бесцветная жидкость с «металлическим» вкусом, неограниченно растворимая в воде, спирте и эфире. Концентрированные водные растворы взрывоопасны. Пероксид водорода является хорошим растворителем. Из воды выделяется в виде неустойчивого кристаллогидрата H2O2∙2H2O.
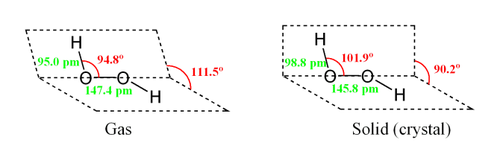
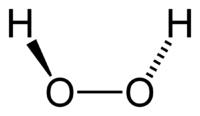
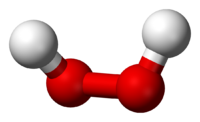
Молекула пероксида водорода имеет следующее строение:
Вследствие несимметричности молекула H2O2 сильно полярна (μ = 0,7⋅10 −29 Кл·м). Относительно высокая вязкость жидкого пероксида водорода обусловлена развитой системой водородных связей. Поскольку атомы кислорода имеют неподелённые электронные пары, молекула H2O2 также способна образовывать донорно-акцепторные связи.
Перекись водорода Н2О2
Более устойчивыми являются водные растворы перекиси водорода, которые в прохладном месте могут сохраняться довольно долго. Нагревание и свет сильно ускоряют процесс разложения: из раствора начинают выделяться пузырьки кислорода и в конце концов остается чистая вода.
Разложение перекиси водорода ускоряется также различными катализаторами. Если, например, в пробирку с раствором перекиси водорода бросить немного двуокиси марганца МnO2, то происходит бурная реакция и из пробирки выделяется кислород. В то же время некоторые вещества замедляют разложение перекиси водорода. К числу их относятся, например, некоторые соли фосфорной кислоты.
Перекиси водорода
Перекись водорода образуется в качестве промежуточного продукта при горении водорода, но ввиду высокой температуры водородного пламени тотчас же разлагается на воду и кислород. Однако если направить водородное пламя на кусок льда, то в образующейся воде можно обнаружить следы перекиси водорода.
Перекись водорода получается также при действии атомарного водорода на обыкновенный (молекулярный) кислород.
При образовании перекиси водорода из атомарного водорода и кислорода атомы водорода связываются ковалентно с атомами кислорода, входящими в состав его молекул, причем двойная связь между атомами кислорода переходит в простую, как видно из следующей схемы:
Поэтому обыкновенную структурную формулу перекиси водорода, в которой связи показаны черточками, изображают так:
Эта формула не дает, однако, представления о пространственной структуре молекул Н2O2, в которых связи атомов водорода с атомами кислорода образуют со связью между атомами кислорода угол около 100°, вследствие чего молекулы перекиси водорода обладают значительной полярностью.
В молекуле перекиси водорода Н2O2 атомы кислорода связаны между собой неполярной ковалентной связью, тогда как. связи между атомами водорода и кислорода (вследствие смещения общих электронов в сторону кислорода) полярны. Поэтому в водном растворе, под влиянием полярных молекул воды, перекись водорода может отщеплять ионы водорода.
Перекись водорода может быть получена рядом способов^ Долгое время основным способом ее получения являлось действие разбавленной серной кислоты на перекись бария ВаO2 или: натрия Na2O2:
В настоящее время, в связи с разработкой методов электрохимического получения перекиси водорода, этот способ утратил свое-значение.
Электрохимические методы получения Н2O2 позволяют получать чистые и высококонцентрированные (85—90%-ные) растворы перекиси водорода, отличающиеся большой стабильностью.
С некоторыми основаниями перекись водорода непосредственно вступает в реакцию обмена, образуя соли. Так, при действии перекиси водорода на водный раствор гидрата окиси бария выпадает осадок бариевой соли перекиси водорода:
Соли перекиси водорода называются перекисями. Как и другие соли, они состоят из положительно и отрицательно заряженных ионов, причем отрицательно заряженными ионами в данном случае являются ионы O2 —
При действии кислот на перекиси снова получается перекись водорода и соль соответствующей кислоты. Таким образом, приведенная выше реакция получения перекиси водорода из ВаО2
представляет собой не что иное, как вытеснение слабой кислоты из ее соли сильной кислотой.
Наиболее характерным химическим свойством перекиси водорода является ее резко выраженная окислительная способность, благодаря которой перекись водорода может окислять очень многие вещества. В качестве примера рассмотрим реакцию окисления йодистого калия, сопровождающуюся выделением иода:
или в ионной форме
Так как молекулы Н2O2 могут отщеплять в водном растворе ионы О2«, то происходящий процесс можно рассматривать как окисление ионов иода J’ ионами О2«:
В этом случае ион O2» является восстановителем. Отдавая два электрона атомам хлора, сам он превращается в электронейтральную молекулу O2.
На окислительных свойствах перекиси водорода основано ее довольно обширное практическое применение. Действуя окисляющим образом на различные красящие вещества, она является прекрасным средством для отбеливания тканей, соломы и других материалов; разрушая красящие вещества, перекись водорода почти не затрагивает отбеливаемый материал.
Перекись водорода применяется также для обновления старых картин, написанных масляными красками и потемневших от времени вследствие превращения свинцовых белил в черный сульфид свинца под действием содержащихся в воздухе следов сероводорода.
При промывании картин перекисью водорода черный сульфид свинца окисляется в белый сульфат свинца:
Высококонцентрированная (85—90%-вая) перекись водорода в смеси с некоторыми горючими материалами используется для получения взрывчатых составов. Слабый (обычно 3%-ный) раствор перекиси водорода применяется в медицине как дезинфицирующее средство для промывания ран, для полоскания горла и т. п.
При промывании картин перекисью водорода черный сульфид свинца окисляется в белый сульфат свинца:
Высококонцентрированная (85—90%-ная) перекись водорода в смеси с некоторыми горючими материалами используется для получения взрывчатых составов. Слабый (обычно 3%-ный) раствор перекиси водорода применяется в медицине как дезинфицирующее средство для промывания ран, для полоскания горла и т. п.
Вы читаете, статья на тему Перекись водорода Н2О2
Похожие страницы:
Понравилась статья поделись ей
Перекись водорода
Перекись водорода
| Пероксид водорода | |
 | |
 | |
| Общие | |
|---|---|
| Систематическое наименование | Пероксид водорода |
| Химическая формула | H2O2 |
| Отн. молек. масса | 34,01 а. е. м. |
| Молярная масса | 34,01 г/моль |
| Физические свойства | |
| Плотность вещества | 1.4 г/см³ |
| Состояние (ст. усл.) | жидкость |
| Термические свойства | |
| Температура плавления | −0,432 °C |
| Температура кипения | 150,2 °C |
| Энтальпия (ст. усл.) | -136.11 кДж/моль |
| Химические свойства | |
| pKa | 11.65 |
| Растворимость в воде | неограниченная г/100 мл |
| Классификация | |
| номер CAS | [7722-84-1] |
Перокси́д водоро́да (перекись водорода), H2O2 — простейший представитель пероксидов. Бесцветная жидкость с «металлическим» вкусом, неограниченно растворимая в воде, спирте и эфире. Концентрированные водные растворы взрывоопасны. Пероксид водорода является хорошим растворителем. Из воды выделяется в виде неустойчивого кристаллогидрата H2O2•2H2O.
Молекула пероксида водорода имеет следующее строение:
Содержание
Физические свойства
Чистый пероксид водорода очень сильно отличается от знакомого всем 3%-ного раствора Н2О2, который стоит в домашней аптечке. Прежде всего, он почти в полтора раза тяжелее воды (плотность при 20° С равна 1,45 г/см3). Замерзает Н2О2 при температуре, немного меньшей, чем температура замерзания воды – при минус 0,41° С, но если быстро охладить чистую жидкость, она обычно не замерзает, а переохлаждается, превращаясь в прозрачную стеклообразную массу. Растворы Н2О2 замерзают при значительно более низкой температуре: 30%-ный раствор – при минус 30° С, а 60%-ный – при минус 53° С. Кипит Н2О2 при температуре более высокой, чем обычная вода, – при 150,2° С. Смачивает стекло Н2О2 хуже, чем вода, и это приводит к интересному явлению при медленной перегонке водных растворов: пока из раствора отгоняется вода, она, как обычно, поступает из холодильника в приемник в виде капель; когда же начинает перегоняться Н2О2, жидкость выходит из холодильника в виде непрерывной тоненькой струйки. На коже чистый пероксид водорода и его концентрированные растворы оставляют белые пятна и вызывают ощущение жгучей боли из-за сильного химического ожога.
Чистый Н2О2, как и сахарный сироп, сильно преломляет свет. Действительно, коэффициент преломления безводного Н2О2 (1,41) намного больше, чем у воды (1,33). Однако то ли в результате неверного толкования, то ли из-за плохого перевода с французского, практически во всех учебниках до сих пор пишут, что чистый пероксид водорода – «густая сиропообразная жидкость», и даже объясняют это теоретически – образованием водородных связей. Но ведь вода тоже образует водородные связи. На самом деле вязкость у Н2О2 такая же, как и у чуть охлажденной (примерно до 13° С) воды, но нельзя сказать, что прохладная вода густая, как сироп.
Химические свойства
Разлагается на кислород и воду при нагревании, под действием ультрафиолетового излучения, а также в присутствии ионов переходных металлов и серебра:
Однако очень чистый пероксид водорода устойчив.
Пероксид водорода проявляет очень слабые кислотные свойства (К = 1,4·10 –12 ). При действии концентрированного раствора Н2O2 на гидроксиды в ряде случаев можно выделить пероксиды металлов (Li2O2, MgO2 и др.):
Окислительно-восстановительные свойства
Пероксид водорода обладает сильными окислительными, а также восстановительными свойствами. Он окисляет нитриты в нитраты, выделяет иод из иодидов металлов, расщепляет ненасыщенные соединения по месту двойных связей. Пероксид водорода восстанавливает соли золота и серебра, а также кислород при реакции с водным раствором перманганата калия в кислой среде.
При действии сильных окислителей H2O2 проявляет восстановительные свойства, выделяя свободный кислород:
Реакцию KMnO4 с Н2O2 используют в химическом анализе для определения содержания Н2O2:
Окисление органических соединений пероксидом водорода (например, сульфидов и тиолов) целесообразно проводить в среде уксусной кислоты.
Биологические свойства
Перекись водорода относится к реактивным формам кислорода и при повышенном образовании в клетке вызывает оксидативный стресс. Некоторые ферменты, например глюкозоксидаза, образуют в ходе окислительно-восстановительной реакции пероксид водорода, который может играть защитную роль в качестве бактерицидного агента. В клетках млекопитающих нет ферментов, которые бы восстанавливали кислород до перекиси водорода. Однако несколько ферментных систем (ксантиноксидаза, НАД(Ф)H-оксидаза, циклоксигеназа и др.) продуцируют супероксид, который спонтанно или под действием супероксиддисмутазы превращается в перекись водорода.
Получение
Пероксид водорода получаются в промышленности по реакции с участием органических веществ, в частности, каталитическим окислением изопропилового спирта:
Ценным побочным продуктом этой реакции является ацетон.
В лабораторных условиях для получения пероксида водорода используют реакцию
Концентрирование и очистку пероксида водорода проводят осторожной перегонкой.
Применение
Благодаря своим сильным окислительным свойствам пероксид водорода нашёл широкое применение в быту и в промышленности, где используется, например, как отбеливатель на текстильном производстве и при изготовлении бумаги. Применяется как ракетное топливо — в качестве окислителя или как однокомпонентное (с разложением на катализаторе). Используется в аналитической химии, в медицине, в качестве пенообразователя при производстве пористых материалов, в производстве дезинфицирующих и отбеливающих средств. В промышленности пероксид водорода также находит свое применение в качестве катализатора, гидрирующего агента, как эпоксидирующий агент при эпоксидировании олефинов. В медицине растворы пероксида водорода применяются как антисептическое средство. При контакте с поврежденной кожей и слизистыми пероксид водорода под влиянием фермента каталазы распадается с выделением кислорода, что способствует сворачиванию крови и создает неблагоприятные условия для развития микроорганизмов. Однако такое действие непродолжительно и обладает слабым эффектом. Тем не менее, пероксид водорода (аптечное название — перекись водорода, 3 %) применяется при первичной обработке ран (в том числе открытых). Перекись водорода очень эффективна для лечения небольших царапин, особенно у детей — она не «щиплет», не имеет запаха, бесцветна. Однако она может вызывать небольшое жжение в районе открытой раны. Стоимость пузырька такого раствора (на 2009 год) — около 6 руб. В пищевой промышленности растворы пероксида водорода применяются для дезинфекции технологических поверхностей оборудования, непосредственно соприкасающихся с продукцией. Кроме того, на предприятиях по производству молочной продукции, соков, растворы перекиси водорода используются для дезинфекции упаковки (технология «Тетра Пак»). Для технических целей пероксид водорода применяют в производстве электронной техники.
Формы выпуска
Выпускается в виде водных растворов, стандартная концентрация 3, 30, 38, 50, 60, 85, 90 и 98%. 30% водный раствор пероксида водорода, стабилизированный добавлением фосфатов натрия, называется пергидролем.
Опасность применения
Несмотря на то, что пероксид водорода не токсичен, его концентрированные растворы при попадании на кожу, слизистые оболочки и в дыхательные пути вызывают ожоги. В больших концентрациях недостаточно чистый пероксид водорода может быть взрывоопасен.
Химические связи
Различают несколько типов химических связей: ковалентная, ионная, металлическая, водородная.
Ковалентная связь возникает между двумя атомами по обменному механизму (обобществление пары электронов) или донорно-акцепторному механизму (электронов донора и свободной орбитали акцептора).
Ковалентной связью соединены атомы в молекулах простых веществ (Cl2, Br2, O2), органических веществ (C2H2), а также, в общем случае, между атомами неметалла и другого неметалла (NH3, H2O, HBr).
Существует донорно-акцепторный механизм образования ковалентной связи, при котором один атом выступает в качестве донора неподеленной электронной пары. Другой атом не тратит свои электроны, а только лишь предоставляет орбиталь (ячейку) для этой электронной пары.
Ионная связь
В наиболее частом случае ионная связь образуется между типичным металлом и типичным неметаллом. Примеры:
Большой подсказкой служит таблица растворимости, ведь все соли имеют ионные связи: CaSO4, Na3PO4. Даже ион аммония не исключение, между катионом аммония и различными анионами образуются ионные связи, например в соединениях: NH4I, NH4NO3, (NH4)2SO4.
Часто в химии встречаются несколько связей внутри одной молекулы. Рассмотрим, например, фосфат аммония, обозначив тип каждой связи внутри этой молекулы.
Металлическая связь
“Облако” электронов в металлах способно приходить в движение под различным воздействием. Именно оно является причиной электропроводности металлов.
Водородная связь
Водородные связи возникают между атомом водорода и другим более электроотрицательным атомом (O, S, N, C).
Отчасти за счет водородных связей наблюдается то самое исключение, связанное с усилением кислотных свойств в ряду галогеноводородных кислот: HF → HCl → HBr → HI. Фтор является самым ЭО-ым элементов, сильно притягивает к себе атом водорода другой молекулы, что снижает способность кислоты отщеплять водород и снижает ее силу.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Какая связь в перекиси водорода
ИССЛЕДОВАНИЕ СВОЙСТВ ПЕРОКСИДА ВОДОРОДА
Автор работы награжден дипломом победителя III степени
Перекись водорода (систематическое наименование — пероксид водорода, H2O2) — это самое первое из открытых соединений подобного вида. Вещество представляет собой несимметричную молекулу, состоящую из атомов водорода и кислорода, с образованием сильных полярных связей (Приложение 1). Ими обусловлены основные физико-химические свойства перекиси водорода, ее реакционная способность и активность в качестве растворителя. Перекись водородасчитается одним из сильнейших окислителей, в связи с чем это вещество получило широкое распространение, как в бытовых, так и в промышленных целях.
На бытовом уровне пероксид водорода используется в качестве эффективного антисептика для обработки открытых ран и других травм. Установлено, что растворы с концентрацией в 1 % способны полностью убивать большинство патогенных микроорганизмов, не угнетая активность клеток человеческого организма. Кроме того, пероксид водорода обладает способностью мягко очищать ткани от инородных включений. Весьма часто слабые растворы пероксида используются для обесцвечивания волос и пигментных пятен на коже, что может негативно сказаться на состоянии роговых покровов.
Промышленная сфера применения перекиси водорода значительно шире. Благодаря высоким реакционным свойствам это вещество широко используется в качестве катализатора или восстановителя в различных реакциях, в том числе — для очистки металлов. Пероксид водорода является незаменимым компонентом большинства средств бытовой химии, а также используется в пищевой промышленности в качестве безопасного антисептика. Также это вещество нашло применение в сфере энергетики: его используют в качестве окислителя для ракетного топлива, торпед и турбин.
Актуальность. Пероксид водорода интересен, во-первых, двоякостью своих свойств: с одной стороны, это типичный окислитель, но с другой стороны, при определенных условиях он проявляет восстановительные свойства. Интересно, как ведет себя соединение с необычной степенью окисления кислорода (–1). Во-вторых, его слабые растворы часто применяются в быту, а с другой стороны — учёные 19-го века не раз отмечали опасность чистого пероксида водорода.
Цель работы: изучить физические и химические свойства пероксида водорода.
Для достижения указанной цели поставлены следующие основные задачи:
выяснить историю открытия и получения H2O2;
узнать, какие физические и химические свойства характерны для исследуемого объекта;
провести эксперимент по исследованию окислительно-восстановительных свойств;
обобщить полученные сведения в учебной исследовательской работе.
Гипотеза исследования: если всесторонне изучить свойства пероксида водорода, то можно гарантировать правильное использование этого соединения.
Объект: растворы пероксида водорода различной концентрации
Предмет: исследование свойств пероксида водорода в лабораторных условиях.
Методы: эксперимент, наблюдение, сравнение, анализ результатов.
Теоретическая часть
1. Открытие пероксида водорода (историческая справка)
Впервые пероксид водорода получил в 1818 французский химик Луи Жак Тенар (1777 – 1857), действуя сильно охлажденной соляной кислотой на пероксид бария:
Пероксид бария, в свою очередь, получали сжиганием металлического бария. Для выделения из раствора Н2О2. Тенар удалил из него образовавшийся хлорид бария:
Чтобы не использовать дорогую соль серебра, в последующем для получения H2O2использовали серную кислоту, поскольку при этом сульфат бария остается в осадке:
Иногда применяли другой способ: пропускали углекислый газ во взвесь ВаО2 в воде, поскольку карбонат бария также нерастворим:
Этот способ предложил французский химик Антуан Жером Балар (1802–1876), прославившийся открытием нового химического элемента брома (1826).
Применяли и более экзотические методы, например, действие электрического разряда на смесь 97% кислорода и 3% водорода при температуре жидкого воздуха (около –190° С), так был получен 87%-ный раствор H2O2.
Концентрировали H2O2 путем осторожного упаривания очень чистых растворов на водяной бане при температуре не выше 70–75 °С – так можно получить примерно 50%-ный раствор. Сильнее нагревать нельзя – происходит разложение H2O2,поэтому отгонку воды проводили при пониженном давлении, используя сильное различие в давлении паров (и, следовательно, в температуре кипения) Н2О и Н2О2. Так, при давлении 15 мм рт.ст. сначала отгоняется в основном вода, а при 28 мм рт.ст. и температуре 69,7°С, отгоняется чистый пероксид водорода. Другой способ концентрирования – вымораживание, так как при замерзании слабых растворов лед почти не содержит Н2О2. Окончательно можно обезводить поглощением паров воды серной кислотой на холоде под стеклянным колоколом.
2. Физические свойства
Чистый пероксид водорода очень сильно отличается от знакомого всем 3%-ного раствораH2O2. Прежде всего, он почти в полтора раза тяжелее воды (плотность при 20°С равна 1,45 г/см 3 ). ЗамерзаетH2O2 при температуре немного меньшей, чем температура замерзания воды – при минус 0,41° С, но если быстро охладить чистую жидкость, она обычно не замерзает, а переохлаждается, превращаясь в прозрачную стеклообразную массу. Растворы H2O2 замерзают при значительно более низкой температуре: 30%-ный раствор – при минус 30°С, а 60%-ный – при минус 53°С. Кипит H2O2 при температуре более высокой, чем вода – при 150,2° С. На коже чистый пероксид водорода и его концентрированные растворы оставляют белые пятна и вызывают ощущение жгучей боли из-за сильного химического ожога.
В статье, посвященной получению пероксида водорода, Тенар не очень удачно сравнил это вещество с сиропом, возможно, он имел в виду, что чистый H2O2, как и сахарный сироп, сильно преломляет свет. Действительно, коэффициент преломления безводногоH2O2(1,41) намного больше, чем у воды (1,33). Однако, то ли в результате неверного толкования, то ли из-за плохого перевода с французского, практически во всех учебниках до сих пор пишут, что чистый пероксид водорода – «густая сиропообразная жидкость», и даже объясняют это теоретически – образованием водородных связей. Но ведь вода тоже образует водородные связи. На самом деле вязкость у H2O2 такая же, как и у чуть охлажденной (примерно до 13° С) воды, но нельзя сказать, что прохладная вода густая, как сироп.
3. Химические свойства
Для перекиси водорода характерно наличие одновременно окислительных и восстановительных свойств, что объясняется особым состоянием атомов кислорода в молекуле этого вещества. Тем не менее, перекись водорода более охотно проявляет окислительные свойства при взаимодействии с металлами, гидроксидами, солями, щелочами.
При этом образуются оксиды или пероксиды других соединений, а перекись водорода восстанавливается до воды. В присутствии других сильных окислителей (кислот или активных соединений) пероксид водорода проявляет свойства восстановителя, что может быть использовано в целях очистки соединений от примесей.
Окислительно-восстановительные свойства
В молекулах пероксида водорода H2O2 атомы кислорода находятся в степени окисления –1. Это промежуточная и не самая устойчивая степень окисления атомов этого элемента, поэтому пероксид водорода проявляет и окислительные, и восстановительные свойства.
Окислительно-восстановительная активность этого вещества зависит от концентрации. В обычно используемых растворах с массовой долей 20% пероксид водорода довольно сильный окислитель, в разбавленных растворах его окислительная активность снижается. Восстановительные свойства для пероксида водорода менее характерны, чем окислительные, и также зависят от концентрации.
Пероксид водорода – очень слабая кислота, поэтому в сильнощелочных растворах его молекулы превращаются в гидропероксид-ионы.
В зависимости от реакции среды и от того, окислителем или восстановителем является пероксид водорода в данной реакции, продукты окислительно-восстановительного взаимодействия будут разными.
4. Получение
На сегодняшний день пероксид водорода получают на основе реакции с антрахиноном. Концентрация получаемого раствора варьирует в пределах от 20 до 40%. При необходимости концентрацию можно увеличить до 50-70% с помощью вакуумного дистиллятора. В вакуумном дистилляторе создается пониженное давление, в результате чего вода испаряется при температуре ниже 100 °С, в то время как пероксид водорода, температура кипения которого при нормальных условиях составляет 150,2 °С, остается в растворе. Конечный продукт хранится и транспортируется в цистернах, изготовленных из нержавеющей стали или из алюминия.
За счет добавления стабилизатора в раствор пероксида водорода мы имеем возможность значительно продлять срок его хранения, удается добиться того, чтобы за месяц распаду подвергалось менее 0,1 % вещества. Подобную защиту обеспечивают такие вещества, как станнат натрия (Nа2SnO3·ЗН20) и различные фосфаты, которые связывают все металлы, находящиеся в растворе, и не дают им катализировать разложение перекиси.
5. Применение
Благодаря своим сильным окислительным свойствам пероксид водорода нашёл широкое применение в быту и в промышленности, где используется, например, как отбеливатель на текстильном производстве и при изготовлении бумаги (Приложение 2). Применяется как ракетное топливо, в качестве окислителя или как однокомпонентное (с разложением на катализаторе), в том числе для привода турбонасосных агрегатов. Используется в аналитической химии, в качестве пенообразователя при производстве пористых материалов, в производстве дезинфицирующих и отбеливающих средств.
При обработке ран пероксид водорода может мешать заживлению и способствовать образованию рубцов из-за разрушения новообразующихся клеток кожи. Однако в качестве средства для очистки глубоких ран сложного профиля, гнойных ран, санация которых затруднена, пероксид водорода остаётся предпочтительным препаратом, так как он обладает не только антисептическим эффектом, но и создаёт большое количество пены при взаимодействии с ферментом каталазой.
Пероксид водорода применяется также для отбеливания зубов и обесцвечивания волос, эффект в обоих случаях основан на окислении.
В пищевой промышленности растворы пероксида водорода применяются для дезинфекции технологических поверхностей оборудования, непосредственно соприкасающихся с продукцией. Кроме того, на предприятиях по производству молочной продукции и соков, растворы перекиси водорода используются для дезинфекции упаковки (технология «Тетра Пак»).
Для технических целей пероксид водорода применяют в производстве электронной техники.
В быту применяется также для выведения пятен MnO2, образовавшихся при взаимодействии перманганата калия («марганцовки») с предметами (ввиду его восстановительных свойств).
3%-ный раствор пероксида водорода используется в аквариумистике для оживления задохнувшейся рыбы, а также для очистки аквариумов и борьбы с нежелательной флорой и фауной в аквариуме.
Практическая часть.
Исследование химических свойств пероксида водорода (Приложение 3)
1. Пероксид водорода – кислота, но очень слабая. Пробуем подтвердить это. Добавляем индикатор к щелочи, затем пероксид. Светло-розовый (из-за наличия фенолфталеина) раствор гидроксида натрия обесцвечивается при добавлении пероксида водорода
2.Необычно идет окисление формальдегида: Н2О2 восстанавливается не до воды (как обычно), а до свободного водорода:
Если взять 30%-ный раствор Н2О2 (гидроперит) и 40%-ный раствор НСНО (формалин), то после небольшого подогрева начинается бурная реакция, жидкость вскипает и пенится.
3.Окислительное действие разбавленных растворов Н2О2 больше всего проявляется в кислой среде, например, при взаимодействии со щавелевой кислотой.
Наблюдали выделение бесцветного газа.
4.Под действием света идет окисление и соляной кислоты:
Небольшое выделение желто-зеленого газа.
5.Добавление Н2О2 к кислотам сильно увеличивает их действие на металлы. При добавлении разбавленной серной кислоты к меди реакция не идет (медь – неактивный металл), но в случае добавления пероксида медь начинает растворяться, при нагревании этот процесс ускорился, выделился газ, а раствор стал светло-голубым.
6. Необычно происходит окисление калий-натриевой соли винной кислоты (сегнетовой соли) в присутствии сульфата кобальта в качестве катализатора. В ходе реакции розовый CoSO4 изменяет цвет на зеленый из-за образования комплексного соединения с тартратом – анионом винной кислоты. По мере протекания реакции и окисления тартрата комплекс разрушается, и катализатор снова розовеет.
Если вместо соли кобальта использовать в качестве катализатора медный купорос CuSO4 ∙ 5H2O, то промежуточное соединение, в зависимости от соотношения исходных реагентов, будет окрашено в оранжевый или зеленый цвет. После окончания реакции восстанавливается синий цвет медного купороса.
2. Особенности окислительно-восстановительной активности
7. Реакции с перманганатом калия в разных средах
а) в нейтральной среде:
Наблюдается выпадение коричневого осадка и выделение бесцветного газа.
при добавлении пероксида розовый раствор перманганата калия начинает быстро светлеть: соль, придававшая окраску раствору, вступает в реакцию и образует соединения, неспособные окрашивать раствор.
в) в щелочной среде:
При добавлении гидроксида натрия раствор перманганата посветлел, после добавления пероксида водорода приобрёл желтоватый оттенок, выделился газ.
8. Реакции с хроматом калия в разных средах
а) в нейтральной среде:
Жёлтый раствор хромата калия после добавления перекиси помутнел, образовался осадок, выделился газ.
После добавления серной кислоты желтый раствор становится более ярким. При добавлении перекиси водорода приобретает зелёный оттенок, со временем светлеет.
в) в щелочной среде:
При добавлении перекиси в смесь растворов гидроксида натрия и хромата калия особых изменений не наблюдалось.
9. Реакции с дихроматом калия в разных средах
а) в нейтральной среде:
При добавлении перекиси в водный раствор дихромата калия стали подниматься пузырьки газа, раствор приобрёл коричневый цвет, из-за полученного гидроксида хрома (III).
После добавления пероксида водорода в смесь серной кислоты и дихромата калия раствор под влиянием сульфата хрома (III) сталярко-синим, а после посветлел.
в) в щелочной среде:
При проведении реакции особых признаков выявлено не было.
10. Реакция с сульфидом свинца
При добавлении нитрата свинца в водный раствор сульфида натрия выпал черный осадок сульфида свинца
После добавления пероксида он превратился в белый творожистый осадок
11. Реакция с нитратом серебра
После добавления пероксида водорода появились пузырьки газа, а раствор стал светло-голубым, из-за выделения кислорода и восстановления серебра.
11. Реакции с иодидом калия в разных средах
а) в нейтральной среде:
После добавления перекиси водорода раствор стал зеленоватым, из-за получившегося в ходе реакции иода.
При добавлении пероксида раствор сначала пожелтел, а затем стал оранжевым, выпал осадок.
в) в щелочной среде:
Видимых признаков реакции не наблюдалось.
12. Такие необычные свойства Н2О2 позволяет, например, провести окисление гексацианоферрата(II) калия, а затем, изменив условия, восстановить продукт реакции в исходное соединение с помощью того же реактива. Первая реакция идет в кислой среде, вторая – в щелочной:
Двойственный характер Н2О2 позволил одному преподавателю химии сравнить пероксид водорода с героем повести известного английского писателя Стивенсона «Странная история доктора Джекила и мистера Хайда», под влиянием придуманного им состава он мог резко изменять свой характер, превращаясь из добропорядочного джентльмена в кровожадного маньяка.
IV. Выводы
Перекись водорода, химическая формула которой H2O2, при контакте с водой распадается до составляющих, то есть на воду и кислород, поэтому перекись водорода вполне справедливо считается экологически чистым веществом, которое не может принести никакого вреда окружающей среде.
Что касается безусловной пользы перекиси водорода, то это, прежде всего, ее использование в медицинских целях. Как известно, согласно официальным рекомендациям, в медицинских целях используется перекись водорода трехпроцентная, причем назначение этого средства исключительно наружное — обработка незначительных повреждений кожи (ссадин, царапин, ран небольшого размера), остановка незначительных кровотечений, а также использование для полосканий при заболевании стоматитом.
Чем же объясняется эффект обеззараживания, который оказывает перекись водорода на различные повреждения кожных покровов? Обеззараживающий (антисептический) эффект объясняется тем, что при контакте перекиси водорода с кожей происходит высвобождение кислорода (появляется пенка), и, как следствие, рана получает возможность очиститься механическим способом — образовавшаяся кислородная пена очищает рану просто механически, вымывая микробы, грязь и даже некротические образования, которые могли уже появиться в ране.
Итак, проведя исследование физических и химических свойств пероксида водорода, я сделала выводы:
1. Такие физические свойства, как температура замерзания, температура кипения, плотность и коэффициент преломления у пероксида водорода зависят от концентрации вещества.
2. Как правило, в химических реакциях пероксид проявляет и окислительные свойства, восстанавливаясь до воды, и восстановительные, окисляясь до кислорода.
3. Использовать это удивительное соединение необходимо только учитывая его свойства.
Таким образом, я могу утверждать, что гипотеза моего исследования подтверждена.
V. Заключение
Итак, я провела планируемое исследование и узнала много нового. Над своим исследованием я трудилась очень увлеченно, мне было интересно узнать, каковы состав и строение пероксида водорода, что придает ей полезные свойства.
В перспективе мне хотелось бы обратиться к биолого-анатомическому и медицинскому аспекту данной темы, узнать, как именно влияет перекись водорода на органы и ткани человеческого организма, с чем связан ее лечебный эффект.
При подготовке работы и презентации к ней, я подробно ознакомилась с требованиями к оформлению исследовательских работ, что обязательно пригодится мне в дальнейшей учебной деятельности в школе и в вузе. Свойства пероксида водорода, изученные в теории и на практике помогут мне правильно и безопасно применять его в жизни.
VI. Литература
1. Ахметов Н. С. Общая и неорганическая химия.
2. Долгоплоск Б.А., Тинякова Е.И. Генерирование свободных радикалов и их реакции.
3. Карапетьянц М. Х., Дракин С. И. Общая и неорганическая химия.
4. Хомченко Г. П., Севастьянова К. И., Окислительно-восстановительные реакции, 2 изд., М., 1980
VII. Приложения
Приложение 1. Строение молекулы пероксида водорода H2O2
молекула пероксида водорода
Приложение 2. Формы выпуска пероксида водорода
Приложение 3. Фото опытов
Раствор гидроксида натрия с фенолфталеином
При добавлении пероксида обесцвечивается:
При добавлении пероксида в формальдегид начинается обильное выделение газа:
Выделение бесцветного газа при добавлении пероксида водорода в раствор щавелевой кислоты:
При добавлении перекиси водорода и при последующем нагревании медь реагирует с серной кислотой, в результате чего происходит выделение газа и изменение цвета:
Раствор перманганата калия:
При добавлении пероксида в нейтральной среде:
При добавлении пероксида в кислой среде:
При добавлении пероксида в щелочной среде:
Раствор хромата калия:
После добавления пероксида водорода к хромату калия в нейтральной среде:
При добавлении пероксида в кислой среде:
При добавлении пероксида водорода в щелочной среде:
Раствор иодида калия:
При добавлении пероксида в нейтральной среде: