какая железа функционирует только у детей
Когда желудку и кишечнику не хватает ферментов
Основным инструментом пищеварения являются ферменты, именно они выполняют всю основную работу. Логично, что при их недостатке процесс пищеварения нарушается, и организм начинает нам сообщать о проблемах, сигнализируя различными симптомами. Такие привычные всем симптомы как изжога, тяжесть в животе, боль, метеоризм, диарея или запор – являются прямым указанием на проблемы с пищеварением.
Ферменты поджелудочной железы – виды и функции
Пора узнать, что представляют собой ферменты, и как они влияют на пищеварение. Ферменты поджелудочной железы – это белковые комплексы или катализаторы, основной задачей которых является расщепление питательных веществ на простые, легкоусвояемые соединения. Таким образом, организм легко усваивает все необходимые элементы и витамины.
Какие ферменты вырабатывает поджелудочная железа и какие у них функции?
Особо интересно то, что организм может регулировать выработку тех или иных ферментов в зависимости от характера потребляемой пищи. То есть, если вы потребляете много хлебобулочных изделий, то упор в выработке будет сделан на амилазе, если потребляется жирная пища, то поджелудочная железа отправит в кишечник больше липазы.
Кажется, что работа полностью налажена, и сбоев быть не может. Но сбои случаются и достаточно часто: слишком тонкий механизм работы, который легко нарушить. Даже большой приём пищи с преобладанием жиров может сломать систему, и поджелудочная железа не сможет обеспечить нужное количество ферментов.
Появление проблем с пищеварением
Мы выяснили, что проблемы с пищеварением могут возникать из-за недостатка ферментов. Существует два основных механизма, при которых организму не хватает ферментов поджелудочной железы. В первом варианте проблема с выработкой ферментов кроется в самой поджелудочной железе, т.е. сам орган функционирует неправильно.
Во втором варианте нарушаются условия, при которых ферменты могут правильно работать. Подобное возможно в результате изменения кислотности среды кишечника, например, при воспалении или при изменении стандартной температуры окружения (36-37° С). Воспалительный процесс в кишечнике может возникать при различных состояниях: кишечные инфекции, аллергические реакции (пищевая аллергия, атопический дерматит).
Основные признаки нехватки ферментов поджелудочной железы
Выявить недостаток ферментов достаточно просто. Ключевыми симптомами являются тяжесть после еды, чувство распирания в животе и дискомфорт в животе. Нередко эти симптомы сопровождаются вздутием, урчанием, метеоризмом, диареей. Чаще всего такие симптомы могут возникать в рядовых ситуациях: при употреблении тяжелой, жирной пищи или при переедании, когда удержаться от множества вкусных блюд попросту не удалось. В этом случае не стоит бояться неполадок с поджелудочной железой или других заболеваний ЖКТ. Поджелудочная железа просто не справляется с большим объемом работы, и ей может потребоваться помощь.
Если нехватка ферментов и проблемы с пищеварением сохраняются длительное время, то это не остается незаметным для организма. Симптомы могут усугубляться и носить уже не эпизодический, а регулярный характер. Постоянная диарея дает старт авитаминозу, могут развиваться: белково-энергетическая недостаточность и обезвоживание во всем организме. Может наблюдаться значительное снижение массы тела. Помимо этого при тяжелых стадиях могут наблюдаться следующие симптомы недостатка ферментов поджелудочной железы 8 :
Поддержание пищеварения и лечение ферментной недостаточности
При проблемах с пищеварением могут помочь ферментные препараты (чаще они называются препаратами для улучшения пищеварения), основная задача которых компенсировать нехватку собственных ферментов в организме. Не зря такая терапия называется «ферментозаместительная». Критически важно, чтобы ферментный препарат максимально точно «имитировал» физиологический процесс.
На сегодняшний момент существуют различные препараты для улучшения пищеварения. Как же ориентироваться в многообразии средств и сделать правильный выбор?
Эффективный ферментный препарат должен соответствовать следующим критериям 5,6 :
Тимус – что это? Роль тимуса на первому году жизни ребенка
Ультразвуковая чистка кожи лица со скидкой 50%
Консультация педиатра со скидкой 20%
Тимус (вилочковая железа) – важный орган иммунной системы детей. Он расположен в верхнем отделе грудной клетки и состоит из двух долей, соединяющихся в передней части трахеи. Железа растет до наступления половой зрелости, достигая массы 30–40 грамм, затем постепенно уменьшается (обратное развитие).
Она играет доминирующую роль в иммунной, эндокринной системе. Тимус продуцирует тимозин, тимопоэтин, стимулирующие выработку антител, а также производит Т-лимфоциты – белые клетки крови, уничтожающие аномальные клетки с чужеродными антигенами. Другая функция вилочковой железы – предотвращение патологического роста клеток и предупреждение рака. Следует отметить, что тимус играет ведущую роль в иммунитете ребенка до трех лет.
Роль тимуса в жизни ребёнка
До рождения и в детстве тимус ответственен за производство плюс созревание Т-лимфоцитов, защищающих организм от определенных угроз, включая вирусы, бактерии. Тимус является крупнейшим лимфоидным органом у новорожденных, так как активнее других тканей продуцирует лимфоциты. Железа выступает «первой скрипкой» в развитии и улучшении иммунной системы ребенка.
Тимус производит и секретирует тимозин – гормон, необходимый для выработки Т-клеток. После «созревания» в железе они поступают в кровь и мигрируют в лимфоузлы и селезенку, где помогают иммунной системе бороться с болезнью.
В некоторых случаях функции вилочковой железы снижены, что ослабляет иммунную систему, увеличивая склонность к инфекциям и аллергии. Ребенок страдает затяжными ОРВИ, патология легко переходит в хроническую. Недостаток Т-лимфоцитов в организме может привести к иммунодефицитным заболеваниям, характеризующимися сильной потливостью, отечностью и/или болезненностью горла, припухлостью лимфатических узлов, депрессией.
Недоедание и дефицит белка в раннем возрасте обусловливает медленный или ограниченный рост тимуса, «подрывая» тем самым нормальное функционирование лимфоцитов. Вот почему важно сбалансированное питание с достаточным количеством белка.
Доктора данного направления
Патология тимуса
Основные виды патологии тимуса:
Увеличение тимуса у детей
Отклонение в размере тимуса в большую сторону и снижение его функции обозначают термином «синдром увеличенной вилочковой железы» (СУВЖ) у детей. Проблему увеличенного тимуса чаще рассматривают в свете дифференциальной диагностики с плевритом, перикардитом, опухолями средостения, другими патологиями.
Ошибочно считают, что увеличенный тимус у детей грудного или раннего возраста является физиологическим состоянием. Особенности протекания инфекционных заболеваний у маленьких пациентов с СУВЖ заставляют классифицировать синдром, как патологию. Дети с СУВЖ имеют большую вероятность развития дисбаланса нейроэндокринной плюс иммунной систем. Поэтому пациенты с выявленным увеличением тимуса требуют полного обследования и диспансерного наблюдения у эндокринолога, иммунолога.
Симптомы заболевания или нарушения развития вилочкой железы
Для того, что бы вовремя выявить патологию тимуса, родителям стоит обратить внимание на отклонения, имеющие различную степень выраженности, которые могут свидетельствовать о заболевании или нарушении развития вилочковой железы:
При возникновении подозрений на патологию тимуса, врач может назначить дополнительные методы обследования:
Тимическая недостаточность поддается иммунокорекции, которая индивидуально подбирается врачом аллергологом-иммунологом. Стоит обратить внимание, что своевременная диагностика патологии вилочковой железы особенно актуальна на первом году жизни ребенка, когда ребенку начинают проводить вакцинацию.
Для получения подробных консультаций о роли тимуса в жизни ребёнка на первом году жизни обращайтесь к педиатрам медицинских центров «Президент-Мед»
Самый загадочный орган иммунной системы
Вплоть до средних веков одним из претендентов на роль телесного вместилища души считался тимус. В наши дни самой удивительной особенностью этого органа называют его склонность к раннему старению и полной деградации с возрастом. Почему так происходит? Если взрослые могут обходиться без этой железы, то зачем она нужна детям?
Вилочковая железа
Тимус относится к центральным элементам иммунной системы. Свое название железа получила в честь душистого растения чебрец (Thymus), из клеток которой было выделено азотистое основание тимин, входящее в состав ДНК. Это небольшой орган розовато-серого цвета, мягкой консистенции, расположенный в центральной части грудной клетки. Он покрыт капсулой из плотной соединительной ткани, от которой в глубину отходят перемычки, делящие его на дольки. Верхние, более узкие, концы долей выходят за пределы грудной полости, иногда достигая щитовидной железы. Доли тимуса напоминают двузубую вилочку, что и дало название этому органу — «вилочковая железа».
Если тимус недостаточно развит, как, например, при таком генетическом заболевании, как синдром ДиДжорджи, то у детей развивается врожденный иммунодефицит. Болезнь приводит к уменьшению количества Т-лимфоцитов в крови и проявляется повышенной чувствительностью к вирусным, грибковым и некоторым бактериальным инфекциям. Иногда в зрелом возрасте наблюдается особое нарушение иммунологических процессов, связанное с патологией тимуса и других лимфоидных органов, что может быть причиной внезапной смерти от наркоза во время операции.
Его задача — обнаружить клетки, которые в силу различных повреждений превратились в чужеродные, например, под воздействием вируса
Клетки-няньки и школа для лимфоцитов
В отличие от костного мозга, который дает начало практически всем клеткам иммунной системы (эритроцитам, тромбоцитам, гранулоцитам, моноцитам, лимфоцитам), тимус «специализируется» на продукции исключительно Т-лимфоцитов. Буква Т в названии указывает 
Часовые клеточного иммунитета
На внешней оболочке Т-лимфоцитов находятся белки, распознающие специфичные молекулы тканевой совместимости данного организма. Т-лимфоцит похож на часового, который охраняет организм от чужаков, спрашивая «пароль» у каждой клетки, встречающейся на его пути. Его задача — обнаружить клетки, которые в силу различных повреждений превратились в чужеродные, например, под воздействием вируса. Если клетка выглядит подозрительно, то она незамедлительно подлежит разрушению. Для выполнения этой функции Т-лимфоциты должны быть способны распознать собственные антигены тканевой совместимости, специфичные для каждого организма. При этом Т-лимфоциты не должны реагировать на аутоантигенные пептиды, связанные с собственными антигенами тканевой совместимости. Из широчайшего спектра вариантов антигенов тканевой совместимости лишь немногие экспрессированы на клетках данного индивида и нуждаются в распознавании Т-лимфоцитами. Именно поэтому селекция тимоцитов сопровождается большими энергетическими затратами и 95% гибелью. Зато зрелые периферические Т-лимфоциты живут долго и способны отвечать клональной экспансией в случае встречи со специфическим чужеродным антигеном.
Размеры тимуса являются максимальными в детском возрасте, но после начала полового созревания этот орган подвергается значительной атрофии и инволюции
Инволюция тимуса
Размеры тимуса являются максимальными в детском возрасте, но после начала полового созревания этот орган подвергается значительной атрофии и инволюции. У новорожденного тимус уже полностью развит и в течение первого года жизни достигает максимальных размеров — 25 см3: его длина составляет 5 см, ширина — 4 см, толщина — 6 мм. У 6-месячного ребенка масса тимуса достигает от 12 до 20 г, что составляет 0,5% массы тела. Сложная структура и напряженное функционирование железы сохраняются в течение первых 2–3 лет жизни. Самая высокая продукция Т-лимфоцитов происходит до 2 лет, а затем быстро уменьшается. Тимус продолжает расти до наступления половой зрелости, достигая максимального размера (длина до 7,5–16 м) и массы (35–40 г), а после 14–15 лет начинается процесс инволюции. К 20 годам половина функционирующей ткани тимуса замещается жировой тканью и у 25-летних масса железы уменьшается до 25 г с сохранением ее общих очертаний. В течение первых 50 лет жизни ежегодно теряется по 3% истинно тимической ткани. К 50–60 годам инволюция тимуса завершается, его масса составляет менее 15 г, а к 70–75 — около 6 г. Атрофии подвергаются главным образом латеральные участки железы и отчасти нижние, так что железа у взрослого человека принимает более удлиненную форму. По мере инволюции тимус утрачивает былой цвет и за счет увеличения в нем доли стромы и жировых клеток становится более желтым. Вместе с деградацией органа значительно уменьшается и почти полностью прекращается выработка Т-лимфоцитов, с чем отчасти связывают снижение иммунитета у лиц пожилого возраста.
Почему тимус деградирует?
Из всех органов иммунной системы только для тимуса характерна возрастная инволюция. Однако следует отметить, что количество Т-лимфоцитов долгое время сохраняется на достаточном уровне. Дело в том, что значительную часть популяции Т-лимфоцитов составляют долгоживущие клетки, которые не нуждаются в постоянном обновлении. Более того, зрелые Т-лимфоциты подвергаются так называемой колониальной экспансии, то есть избирательной пролиферации при встрече со своим антигеном, за счет чего их численность увеличивается, поэтому количество Т-клеток может поддерживаться во взрослом организме и при отсутствии тимуса. Кроме того, иммунная система располагает некоторыми компенсаторными возможностями для замещения отдельных функций недостающих Т-лимфоцитов. Да и в целом необходимость в генерации новых Т-лимфоцитов с возрастом снижается. Первичные контакты с инфекционными агентами происходят в основном в первые годы жизни, а в дальнейшем встреча с новыми патогенами случается не так часто, поэтому энергозатраты на содержание тимуса становятся нецелесообразными. К тому же постоянная активность тимуса с возрастом чревата развитием стрессовой гиперчувствительности иммунной системы, имеющей патологические последствия.
Тимусзависимая старость
Как видим, возрастная инволюция тимуса не вызывает катастрофического снижения иммунитета. Однако встреча с вирусами кори или ветрянки приводит к более тяжелым осложнениям у взрослых по сравнению с детьми, у которых тимус функционирует в полную силу. Не зря именно в течение первых трех лет жизни, то есть в период «расцвета» тимуса, врачи стараются вакцинировать ребенка против всех наиболее опасных и частых инфекционных заболеваний: туберкулеза, полиомиелита, дифтерии, столбняка, коклюша, кори. В этом возрасте иммунная система организма, как правило, отвечает на введение вакцины выработкой активного иммунитета, в частности путем формирования клонов долгоживущих Т-клеток. Благодаря этому впоследствии при встрече с болезнетворным микроорганизмом включается сигнал колониальной экспансии, активирующий Т-лимфоциты. Несмотря на это, предполагают, что возрастное ослабление иммунной системы, проявляющееся в виде слабой устойчивости к инфекциям, невосприимчивости к вакцинам и аутоиммунным заболеваниям, обусловлено прежде всего старением тимуса. Ведь разнообразные инфекции атакуют человека на протяжении всей его жизни, и «запастись» специфичными иммунными клетками на все случаи практически невозможно, да и запас Т-лимфоцитов постепенно исчерпывается.
Из всех органов иммунной системы только для тимуса характерна возрастная инволюция. Однако следует отметить, что количество Т-лимфоцитов долгое время сохраняется на достаточном уровне
Можно ли «омолодить» тимус?
Фактически тимус начинает деградировать с первых лет жизни, однако это становится заметно в период полового созревания. Закономерно, что инволюция тимуса напрямую связана с влиянием половых гормонов. Отмечено, что инволюцию тимуса способны замедлить пептиды шишковидной железы. Аналогичным образом действует ее гормон мелатонин, способный даже вызывать «омоложение» органа. Поскольку с возрастом ткань тимуса заменяется жировыми клетками, логично, что тимус довольно хорошо восстанавливается при соблюдении низкокалорийной диеты. Способствует этому, скорее всего, «гормон голода» — грелин, правда, у него есть побочный эффект в виде ослабления сексуальной мотивации. У людей старше 70 лет отмечен более разнообразны набор Т-клеточных рецепторов по сравнению с теми, которые еще не преодолели 70-летний рубеж. Удивительно, что продукция Т-лимфоцитов тимусом, пусть и в небольшом количестве, сохраняется даже у людей 100-летнего возраста. При этом у долгожителей менее выражены популяции клеток-клонов — то есть клеток, произошедших от одного активированного Т-лимфоцита. Возможно, именно эти особенности иммунитета позволяют долгожителям лучше противостоять инфекциям и быть более здоровыми. При этом возникает «тимусная селекция», в результате которой люди со сниженным иммунитетом реже становятся долгожителями.
Теперь понятно, почему тимус деградирует с возрастом. Во-первых, производство каждого Т-лимфоцита является слишком энергозатратным процессом. Во-вторых, клетки, прошедшие все этапы созревания, дифференцировки и отбора, могут жить долго и в случае необходимости размножаться клонированием. В-третьих, специфичные наборы клеточных рецепторов практически на все случаи чужеродных антигенов способны сформироваться в течение первого десятилетия жизни, а затем шанс столкнуться с новым инфекционным агентом значительно уменьшается. В-четвертых, подвергать организм иммунологическому стрессу без острой на то необходимости не только нецелесообразно, но и крайне опасно
Татьяна Кривомаз, канд. биол. наук
Список литературы находится в редакции
Дефицит железа и его отрицательное влияние на развитие детей раннего возраста. Диетологические возможности постнатальной коррекции дефицита железа
Железодефицитные состояния (ЖДС) — важная проблема педиатрии. В первую очередь, это обусловлено широкой распространенностью данных состояний среди населения нашей планеты. По данным ВОЗ, дефицит железа (ДЖ) имеет около 1,5 млрд человек, и только половина этих случаев приходится на долю его явного дефицита, то есть железодефицитную анемию (ЖДА) [1–3].
В материалах United Nations Administrative Committee on Coordination/Sub-Committee on Nutrition and International Food Policy Research Institute. Fourth Report of the World Nutrition Situation отмечено, что в странах с низким социально-экономическим уровнем у детей, страдающих различными дефицитными состояниями, ДЖ является самым частым микронутриентным недостатком. В индустриализированных странах, несмотря на то, что дефицитные состояния в последние годы стали встречаться значительно реже, ЖДА остается самой распространенной формой анемии у детей раннего возраста [4, 5].
Наиболее «уязвимы» по развитию ЖДС дети раннего возраста, подростки и беременные женщины. Так, в России, по данным различных авторов, частота ЖДА колеблется от 6% до 40% среди детского населения [6–8] и от 15% до 56% у беременных женщин [9].
Такая высокая распространенность ЖДА среди лиц этих категорий обусловлена тем, что основными причинами развития ЖДС чаще всего являются алиментарные факторы (нарушение сроков введения продуктов прикорма, дефицит питания, нерациональное питание), интенсивный рост и повышенная потребность в железе [6–10]. У девочек-подростков к вышеназванным причинам следует добавить еще и потерю железа вследствие наступления менструаций. В работе Bruner A. B. et al. (1996) отмечено, что у девочек после десятилетнего возраста потребность в железе возрастает на 70% и ДЖ развивается у 25% девочек-подростков в США [11].
Особенно чувствительны к недостаточности железа дети второго полугодия и второго года жизни [10]. В исследовании, проведенном в Institute for Nutrition Research, University of Oslo (2004), показано, что в Норвегии частота выявления ЖДА у детей первого полугодия жизни составляет 3%, во втором полугодии увеличивается втрое и составляет 10%, незначительно увеличиваясь к двум годам до 12% [12].
Этот возрастной период с физиологических позиций рассматривают как критический период в жизни ребенка, который характеризуется бурным ростом, активным формированием адаптивного иммунного ответа. Именно этот период по времени совпадает с последней фазой «рывка» в развитии головного мозга, когда завершается процесс формирования гиппокампа, осуществляется активный дендритогенез, синаптогенез и миелинизация. Поэтому любой, даже самый незначительный дефицит нутриентов, перенесенный малышом в этот период, может иметь ряд негативных последствий для становления психомоторных, предречевых и речевых навыков, абстрактного мышления, памяти и поведения.
Результаты исследований последних лет показывают, что не только ЖДА, но и ДЖ без анемии может иметь долгосрочное отрицательное влияние на развитие умственных способностей и поведение ребенка, причем некоторые из этих эффектов могут быть необратимыми [11, 13, 14].
Основные понятия и критерии диагностики ЖДС
Развитие ДЖ в организме имеет определенную стадийность. Выделяют три последовательно развивающиеся стадии ЖДС: прелатентный дефицит железа (ПДЖ), латентный дефицит железа (ЛДЖ) и ЖДА [6, 15].
ПДЖ характеризуется только снижением содержания железа в депо при сохранении транспортного и гемоглобинового фондов. По мнению главного детского гематолога РФ Румянцева А. Г., отсутствие клинических проявлений и четких критериев диагностики позволяет считать, что это состояние не имеет практического значения [15].
ЛДЖ составляет 70% всех ЖДС и представляет собой функциональное расстройство с отрицательным балансом железа, а не болезнь. На этой стадии происходит обеднение депо железа, которое может быть охарактеризовано с помощью определения сывороточного ферритина (СФ). В норме концентрация ферритина в сыворотке тесно коррелирует с его запасами в депо, при этом концентрация ферритина, равная 1 мкг/л, соответствует 10 мкг железа в депо. Уровень СФ зависит не только от количества железа в тканях депо, но и от скорости высвобождения ферритина из тканей. На сегодняшний день СФ является единственным международно признанным маркером запасов железа в организме человека.
При обеднении депо снижается поступление железа к клеткам эритроидного ростка и ограничивается продукция эритроцитов. При ЛДЖ имеется характерная клиническая картина — сидеропенический синдром, но гемоглобин остается в пределах нормальных значений [10].
По рекомендации ВОЗ (1998) биохимическим маркером ЛДЖ служит уровень СФ, концентрация которого при данном состоянии меньше 12 мкг/л (у детей до 1 года
Н. М. Богданова, кандидат медицинских наук, доцент
Е. М. Булатова, доктор медицинских наук, профессор
Т. В. Габрусская
А. В. Верхососова, главный технолог ЗАО «Завод детских мясных консервов «Тихорецкий»»
СПбГПМА, Санкт-Петербург
Коррекция дефицита железа у детей
Целью терапии железодефицитной анемии (ЖДА) является устранение дефицита железа и восстановление его запасов в организме. Добиться этого можно только при ликвидации причины, лежащей в основе ЖДА в организме.

Основные принципы лечения ЖДА сформулированы Л. И. Идельсоном в 1981 г.:
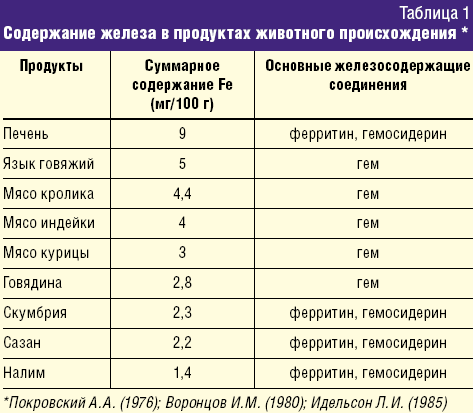
Ранее существовало мнение, что дефицит железа можно устранить назначением диеты, содержащей яблоки, гречневую крупу, гранаты и другие продукты растительного происхождения, содержащие железо. Однако в 60-е гг. ХХ века исследователями было доказано, что железо, содержащееся в продуктах в виде гема (мясо, печень, рыба), лучше усваивается в организме, чем из других соединений. Около 90% железа всасывается в 12-перстной кишке, остальное – в верхнем отделе тощей кишки. При железодефицитных состояниях абсорбционная поверхность тонкого кишечника увеличивается. Железо всасывается в 2-х формах:
Количество железа, поступающее в течение суток с пищей, содержит около 10–12 мг железа (гемовое + негемовое), но только 1–1,2 мг микроэлемента из этого количества абсорбируется. Установлено, что биодоступность гемового железа в пищевых продуктах более высокая, чем из негемовых соединений, и составляет 25–30%.
Большая часть поступающего с пищей железа представлена негемовой формой. Биодоступность железа из злаковых, бобовых, клубневых, овощей и фруктов значительно ниже, чем из гемовых соединений, и во многом зависит от преобладания в рационе факторов, ингибирующих либо потенцирующих кишечную ферроабсорбцию (табл. 3).
Несмотря на высокое содержание железа в части продуктов растительного происхождения, они не в состоянии обеспечить им организм ребенка. Присутствующие в продуктах питания растительного происхождения вещества (танины, фитины, фосфаты) образуют с Fe (III) нерастворимые соединения и выводятся с калом. Имеются также сведения о неблагоприятном влиянии на абсорбцию железа пищевых волокон, которыми богаты крупы, свежие овощи, фрукты. В кишечнике пищевые волокна практически не перевариваются, железо фиксируется на их поверхности и выводится с калом. Напротив, повышают биодоступность железа аскорбиновая кислота, животный белок (мясо, рыба), которые увеличивают абсорбцию микроэлемента. Необходимо отметить также, что продукты из мяса, печени, рыбы, в свою очередь, увеличивают всасывание железа из овощей и фруктов при одновременном их применении.
Полноценная и сбалансированная по основным ингредиентам диета позволяет лишь «покрыть» физиологическую потребность организма в железе, но не устранить его дефицит.
Естественной профилактикой ЖДА у детей первых месяцев жизни является исключительно грудное вскармливание до 4–6 мес. Известно, что концентрация железа в женском молоке составляет всего 0,2–0,4 мг/л, однако абсорбция железа из него достигает 50%, что обеспечивает потребность ребенка первых 4–6 мес. К моменту удвоения массы тела ребенка (5–6 мес) антенатальные запасы железа в его организме истощаются.
С целью профилактики ЖДА при искусственном вскармливании целесообразно у детей, относящихся к группе риска по развитию ЖДА, использовать смеси, обогащенные железом. Они назначаются доношенным детям, относящимся к группе риска (из двойни, тройни, имеющих большую прибавку в массе), начиная с 3–5 мес жизни, а недоношенным – с 1,5–2 мес. Содержание железа в смесях для искусственного вскармливания детей первого полугодия жизни составляет 3–5–8 мг/л смеси, а для детей второго полугодия – 10–14 мг/л.
Включение в питание детей продуктов прикорма, обогащенных железом (фруктовые соки, фруктовые и овощные пюре, инстантные каши), заметно повышает количество железа, поступающего с пищей в организм ребенка.
Детям в возрасте 4–6 мес, находящимся на грудном вскармливании, и младенцам после 6 мес жизни, не получающим обогащенное железом питание, целесообразно назначать препараты железа в профилактической дозе 1–2 мг/кг/день до 12–18 мес жизни.
ЖДА у детей раннего возраста связывают с ранним использованием в пищу коровьего или козьего молока, содержащего высокий уровень белка. Следует отметить, что развитие ЖДА у этих детей связано не только с низким уровнем железа в коровьем молоке, плохим его усвоением, но и потерей железа за счет микродиапедезных кишечных кровотечений. Многочисленными исследованиями отмечена взаимосвязь между количеством употребляемого неадаптированного продукта (молока, кефира) и степенью выраженности микродиапедезных кишечных кровопотерь у младенцев. Отмечено, что чувствительность к неадаптированным продуктам уменьшается с возрастом и после 2-х лет жизни микродиапедезных кишечных кровотечений на фоне приема коровьего молока не отмечается. Механизм, лежащий в основе повышенной экскреции гемоглобина с калом на фоне приема неадаптированных молочных продуктов, у детей раннего возраста точно не известен. Часть авторов связывают микродиапедезные кишечные кровотечения с непереносимостью белков коровьего молока.
Выбору препарата для коррекции ЖДА придается особое значение, поскольку длительность лечения может составлять от нескольких недель до нескольких месяцев. При этом важны не только эффективность, но и отсутствие побочных эффектов и осложнений, приверженность к проводимой терапии, особенно в педиатрической практике.
В настоящее время все препараты железа разделяют на две группы (табл. 4):
Терапия железодефицитных состояний должна быть направлена на устранение причины и одновременное восполнение дефицита железа лекарственными Fe-содержащими препаратами.
Терапия железодефицитных состояний должна проводиться преимущественно препаратами железа для приема внутрь.
Пероральный прием препаратов Fe:
Парентеральное введение препаратов железа показано лишь по специальным показаниям (синдром нарушенного кишечного всасывания, состояние после обширной резекции тонкого кишечника).
Требования к препаратам железа для приема внутрь, применяемым в детской практике:
Детям раннего возраста предпочтительно назначение железосодержащих препаратов, выпускаемых в форме капель, сиропа. Хороши для детей этой возрастной группы Актиферрин (капли, сироп), Мальтофер (капли, сироп), Феррум Лек (сироп), Гемофер (капли) (табл. 5).
Для детей подросткового возраста лучше всего назначать препараты железа типа Феррум Лека (жевательные таблетки) или Тардиферона и Ферроградумента, которые медленно всасываются, обеспечивая пролонгированную и равномерную абсорбцию медикаментозного железа в кишечнике. Как правило, эти препараты хорошо переносятся больными.
После выбора железосодержащего препарата и способа его применения необходимо определить ежедневную суточную дозу лекарственного средства и кратность приема (табл. 6).
Рекомендуемые дозы двухвалентного железа рассчитаны на основе данных, свидетельствующих, что лишь 10–15% поступающего в организм железа всасывается.
Препараты железа (III) – ГПК используются у детей с ЖДА разного возраста в терапевтической дозе 5 мг/кг/сут.
При латентном дефиците железа все препараты железа используются в половинной терапевтической дозе.
Профилактические дозы препаратов железа:
Известно, что лечение солевыми препаратами может сопровождаться расстройствами стула, в связи с чем терапию препаратами двухвалентного железа необходимо начинать с дозы, равной 1/4–1/2 от расчетной терапевтической, с последующим постепенным достижением полной дозы в течение 7–14 дней. Темп «постепенного наращивания» дозы до терапевтической зависит как от выраженности дефицита железа, так и от состояния желудочно-кишечного тракта и индивидуальной переносимости препарата. Данная методика позволяет подобрать индивидуальную дозу в зависимости от переносимости и снизить риск побочных эффектов терапии солевыми препаратами железа.
Хорошо известно, что солевые препараты железа в просвете кишечника взаимодействуют с компонентами пищи, лекарствами, затрудняя абсорбцию железа. В связи с этим солевые препараты железа рекомендуют назначать за 1 ч до приема пищи. Назначение препаратов Fe (III) – ГПК не требует применения методики постепенного наращивания дозы. Препараты этой группы назначаются сразу в полной дозе вне зависимости от еды, поскольку пища не влияет на их абсорбцию.
Терапевтический эффект при пероральном приеме железа появляется постепенно. Вначале отмечается клиническое улучшение и лишь спустя некоторое время происходит нормализация гемоглобина. Первым положительным клиническим признаком, появляющимся при лечении препаратами железа, является исчезновение или уменьшение мышечной слабости. Последнее обусловлено тем, что железо входит в состав ферментов, участвующих в сокращении миофибрилл. На 10–12 день от начала лечения повышается содержание ретикулоцитов в периферической крови. Повышение гемоглобина может быть постепенным либо скачкообразным. Чаще всего начало подъема уровня гемоглобина происходит на 3–4 нед от начала терапии. Как показали многочисленные исследования, исчезновение клинических проявлений заболевания отмечается к 1–2 мес терапии, а исчезновение тканевой сидеропении наступает на 3–6 мес лечения. Суточная доза элементарного железа после нормализации уровня гемоглобина должна соответствовать 1/2 терапевтической дозы (табл. 7). Раннее прекращение лечения препаратами железа, как правило, приводит к рецидивам ЖДА. Длительность основного курса лечения препаратами железа составляет 6–10 нед в зависимости от степени тяжести выявленной железодефицитной анемии. Продолжительность профилактического курса препаратами железа с целью создания депо железа в организме составляет:
Критерии эффективности лечения препаратами железа:
Рефрактерность железодефицитной анемии обусловлена неадекватностью назначаемой терапии или анемией, не связанной с дефицитом железа!
Парентеральные препараты при лечении железодефицитной анемии должны использоваться только по строгим показаниям!
Показания к парентеральному введению препаратов железа:
Парентеральные препараты лучше использовать не ежедневно, а с интервалом в 1–2 дня. При этом в первые 1–3 введения можно использовать половинную дозу.
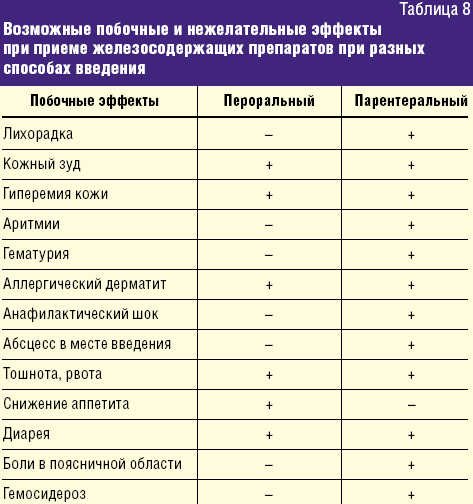
Учитывая длительность проведения ферротерапии, выбор препаратов для коррекции ЖДА у детей раннего возраста требует особого внимания. Как солевые препараты железа, так и препараты Fe(III) — ГПК полимальтозного комплекса являются эффективными при терапии ЖДС. Побочные и нежелательные явления при пероральной ферротерапии ЖДА в основном связаны с превышением рекомендуемых доз и чаще проявляются диспепсией. Побочные реакции и нежелательные эффекты, которые могут развиться при ферротерапии у детей, суммированы в таблице 8.
Парентеральные препараты железа должны применяться только строго по специальным показаниям.
Переливания крови или эритроцитарной массы при ЖДА проводятся крайне редко и строго по жизненным показаниям. Критериями для гемотрансфузии является снижение гемоглобина ниже критического уровня в сочетании с признаками нарушения центральной гемодинамики, геморрагического шока, анемической прекомы, гипоксического синдрома (табл. 9). Гемотрансфузия может проводиться и при значениях гемоглобина и гематокрита выше критических, если имеет место массивная острая кровопотеря.
Эффект от гемотрансфузий при ЖДА кратковременный. Отмечено отрицательное влияние гемотрансфузий на эритропоэз. К тому же сохраняется высокий риск трансфузионного инфицирования реципиента. При наличии витальных показаний для заместительной гемотрансфузии предпочтение отдается эритроцитарной массе или отмытым эритроцитам из расчета 10–15 мл/кг массы. Детям старшего возраста обычно переливают от 150 до 250 мл. Цельную кровь в последние годы в педиатрической практике не используют.
Профилактика ЖДА у детей включает:
1. Антенатальную профилактику:
2. Постнатальную профилактику:
Вакцинация детей с ЖДА проводится после нормализации уровня гемоглобина.
Снятие с диспансерного учета осуществляется через год.
И. Н. Захарова, доктор медицинских наук, профессор
Н. А. Коровина, доктор медицинских наук, профессор
А. Л. Заплатников, доктор медицинских наук, профессор
Н. Е. Малова, кандидат медицинских наук
РМАПО, Москва