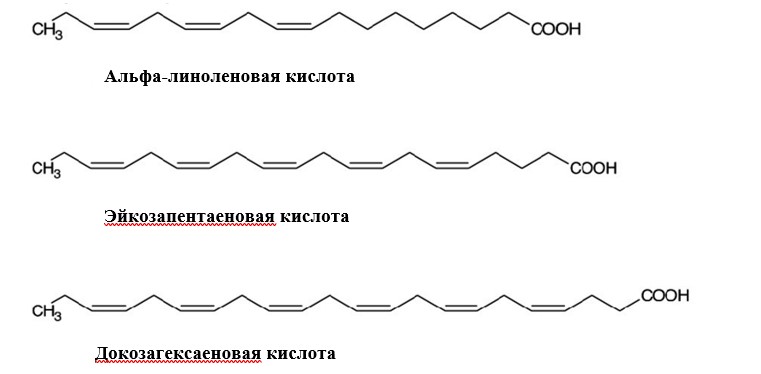
какая жирная кислота является предшественником эйкозаноидов как противо так и провоспалительных
Роль омега-6 и омега-3 жирных для организма больного человека
Но активность ферментов, которые превращают одни омега-кислоты в другие у разных людей сильно отличается. Чтобы не возник дефицит каких-либо из этих кислот – особенно омега-3 – все они должны присутствовать в пище.
Какую роль ПНЖК играют в организме?
Являются предшественниками сигнальных веществ, которые регулируют процесс воспаления и работу гладких мышц организма, влияют на иммунитет и жировой обмен.
Служат источником энергии.
Чем отличается действие омега-3 и омега-6?
1. Что такое омега-6, какое действие оказывают на организм
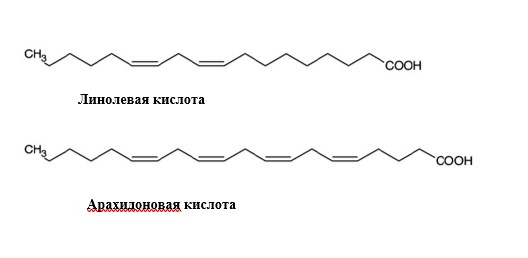
В организме из линолевой кислоты получается арахидоновая кислота. Она может и поступать с едой.
2. Что такое омега-3, какое действие оказывают на организм
Кроме альфа-линоленовой кислоты к омега-3 относятся еще две ненасыщенные кислоты, важные для нормальной работы организма:
В чем особенность их роли в организме?
Докозагексаеновая кислота преимущественно встречается в мембранах клеток сетчатки глаза и участках мембран нервных клеток, которые отвечают за восприятие нервного импульса. Поэтому омега-3 важны для нормального зрения и работы нервной системы.
Из эйкозапентаеновой кислоты тоже получаются эйкозаноиды, как и из омега-6. Но их строение и функции немного отличаются от последних. Они регулируют скорее конечную стадию воспалительного процесса, «выключая» его. Поэтому считается, что омега-3 кислоты проявляют противовоспалительное действие.
3. Какое соотношение омега-6 и омега-3 жирных кислот должно быть в питании больного человека, и почему это важно?
Чтобы еда способствовала нормальному самочувствию, она должна быть в целом сбалансированной. То же самое работает и для частного случая: соотношение незаменимых жирных кислот в пище.
Считается, что потребности в омега-кислотах удовлетворяются, когда в рационе достаточно жирной океанической рыбы и растительных масел (нерафинированных, холодного отжима).
Но бывает ситуация, когда человек не может есть «правильные» продукты. Например, онкологическим больным трудно питаться полноценно. Из-за лучевой и химиотерапии у них воспаляются слизистые рта и глотки, меняются вкусовые ощущения. Полезная еда может показаться несъедобной. Чтобы они могли питаться полноценно, есть лечебные продукты питания с нейтральным вкусом.
4. Соотношение омега-6 к омега-3 в продукте Нутриэн Форт очень хорошее и подходит для онкологических больных
Гиперкалорийная смесь Нутриэн Форт (Nutrien Fort) разработана для поддержки онкологических больных. Ее можно пить как напиток или использовать как энтеральное питание.
Она содержит незаменимые кислоты, причем в ней много более дефицитных омега-3. Это может помочь в сдерживании воспалительного процесса, который всегда есть во время борьбы организма с опухолью.
Какая жирная кислота является предшественником эйкозаноидов как противо так и провоспалительных
Наиболее распространенными воспалительными заболеваниями дыхательных путей являются бронхиальная астма (БА) и хроническая обструктивная болезнь легких (ХОБЛ) [1, 2]. Участниками воспаления при ХОБЛ и БА выступают многие факторы – нейтрофилы, Т-лимфоциты, альвеолярные макрофаги, тучные клетки, свободные радикалы кислорода, цитокины, хемокины, протеазы и др. [1, 2]. Природа воспалительной реакции и механизмы обструкции ХОБЛ и БА заметно отличаются друг от друга: при БА воспаление эозинофильного характера и контролируется CD4+ лимфоцитами, при ХОБЛ в воспалительный процесс вовлекаются нейтрофилы, макрофаги и CD8+ лимфоциты [4]. Однако несмотря на явные различия в самом паттерне воспаления, БА и ХОБЛ имеют некоторые общие черты в клинических проявлениях, подходах к профилактике и лечению, что подразумевает схожий патогенетический механизм детерминации, как иммунных осложнений, так и метаболических сдвигов.
Важное место в клеточно-молекулярных механизмах регуляции воспалительной реакции при БА и ХОБЛ отводится полиненасыщенным жирным кислотам (ПНЖК) и их биологически активным оксипроизводным (эйкозаноиды, проразрешающие медиаторы), проявляющим широкий спектр биологической активности [9, 10]. Эйкозаноиды локально регулируют функции эндотелия, гладкомышечных клеток, реакцию вазодилатации, агрегацию тромбоцитов, микроциркуляцию и воспаление [3, 11]. Появились данные о новых эндогенных специализированных проразрешающих медиаторах – производных эйкозапентаеновой, докозагексаеновой кислот – резолвинов, маресинов, протектинов, липоксинов [8]. Предполагается, что эти медиаторы играют ключевую роль в сдерживании и разрешении воспаления.
Известно, что в патогенезе БА большое значение отводится цистеиновым лейкотриенам и простагландину D2, которые являются мощными бронхоконстрикторами, вызывают гиперреактивность и отек бронхов, изменяют секрецию слизи, участвуют в привлечении Th2-клеток в дыхательные пути [2]. Значение метаболитов ПНЖК в механизме развития ХОБЛ менее изучено [9, 12]. Считается, что гиперсекреция слизи при ХОБЛ является результатом стимуляции лейкотриенами секретирующих клеток. В тоже время неактивность тучных клеток, главных продуцентов эйкозаноидов, является причиной отсутствия бронхоспазма [6]. Основным поставщиком жирных кислот для тканей и клеток являются свободные жирные кислоты (СЖК) плазмы крови. Липидный состава диеты, изменение процессов липолиза, транспорта липидов может серьезным образом сказаться на тканевом и клеточном гомеостазе ПНЖК, биосинтезе эйкозаноидов и проразрешающих медиаторов. В свою очередь дисбаланс синтеза биологически активных оксипроизводных ПНЖК инициирует патогенетические механизмы развития и прогрессирования воспалительных процессов, бронхообструкции [5, 12]. Нарушение состава ЖК в плазме и клетке, а также их метаболизма может являться важным фактором нарушения регуляторных механизмов воспалительного процесса, развития и прогрессирования БА и ХОБЛ.
Цель работы: изучить метаболические превращения жирных кислот у больных БА и ХОБЛ в период клинической ремиссии по характеру модификации состава свободных жирных кислот (СЖК) плазмы крови и ЖК мембран эритроцитов; установить значение жирных кислот в механизме развития воспалительной реакции при хронических заболеваниях легких.
Материалы и методы исследования
В исследовании приняли участие 65 человек, из них 45 пациентов с заболеваниями бронхолегочной системы (21 муж. и 13 жен.) в возрасте 23–57 лет (37,4 ± 2,3 лет), в том числе 25 пациентов с контролируемой БА легкой степени тяжести, принимавших базисную терапию; 20 больных ХОБЛ легкой степени стабильного течения. Обследование пациентов проводили после подписания информированного согласия и в соответствии со стандартами Хельсинкской декларации (2008). Заболевания диагностировали на основании анамнестических данных, объективного осмотра, лабораторных исследований, спирометрии с выполнением бронхолитического теста (спирограф «FUKUDA», Япония) и результатов тестов САТ, ACQ-5. Диагноз ХОБЛ выставляли согласно Глобальной стратегии: диагностика, лечение и профилактика ХОБЛ (GOLD 2011), диагноз БА – Глобальной стратегии лечения и профилактики БА (GINA 2011) [1, 2]. В контрольную группу вошли 20 здоровых добровольцев в возрасте 23–55 лет (32,2 ± 8,2 лет), не курящих и никогда не куривших, без отягощенного аллергического анамнеза. У пациентов с контролируемой БА определялись нормальные значения показателя объема форсированного выдоха за 1-ю секунду (ОФВ1, 96,60 ± 5,77 % от должного), пиковой скорости выдоха (ПСВ, 89,00 ± 2,1 % от должного), постбронходилятационный прирост ОФВ1 составил 100,0 мл и 8,8 %, ACQ-5 тест = 0,5 баллов. У пациентов с ХОБЛ легкой степени тяжести определялось снижение постбронходилятационного показателя ОФВ1/ФЖЕЛ (0,65 ± 0,03), ОФВ1 составил 88,4 ± 3,38 % от должного, результат теста САТ 8 баллов. Критериями исключения являлись наличие профессиональных заболеваний бронхолегочной системы, сердечно-сосудистых заболеваний (ишемическая болезнь сердца, гипертоническая болезнь) и их осложнений, сахарного диабета, заболеваний щитовидной железы, острых патологических состояний и обострений хронических болезней.
Характер воспалительного процесса оценивали по состоянию клеточного иммунитета, уровню секреции цитокинов, иммуноглобулина Е (IgE) в сыворотке крови. Параметры клеточного иммунитета определяли методом проточной цитофлуориметрии с использованием набора «BD Multitest 6-color TBNK» (BD, USA). Цитокиновый профиль (фактор некроза опухоли-α (TNF-α), интерлейкин-4 (IL-4), интерферон гамма (IFN-γ)) исследовали методом проточной цитометрии на цитометре «Facscanto II» (тест-системы фирмы BD, USA). Уровень общего IgE в сыворотке крови определяли иммуноферментным методом с использованием набора фирмы «ХемаМедика».
Мембраны эритроцитов получали путем гемолиза клеток дистиллированной водой и центрифугированием 15 мин при 14000 об/мин в растворе PBS с трехкратным промыванием. Липиды из плазмы крови и мембран эритроцитов экстрагировали по методу Блайя и Дайера [9]. Метиловые эфиры ЖК получали по методу Карро и Дюбак, анализировали на газожидкостном хроматографе Shimadzu GC-2010 (Япония) с пламенно-ионизационным детектором. Идентификацию пиков проводили по значениям эквивалентной длины цепи. Результаты выражали в процентах от суммы ЖК.
Для анализа полученных данных использовалась прикладная программа «Statistiсa», версия 6,1 (серия 1203С для Windows). Статистическую значимость различий средних величин определяли по t-критерию Стьюдента.
Результаты исследования и их обсуждение
Анализ иммунологических показателей больных БА и ХОБЛ выявил наличие различного характера нарушений во всех звеньях иммунной системы, несмотря на клиническую ремиссию (табл. 1). У пациентов с БА наблюдалось угнетение Т-клеточного звена иммунитета и продукции IFN-γ, повышение уровня TNF-α и IL-4, что свидетельствует о сохранении воспалительного процесса в период ремиссии за счет поддержания активированного Th2 типа иммунного ответа. У больных ХОБЛ, напротив, выявили активацию Т-клеточного звена иммунитета по Th1 типу, на фоне истощения функциональной активности В-лимфоцитов, повышения экспрессии TNF-α и IFN-γ при низких показателях противовоспалительного цитокина – IL-4. Полученные результаты исследования показали, что формирование персистирующего воспаления при БА и ХОБЛ происходит в результате нарушения разных регуляторных механизмов иммунного ответа. Течение системного воспаления в период ремиссии при БА продолжается по Th2 типу иммунного ответа, при ХОБЛ – по Th1 пути иммунной регуляции.
Определяющее значение в регуляции персистенции и разрешения воспалительного процесса при заболеваниях бронхолегочной системы выполняют жирные кислоты и их метаболиты [5, 8, 10, 12]. В данном исследовании метаболические превращения жирных кислот оценивали по характеру модификации СЖК плазмы крови, ЖК эритроцитов больных БА и ХОБЛ.
У пациентов с БА результаты исследования показали существенные различия в содержании полиненасыщенных СЖК плазмы крови по сравнению с группой контроля (табл. 2, значение показателей СЖК отмечено в числителе). Выявлено уменьшение содержания α-линоленовой кислоты (18:3n-3) на фоне повышения доли n-6 ПНЖК: дигомо-γ-линолевой (20:3n-6), арахидоновой (20:4n-6) и ее метаболитов – докозатетраеновой (22:4n-6) и докозапентаеновой (22:5n-6). Среди n-3 ПНЖК показано накопление эйкозапентаеновой ЖК (20:5n-3). В группе больных ХОБЛ изменение содержания n-6 ПНЖК имело ту же направленность, что и у пациентов с БА (увеличение доли 20:3n-6, 20:4n-6, 22:4n-6). Однако, в отличие от пациентов с БА у больных ХОБЛ отмечено уменьшение 20:5n-3 и 22:6n-3.
Таблица 1
Показатели иммунного статуса у больных ХОБЛ и БА
Омега-3 полиненасыщенные жирные кислоты в профилактике и лечении болезней детей и взрослых
Как показывают результаты исследований последних лет, полиненасыщенные жирные кислоты (ПНЖК) являются важным эссенциальным фактором питания в связи с их участием в формировании мембран клеток головного мозга, зрительного анализатора и биологических
Как показывают результаты исследований последних лет, полиненасыщенные жирные кислоты (ПНЖК) являются важным эссенциальным фактором питания в связи с их участием в формировании мембран клеток головного мозга, зрительного анализатора и биологических мембран других органов и тканей [1]. Напомним, что жирные кислоты (ЖК), являясь основным компонентом всех видов липидов, различаются по длине углеродной цепи (короткоцепочечные, среднецепочечные, длинноцепочечные), по наличию двойных связей (насыщенные, мононенасыщенные и ПНЖК: ди-, три-, тетра-, пента- и гексаеновые) (табл. 1).
В зависимости от расположения первой двойной связи у 3, 6, 7 или 9-го атома углерода относительно метильного конца молекулы ПНЖК делятся на семейства ω-3, ω-6, ω-7 и ω-9 соответственно [2].
Синтез насыщенных ЖК происходит в клетках печени, стенки кишечника, легочной и жировой ткани, в тканях мозга, почек, лактирующей молочной железы путем последовательного удлинения углеродной цепи, а затем, под действием ферментов-десатураз, может идти образование моноеновых ЖК (например, олеиновой кислоты 18:1 семейства ω-9). Однако организм человека не способен синтезировать линолевую (18:2 семейства ω-6) и a-линоленовую (18:3 семейства ω-3) кислоты, которые являются вследствие этого незаменимыми для человека и должны поступать с пищей [2]. Основные источники ПНЖК приведены в таблице 2, из которой видно, что источниками ПНЖК семейства ω-6 являются преимущественно различные растительные масла, тогда как ПНЖК ω-3 в больших количествах встречаются в рыбе, морепродуктах, яичном желтке [3, 4].
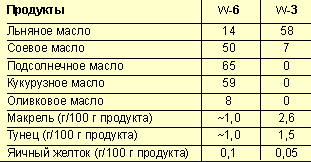 |
| Таблица 2. Основные источники незаменимых ПНЖК (% от общего содержания жира) |
Однако, попадая в организм, незаменимые ЖК способны метаболизироваться с помощью процессов десатурации и элонгации в более длинноцепочечные и ненасыщенные производные. Все ПНЖК — производные линолевой кислоты относят к семейству ω-6, а производные a-линоленовой кислоты — к семейству ω-3. Процессы десатурации и элонгации идут с участием соответствующих ферментов — десатураз и элонгаз, общих для представителей различных семейств ЖК, вследствие чего они конкурируют за указанные ферменты, а соотношение в диете и организме ЖК разных семейств определяет преимущественное образование производных того или иного семейства. Это обстоятельство является важным, поскольку оказывает влияние на проявление присущей ПНЖК регуляторной функции, которая связана с образованием из ЖК с 20 углеродными атомами (эйкозановых) биологически активных веществ — эйкозаноидов [5]. Синтез эйкозаноидов из ПНЖК может идти по двум основным путям — циклооксигеназному и липоксигеназному (рис. 1).
Под действием фермента циклооксигеназы образуются простаноиды (простагландины, простациклины и тромбоксаны), а ферментов липоксигеназ — лейкотриены, гидроксиэйкозатетроеноаты и липоксины. Как видно из рисунка 2, предшественниками эйкозаноидов являются дигомо-α-линоленовая кислота (С20:3 ω-6), арахидоновая (АК) (С20:4 ω-6) и эйкозапентаеновая (С20:5 ω-3) кислоты (ЭПК). Из первой образуются простаноиды 1-й серии, из АК — простаноиды 2-й серии и лейкотриены 4-й серии; ЭПК метаболизируется в простаноиды 3-й серии и лейкотриены 5-й серии. ЖК разных классов конкурируют и за ферменты, участвующие в синтезе эйкозаноидов. Способность различных ЖК образовывать различные классы эйкозаноидов, в свою очередь оказывающих множественные физиологические воздействия на организм взрослых и детей, предопределяет возможность активного влияния ПНЖК-рационов на многие физиологические функции в организме, или иначе регуляторные функции ПНЖК [2, 7].
Интересно, что простаноиды и лейкотриены разных серий, образованные из разных предшественников, выполняют сходные биологические функции, однако интенсивность их действия существенно отличается. В ряде случаев простаноиды и лейкотриены разных серий оказывают прямо противоположное воздействие на клетки-мишени [5]. Кроме того, образование эйкозаноидов, до некоторой степени, — тканеспецифичный процесс. Так, простациклин образуется клетками сосудистого эндотелия, тромбоксаны — тромбоцитами; простагландины вызывают сокращение гладкой мускулатуры, стимулируют или ингибируют адгезию тромбоцитов и вызывают сокращение или расслабление стенок артерий и тем самым влияют на кровяное давление. Тромбоксаны вызывают агрегацию тромбоцитов, увеличивают свертываемость крови, повышают кровяное давление, вызывая сокращение стенок артерий. Лейкотриены вызывают сокращение гладкой мускулатуры бронхов, кишечника и сосудов, стимулируют или подавляют образование в печени положительных реактантов острой фазы воспаления. Некоторые эйкозаноиды действуют как хемотаксические агенты, стимулируя или подавляя активность отдельных звеньев иммунной системы [2].
Эйкозаноиды играют важную роль в развитии неспецифической системной воспалительной реакции.
Под действием инфекционных агентов или других триггеров воспаления активируется фермент фосфолипаза А2, отщепляющая от мембранных фосфолипидов АК либо ЭПК, или при их отсутствии эйкозатриеновую кислоту (20:3 ω-9), из которых под действием циклооксигеназы и липоксигеназы образуются простаноиды и лейкотриены соответствующих серий. Под действием простагландинов и лейкотриенов активируются клетки иммунной системы — участники воспаления: макрофаги, нейтрофилы, Т- и В-лимфоциты. Наиболее сильным провоспалительным действием обладают простагландин Е2 и лейкотриен В4. Активированные клетки вырабатывают цитокины и другие регуляторные соединения, приводящие к развитию системной реакции воспаления. Эффекты эйкозаноидов относятся не только к воспалительной реакции, но затрагивают и многие другие физиологические функции, причем действие эйкозаноидов различных серий существенно различается. Так, тромбоксан А2 обладает сильным вазоконстрикторным и агрегирующим действием на тромбоциты, в то время как тромбоксан А3, образующийся из ЭПК семейства ω-3, действует значительно слабее по сравнению с метаболитом семейства ω-6.
В то же время простациклины I2 (PGI2) и I3 (PGI3) обладают примерно одинаковым вазодилатирующим эффектом, в итоге диета, богатая ПНЖК ω-3, изменяя баланс между эйкозаноидами различных классов в сторону повышенного образования ТХА3 и PGI3, оказывает вазодилатирующее и антитромботическое действие. Кроме того, подавление продукции лейкотриена В4 при использовании такой диеты ведет к уменьшению выработки фактора агрегации тромбоцитов, фактора некроза опухоли и интерлейкина–1β под действием простагландина Е3.
Приведенные данные о способности ПНЖК ω-3 выступать в качестве предшественников различных классов физиологически активных эйкозаноидов лежат в основе использования ПНЖК ω-3 в профилактике и комплексной терапии целого ряда заболеваний у детей и взрослых. Первые публикации о связи между высоким уровнем потребления жирных сортов рыбы, богатой ПНЖК ω-3, и более низким уровнем триглицеридов в крови у эскимосов по сравнению с датчанами появились более 30 лет назад в результате эпидемиологических исследований Bang and Dyerberg, 1972, 1976. В 1989 г. в исследовании DART (Burr и соавторы) было показано, что относительно низкие дозы ПНЖК ω-3 снижают риск рецидива сердечно-сосудистых заболеваний.
В 1996 г. в обзоре Harris были проанализированы уже 72 плацебо-контролируемых исследования, в которых использовалась комбинация ЭПК и докозагексаеновой кислоты (ДГК) в количестве от 1 до 7 г в день в течение как минимум 2 нед. Гиполипидемический эффект был продемонстрирован у 25% пациентов с нормальным уровнем липидов в крови и у 28% пациентов с гиперлипидемией. В настоящее время ПНЖК ω-3 используются в профилактике и комплексной терапии следующих патологических состояний:
Терапевтический эффект ПНЖК обусловлен их способностью оказывать следующие воздействия:
Кроме того, ПНЖК ω-3 оказывают влияние на процессы ишемии-реперфузии, продукцию аденозинтрифосфата и функционирование ионных каналов, т. е. затрагивают все основные патогенетические звенья развития сердечно-сосудистых заболеваний (ССЗ).
Возможным объяснением повышения уровня ЛПВП под влиянием ПНЖК ω-3 считают снижение под действием ПНЖК образования крупных липопротеинов очень низкой плотности (ЛПОНП) и увеличение менее атерогенных мелких липопротеинов, которые быстрее переходят в ЛПНП, а также повышение экскреции стеролов и желчных кислот с калом.
Предполагают также, что ПНЖК модифицируют ЛПВП, влияя на текучесть их липидов и на движение холестерина внутрь этих частиц, в результате чего облегчается удаление холестерина из клетки и реализуется антиатерогенный эффект.
Возможными механизмами гипотриглицеридемического действия могут быть снижение (более чем на 50%) синтеза хиломикронов в кишечнике, облегчение контакта ненасыщенных хиломикронов с липопротеинлипазой, снижение синтеза триглицеридов в печени [8–10]. Установлено также, что ПНЖК ω-3 связываются с факторами транскрипции генов PPAR (peroxisome proliferato-activated receptor), активирующего окисление ЖК, и SREBP (sterol regulatory element binding protein), регулирующего пути синтеза триглицеридов, активируя их, снижая синтез и усиливая катаболизм ЖК. В результате снижается синтез триглицеридов и выход ЛПОНП из печени в кровоток.
Все это обусловливает широко известную положительную роль ПНЖК в профилактике и лечении ССЗ, за счет их гипохолестеринемического, гипотриглицеридемического, антиатерогенного и тромболитического действия [11, 12]. Так, например, при исследовании 1000 жителей Индии с высоким риском ишемической болезни сердца, в ходе которого участники, выбранные случайным путем, получали средиземноморскую диету, богатую цельнозерновыми продуктами, фруктами, овощами, грецкими орехами, миндалем, либо традиционную диету, в группе со средиземноморской диетой дневное потребление α-линоленовой кислоты было в 2 раза больше, чем в группе контроля. За 2 последующих года у лиц, получавших средиземноморскую диету, было зарегистрировано меньше ССЗ (39 против 76, р Таблица 3. Рекомендуемые нормы потребления ПНЖК ω-3, г в день
При этом с пищей не должно поступать жиров более 30% от общего количества калорий. Исходя из этого, рекомендуется, чтобы с ПНЖК поступало менее 8% калорий, с соотношением ω-6/ω-3 в пределах 5:1–3:1. Необходимо также помнить, что из-за участия ПНЖК в процессах перекисного окисления липидов их желательно принимать одновременно с антиоксидантами (токоферол и др.).
Учитывая, что пищевые источники ПНЖК ω-3 довольно ограничены и соотношение ПНЖК ω-6/ω-3 в рационе современного человека далеко от оптимального, в настоящее время разработаны и присутствуют на рынке в большом количестве биологически активные добавки к пище, обогащающие рацион ПНЖК. Перечислим некоторые из них, содержащие ПНЖК ω-3.
Литература
И. Я. Конь, доктор медицинских наук, профессор
Н. М. Шилина, кандидат биологических наук
С. Б. Вольфсон
НИИ питания, Москва
Какая жирная кислота является предшественником эйкозаноидов как противо так и провоспалительных
СПБ ГУЗ “Городской клинический онкологический диспансер”, кафедра онкологии ФПО Санкт-Петербургского государственного медицинского университета им. И.П. Павлова
Жирные кислоты крови в формировании и коррекции метаболического синдрома
Журнал: Терапевтический архив. 2016;88(8): 30-34
Новгородцева Т. П., Денисенко Ю. К., Антонюк М. В., Юбицкая Н. С., Лобанова Е. Г., Жукова Н. В. Жирные кислоты крови в формировании и коррекции метаболического синдрома. Терапевтический архив. 2016;88(8):30-34.
Novgorodtseva T P, Denisenko Yu K, Antoniuk M V, Yubitskaya N S, Lobanova E G, Zhukova N V. Blood fatty acids in the development and correction of metabolic syndrome. Terapevticheskii Arkhiv. 2016;88(8):30-34.
https://doi.org/10.17116/terarkh201688830-34
СПБ ГУЗ “Городской клинический онкологический диспансер”, кафедра онкологии ФПО Санкт-Петербургского государственного медицинского университета им. И.П. Павлова
В соответствии с современными представлениями метаболический синдром (МС) характеризуется наличием центрального ожирения, снижением чувствительности периферических тканей к инсулину и гиперинсулинемией. Актуальность проблемы обусловлена тем, что все составляющие МС являются установленными факторами риска развития сердечно-сосудистых заболеваний (ССЗ), сочетание этих факторов многократно ускоряет развитие атеросклероза и сахарного диабета (СД) 1.
Существует несколько гипотез развития МС, из которых ведущей является теория инсулинорезистентности [1, 3]. По мнению ряда авторов, формированию резистентности к инсулину предшествует дефицит в клетках эссенциальных полиненасыщенных жирных кислот (ПНЖК), одной из причин которого может быть нарушение их активного рецепторного (апо В/100) транспорта в составе липопротеидов [4, 5]. Эндогенный недостаток в клетках ПНЖК приводит к изменению физико-химических свойств плазматических мембран, понижению их жидкостности, нарушению функционирования рецепторов к инсулину и транспортных систем поступления в клетку глюкозы.
Ввиду большого значения МС в развитии сердечно-сосудистых осложнений профилактика последних должна быть направлена на выявление пациентов с высоким риском развития ССЗ и коррекцию образа жизни таких лиц [2]. В качестве вспомогательного средства для профилактики ССЗ и метаболических нарушений (дислипидемия) применяются препараты, содержащие ω-3 ПНЖК [2]. Это обусловлено гиполипидемическими, антиатерогенными свойствами ω-3 ПНЖК, их модифицирующим влиянием на активность мембраносвязанных ферментов, биосинтез эйкозаноидов [7, 8]. Известные биологические эффекты ω-3 ПНЖК обосновывают использование содержащих их липидных препаратов в профилактике и лечении ишемической болезни сердца, АГ, СД 2-го типа и др.
Цель исследования: изучить состав ЖК плазмы, эритроцитов и уровень эйкозаноидов у пациентов с МС и оценить возможность коррекции метаболических нарушений при курсовом применении препарата ω-3 ПНЖК.
Материалы и методы
Уменьшение содержания арахидоновой и эйкозапентаеновой кислот в эритроцитах указывает на нарушение в эйкозаноидном цикле и увеличение синтеза оксилипинов с выраженными вазоконстрикторными (тромбоксан А2) и провоспалительными (лейкотриен В4) свойствами.
Действительно, исследование уровней эйкозаноидов в сыворотке крови у пациентов с МС показало повышение концентраций 6-кето-простагландина F1α (р