Ламиктал или ламотриджин что лучше
Сравнительная эффективность препаратов ламотриджинового ряда
Г. Авакян, доктор медицинских наук, профессор, О. Бадалян, доктор медицинских наук, Р. Биктимеров, О. Варашкевич, Е. Крикова, Ф. Ридер, кандидат медицинских наук, Ю. Тихонов, кандидат медицинских наук, С. Бурд, доктор медицинских наук
РГМУ
С ростом в последние годы затрат в сфере практического здравоохранения все чаще встает вопрос об оптимальном выборе лекарственного препарата, у которого клиническая эффективность и безопасность сочетались бы с низкой стоимостью. В связи с этим в клинической практике все большее распространение получают генерики; изучение их сравнительной клинической эффективности и безопасности — одна из наиболее актуальных задач в области клиники, фармацевтики и фармакоэкономики [4, 6, 8, 9].
При эпилепсии вопрос о биоэквивалентности генериков и оригинальных препаратов стоит особенно остро [1], поскольку даже небольшие различия в биодоступности медикаментов могут привести к серьезным последствиям, например возобновлению приступов у пациентов с многолетней медикаментозной ремиссией [6, 9]. Поэтому существуют достаточно жесткие требования соответствия оригинальному лекарственному средству (ЛС), которые включают 3 важнейших компонента, обозначаемые как фармацевтическая, фармакокинетическая и терапевтическая эквивалентность [2, 5, 7]. Фармацевтическая эквивалентность предполагает, что оригинальное и воспроизведенное ЛС содержат одну и ту же активную субстанцию в одинаковых количестве и форме; допустимы лишь отличия по использованным вспомогательным средствам (наполнители, красители, особенности покрытия). Фармакокинетическая эквивалентность (или биоэквивалентность) означает, что биодоступность (скорость и степень всасывания) и метаболизм оригинального и воспроизведенного ЛС после введения в одной и той же молярной дозе сходны в такой степени, что их эффективность и безопасность не могут не быть одинаковыми, а терапевтическая эквивалентность — что оригинальный препарат и генерик по результатам клинических исследований обладают равными эффективностью и безопасностью [5, 12].
Из средств, имеющих генерические аналоги, врачи-эпилептологи используют не только противоэпилептические препараты (ПЭП) первого поколения, но и новые ПЭП. К последним относится ламиктал (действующее вещество — ламотриджин), который показан дополнительно [3, 6, 8] или в качестве монотерапии при парциальных и генерализованных приступах, включая тонико-клонические судороги и приступы, ассоциированные с синдромом Леннокса — Гасто, для взрослых и детей старше 12 лет; в режиме комбинированной терапии эпилепсии может применяться у детей до 12 лет.
Сегодня на российском рынке существует несколько генерических препаратов, активным компонентом которых является ламотриджин; в частности, к ним относится конвульсан производства «Актавис АО», Исландия [5, 6, 8, 11, 14]. Нами в сравнительном аспекте изучены переносимость и клиническая эффективность в режиме монотерапии (таблетки по 25 мг) конвульсана и ламиктала (оригинальный препарат производства «ГлаксоСмитКляйн Фармасьютикалз С. А.», Польша) у 15 пациентов с эпилепсией.
Больные были в возрасте от 20 до 69 лет. Криптогенная фокальная эпилепсия (КФЭ) была у 7 (47%), симптоматическая фокальная эпилепсия (СФЭ) — у 8 (53%) пациентов; длительность заболевания составляла от 6 мес до 42 лет. Диагноз был установлен на основе клинических и инструментальных данных в соответствии с международной классификацией эпилепсии (1989); тип эпилептических приступов также определялся согласно существующей международной классификации (1981). Всем пациентам проводили клиническое неврологическое обследование, электроэнцефалографическое (ЭЭГ) исследование (энцефалограф «МБН-Нейрокартограф», Россия), магнитно-резонансную томографию (МРТ) для верификации структурных изменений головного мозга. Концентрацию ламотриджина в плазме крови для каждого из изучаемых препаратов измеряли методом высокоэффективной жидкостной хроматографии («Altex, Ultrasphere ODS»). Клиническую эффективность препаратов определяли по изменению частоты и тяжести эпилептических приступов, а также косвенно — по оказавшейся эффективной дозе препарата.
В ходе исследования у 15 пациентов, изначально принимавших оригинальный ламотриджин в соответствии со схемой в инструкции по применению, при достижении клинического эффекта (урежение частоты приступов не менее чем на 50%) брали кровь для биохимического анализа (исследовали концентрацию препарата в крови). Параллельно анализировали частоту и тяжесть эпилептических приступов до и после приема оригинального препарата. Оценивали также изменения на ЭЭГ у пациентов до приема препарата и после достижения клинического эффекта. Затем с шагом по 25 мг в 3 дня осуществляли переход на конвульсан в соответствии с инструкцией по медицинскому применению при параллельном снижении дозы оригинального ламотриджина и проводили наблюдения в течение 3 нед: оценивали динамику клинической картины, регистрировали изменения на ЭЭГ на фоне приема конвульсана, брали кровь (из локтевой вены через 3 ч после приема конвульсана, т.е. на пике его концентрации) для определения концентрации препарата в плазме, оценивали переносимость и безопасность препарата на основании жалоб пациентов.
Доза препаратов ламотриджинового ряда, принимаемых пациентами, составила от 50 до 250 мг/сут. Эффективность действия препарата оценивали по урежению частоты эпилептических приступов (табл. 1).
Таблица 1
Изменение у больных частоты эпилептических приступов на фоне приема препаратов ламотриджина
| Урежение частоты приступов | ||||
| Форма эпилепсии | на 50% | на 75% | Всего больных | |
| КФЭ | 3 (20) | 2 (13,5) | 2 (13,5) | 7 (47) |
| СФЭ | 3 (20) | 4 (26,5) | 1 (6,5) | 8 (53) |
У пациентов с КФЭ не выявлено структурных изменений на МРТ при наличии фокальных приступов с вторичной генерализацией или без нее. ЭЭГ до лечения оригинальным ламотриджином характеризовалась умеренно выраженными общемозговыми изменениями с нарушением регулярности α-ритма и усилением представленности диффузной медленной активности в диапазоне υ- и δ-волн, наличием (в некоторых случаях) региональной эпилептиформной активности в виде вспышек острых волн, комплексов пик — волна, спайков со вторично-билатеральной синхронизацией или без таковой. Изменения ЭЭГ на фоне приема оригинального ламотриджина характеризовались снижением количества вспышек пароксизмальной и эпилептиформной активности с тенденцией к нормализации основных ритмов и зональных распределений.
Для пациентов с СФЭ были характерны структурные изменения на МРТ и фокальные приступы с вторичной генерализацией или без нее. Регистрировались умеренные изменения биоэлектрической активности головного мозга — дезорганизованный тип ЭЭГ с замедлением основной активности в области структурного дефекта с периодическими вспышками эпилептиформной активности в виде острых волн, спайков с тенденцией к вторично-билатеральной синхронизации. Под влиянием оригинального препарата на ЭЭГ больных СФЭ уменьшились частота регистрации эпилептиформной и пароксизмальной активности и возникновения вторично-билатеральной синхронизации с модуляцией основных ритмов.
При замене оригинального ламотриджина конвульсаном эффективность лечения оценивали, помимо клинических проявлений заболевания (изменение частоты и тяжести приступов), по изменениям на ЭЭГ (уменьшение эпилептиформной активности и снижение ее спектра мощности). Нарастание при приеме оригинального препарата нормальной организации корковой ритмики регистрировалось и при переходе на конвульсан. Значимых различий изучаемых показателей (ухудшение ЭЭГ-картины, нарастание эпилептиформной активности и(или) ухудшение организации корковой ритмики) не выявлено.
До лечения препаратами ламотриджина у пациентов регистрировались следующие типы эпилептических приступов, характерные для фокальных форм эпилепсии: простые парциальные (у 12), сложнопарциальные (у 1) и вторично-генерализованные судорожные (у 2). Как отмечалось выше, на фоне приема оригинального ламотриджина отмечалась положительная тенденция, заключавшаяся в снижении количества и тяжести приступов (табл. 2).
Таблица 2
Клинический эффект при приеме оригинального ламотриджина у пациентов с различными формами фокальной эпилепсии
| Изменение частоты приступов | Формы фокальной эпилепсии | ||
| простые парциальные | сложно-парциальные | вторично-генерализованные судорожные | |
| 12 (80) | 1 (6,7) | 2 (13,3) | |
| Урежение на 50% | 4 (26,4) | 0 | 2(13,3) |
| Урежение на 75% | 5 (33,5) | 1 (6,7) | 0 |
| Медикаментозная ремиссия | 3 (20,1) | 0 | 0 |
Замена оригинального ламотриджина на конвульсан у всех пациентов с 50% урежением приступов и у 5 из 6 пациентов с урежением приступов на 75% не привела к ухудшению состояния (усилению или утяжелению эпилептических приступов), не было также необходимости в увеличении принимаемых доз. Однако у 1 пациента было зарегистрировано увеличение количества приступов в 1,8 раза и усиление их тяжести на фоне приема препарата в дозе 100 мг/сут, что потребовало возвращения больного на оригинальный ламотриджин и выведения его из исследования. В группе пациентов с 100% купированием приступов при переведении с оригинального препарата на конвульсан ухудшения состояния не наблюдалось, т.е. сохранялась медикаментозная ремиссия.
Анализ данных о концентрации препаратов ламотриджинового ряда в крови показал, что независимо от степени урежения приступов различии в концентрации оригинального ламотриджина и конвульсана не было. Полученные результаты позволили разделить пациентов на 3 группы в зависимости от средней эффективной дозы и концентрации препаратов в крови (табл. 3).
Таблица 3
Концентрация препаратов ламотриджинового ряда в плазме крови в зависимости от дозы
| Доза препарата, мг | Концентрация в плазме крови, мг/л | |
| оригинальный ламотриджин | конвульсан | |
| 50-75 | 0,535 | 0,835 |
| 100-125 | 0,731 | 0,745 |
| 200-250 | 1,463 | 1,50 |
Стандартная поддерживающая доза оригинального ламотриджина и конвульсана, согласно инструкции по медицинскому применению, составляет 100—200 мг/сут. Терапевтически значимая концентрация ламотриджина (1—3 мг/л, или 4—12 ммоль/л) наблюдалась только в группе с диапазоном доз 200—250 мг, в 2 других группах она оказалась значительно ниже, что объясняется низкой эффективной дозой препаратов и может быть связано с индивидуальными особенностями фармакокинетики у конкретного пациента.
Полученные нами данные свидетельствуют о линейной зависимости между концентрацией препарата в крови и терапевтически эффективной дозой (см. рисунок). Результаты проведенного исследования подтверждаются данными, полученными при сравнительном изучении биоэквивалентности генерических препаратов ламотриджинового ряда и их взаимозаменяемости [6]. Авторами изучалась вариабельность концентрации препарата в плазме крови при замене оригинальной формы ламотриджина на генерик. Было показано, что применение генерического препарата ламотриджина (конвульсана) не привело к изменению концентрации в плазме крови и большему разбросу в значениях показателя. Это свидетельствовало об отсутствии различий в эффекте при назначении оригинального препарата или его генерического аналога.
Рисунок. Зависимость концентрации препаратов ламотриджина в крови от дозы
На протяжении всего исследования мы не наблюдали у пациентов развития тяжелых побочных реакций на фоне приема конвульсана и оригинального ламотриджина. Однако при замене оригинального ламотриджина конвульсаном у 2 пациентов отмечалось ухудшение самочувствия, были зафиксированы тошнота, головокружение, диплопия. Такие побочные эффекты не являются редкостью и не относятся к жизнеугрожающим; они довольно подробно описаны в литературе [13]. Тем не менее проведенное исследование подтвердило данные о возможности появления у части пациентов нежелательных реакций [10] при замене оригинального препарата на генерический.
Таким образом, эффективная концентрация конвульсана (таблетки 25 мг производства «Актавис АО», Исландия) эквивалентна таковой ламиктала (таблетки 25 мг производства «ГлаксоСмитКляйн Фармасьютикалз С. А.», Польша), что подтверждалось отсутствием необходимости корректировать дозу при замене одного препарата на другой у включенных в исследование пациентов. Выявленная линейная зависимость концентрации препарата от принимаемой дозы может стать хорошим прогностическим критерием эффективности лечения при синонимической замене оригинального препарата на генерический. Это особенно важно для больных эпилепсией, у которых подобная замена в условиях меняющегося льготного обеспечения проводится часто. Проведенное исследование, не решая проблему замены оригинальных противоэпилептических ламотриджиновых препаратов на их генерические варианты, демонстрирует возможности исследования уровня препарата в крови при оценке эффективности данной замены.
1. Белоусов Ю. Б. Дженерики — мифы и реалии // Ремедиум. — 2003. — № 7-8: 4-9.
2. Дробижев М. Ю. // Психиатрия и психофармакотерпия. — 2007; 9 (3). Т: 43-49.
3. Andermann F., Duh M. S., Gosselin A. et al. // Epilepsia. — 2007; 48 (3): 464-469.
4. Bialer M. // Epilepsia. — 2007; 48 (10): 1825-1832.
5. Borgherini G. // Clin. Ther. — 2003; 25: 1578-1592.
6. Buck T. C., Schmedes A., Brandslund I. // Ugeskr Laeger. — 2007; 21; 169 (21): 2013-2015.
7. Chow S. C., Liu J. // J. Biopharm Stat. — 1997; 7 (1): 97-111.
8. Duh M. S., Andermann F., Paradis P. E. et al. // Dis Manag. — 2007; 10 (4): 216-225.
9. Heaney D. C., Sander J. W. // Lancet Neurol. — 2007; 6 (5): 465-468.
10. Makus K. G. // Epilepsia. — 2005; 46 (6): 279.
11. Makus K. G., McCormick // J. Clin. Ther. — 2007; 29 (2): 334-341.
12. Therapeutics and Technology Assessment Subcommittee of the American Academy of Neurology. Assessment: Generic substitution for antiepileptic medication. — Neurology. — 1990; 40: 1641-1643.
13. Wong I., Lhatoo S. // Drug. Saf. — 2000; 23 (1): 35-56.
14. Wong I., Mawer G. E., Sander J. W. // Epilepsia. — 2001; 42 (2): 237-244.
Ламиктал или ламотриджин что лучше
(1) Клиника «Душевное здоровье», Москва; (2) Кафедра общей и клинической фармакологии РУДН, Москва
Антиконвульсанты широко применяют в неврологической и психиатрической практике для лечения эпилепсии, аффективных расстройств и хронических болевых синдромов. Одним из наиболее хорошо изученных препаратов этой группы является ламотриджин, потребление которого продолжает расти во всех странах мира, особенно при биполярном аффективном расстройстве (БАР) [1–3].
Ламотриджин обладает множественными механизмами действия, которые лежат в основе его разнообразных фармакологических эффектов, в т.ч. не характерных для других антиконвульсантов. Основным механизмом действия ламотриджина считается блокада вольтажзависимых натриевых каналов, приводящая к угнетению выброса в синоптическую щель возбуждающих аминокислот, таких как глутамат и аспартат [4, 5]. Другие механизмы действия препарата включают блокаду потенциалзависимых кальциевых каналов, приводящую к снижению гиперактивности нейронов в зоне СА1 гиппокампа, отвечающей за регуляцию эмоциональной сферы и когнитивные функции [6]. При длительном применении он также повышает содержание в головном мозге тормозного медиатора γ-аминомасляной кислоты (ГАМК) [4, 5]. Ламотриджин способен угнетать моноаминоксидазу (МАО) [7], угнетать обратный нейрональный захват серотонина, норадреналина и дофамина и стимулировать серотонинергическую передачу [8], что, по-видимому, лежит в основе его антидепрессивного действия. Нейропротективное действие ламотриджина и терапевтический эффект при БАР могут быть связанными с его глутаматергической активностью [9]. Возможно, что ламотриджин имеет и другие пока неизвестные механизмы действия, которые объясняют его эффективность при БАР [10].
Эффективность ламотриджина при биполярном аффективном расстройстве Лечение БАР включает три этапа терапии:
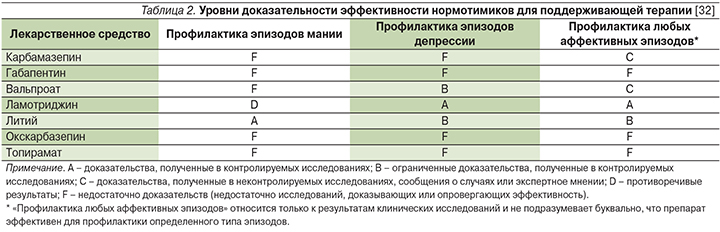
При остром эпизоде мании во всех международных и отечественных рекомендациях в качестве препаратов выбора рассматриваются нормотимики. Однако антиманиакальный эффект не является классовым эффектом препаратов этой группы и характерен только для лития, карбамазепина и вальпроата [12]. Ламотриджин в виде монотерапии изучался у пациентов с острой манией в пяти предрегистрационных исследованиях и ни в одном из них не превосходил по эффективности плацебо [13].
В отличие от острого эпизода мании единое мнение экспертов в отношении препаратов выбора при остром эпизоде депрессии отсутствует, что находит отражение в рекомендациях разных стран [14]. Ламотриджин относится к числу наиболее хорошо изученных препаратов при данном состоянии, поэтому в виде монотерапии или в комбинации с другими препаратами рассматривается в качестве терапии первой линии во всех международных и национальных рекомендациях [14]. Среди антиконвульсантов кроме ламотриджина имеющиеся доказательные данные позволяют рекомендовать в качестве препарата первого выбора при депрессивном эпизоде только вальпроат [15], однако его применение многими категориями пациентов, прежде всего беременными женщинами и женщинами детородного возраста, в целом ограничивают побочные эффекты, включая тератогенный, и повышенный риск развития синдрома поликистозных яичников [16–18].
Эффективность ламотриджина при остром эпизоде депрессии изучалась в предрегистрационном периоде в пяти рандомизированных клинических исследованиях (РКИ) продолжительностью 7–10 недель [19]. Их мета-анализ показал, что ответ на лечение ламотриджином наблюдался у существенно большего числа пациентов в группе ламотриджина, чем в группе плацебо, при оценке по шкале как Гамильтона (HAM-D – Hamilton Depression Rating Scale), так и Монтгомери-Асберг (MADRS – Montgomery-Asberg Depression Rating Scale). Однако в регрессионном мета-анализе было выявлено, что препарат эффективен только в отношении больных тяжелой (>24 баллов по шкале HAM-D), но не легкой депрессией [20]. Результаты еще одного анализа объединенных данных этих исследований, в котором оценивались пункты шкалы HAM-D, ассоциированные с улучшением при применении ламотриджина, позволяют предположить, что его клиническая польза при остром эпизоде биполярной депресии преимущественно связана с устранением депрессивного настроения (начиная с 3-й недели) и психомоторной заторможенности (начиная с 4-й недели) [21].
В пострегистрационном периоде антидепрессивная активность ламотриджина была продемонстрирована в многоцентровом двойном слепом плацебо-контролируемом РКИ с участием 195 пациентов с умеренной депрессией в рамках БАР I [22]. Она подтвердилась и в крупном многоцентровом двойном слепом плацебо-контролируемом исследовании, включившем 200 пациентов с БАР I и БАР II [23].
В этом исследовании препарат по эффективности превосходил плацебо во всех изученных дозах (100–400 мг/сут) и был более эффективным для пациентов с БАР I, чем с БАР II. Согласно результатам систематического обзора 21 РКИ, в котором оценивалась эффективность разных препаратов при остром эпизоде депрессии при БАР II, ламотриджин может рассматриваться для этих пациентов как препарат со «смешанной» поддержкой (с противоречивыми доказательными данными) [24].
По эффективности при остром эпизоде депресии при БАР I ламотриджин уступает кветиапину и немного – комбинации оланзапина с флуоксетином, но превосходит их по переносимости [25, 26].
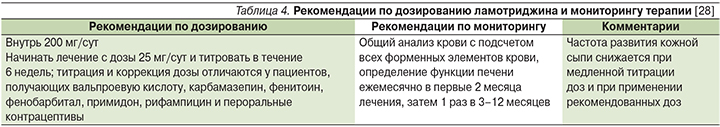
Уровень доказательности эффективности ламотриджина при остром эпизоде депрессии рассматривается как наивысший («А») (табл. 1). Это послужило основанием для включения ламотриджина в качестве препарата первого выбора при остром эпизоде биполярной депрессии во многие рекомендации, включая совместные Международного общества биполярных расстройств (ISBD – International Society for Bipolar Disorders) и Канадской сети по лечению расстройств настроения и тревоги (CANMAT – Canadian Network for Mood and Anxiety Treatments), рекомендации Международной консенсусной группы по доказательной фармакотерапии депрессии при БАР I и БАР II (ICG – International Consensus Group on the Evidence-based Pharmacologic Treatment of Bipolar I and II Depression), а также ряд национальных рекомендаций [14]. Тем не менее полный консенсус экспертов по данному вопросу отсутствует, т.к. применение монотерапии препаратом в острых ситуациях может ограничивать необходимость медленной (в течение 6 недель) титрации его доз с целью предотвращения развития серьезной сыпи [27, 28]. Возможно применение комбинации ламотриджина с литием, которая, по мнению экспертов Всемирной психиатрической ассоциации, наиболее эффективны в данной клинической ситуации [18].
В некоторых руководствах по лечению БАР ламотриджину рекомендуется отдавать предпочтение в отношении пациентов со смешанными эпизодами (наличие симптомов депрессии во время эпизода гипомании или симптомов гипомании во время эпизода депрессии) [29] и с быстрой цикличностью (не менее четырех аффективных эпизодов в год ) в случае преобладания у них депрессивной симптоматики [30].
Доказательства высокого уровня подтверждают применение ламотриджина для длительной поддерживающей терапии БАР (табл. 2). В трех плацебо-контролируемых исследованиях применение ламотриджина в суточных дозах 50–400 мг позволило существенно пролонгировать время до развития любого аффективного эпизода у пациентов с БАР I, недавно перенесших эпизод мании или гипомании [18]. Обобщенный анализ результатов двух исследований показал, что в течение 18 месяцев ламотриджин снижал риск развития аффективного эпизода любой полярности на 36%, однако был более эффективным в отношении профилактики рецидивов депрессии, чем мании [31].
Эффективность профилактического применения ламотриджина больными БАР I подтверждена результатами мета-анализов [33, 34]. Она повышается при его применении в составе комбинированной терапии, однако последняя ассоциируется с более высоким риском развития побочных эффектов. [18]. В то же время монотерапия ламотриджином имеет преимущества перед большинством других препаратов при длительном применении с точки зрения переносимости [35].
Во всех современных руководствах по лечению БАР ламотриджин рассматривается в качестве препарата первой линии для поддерживающей терапии БАР, однако в большинстве из них оговаривается, будто он показан пациентам с преобладанием депрессии [14]. Роль ламотриджина в профилактике эпизодов мании требует дальнейшего изучения.
Безопасность ламотриджина
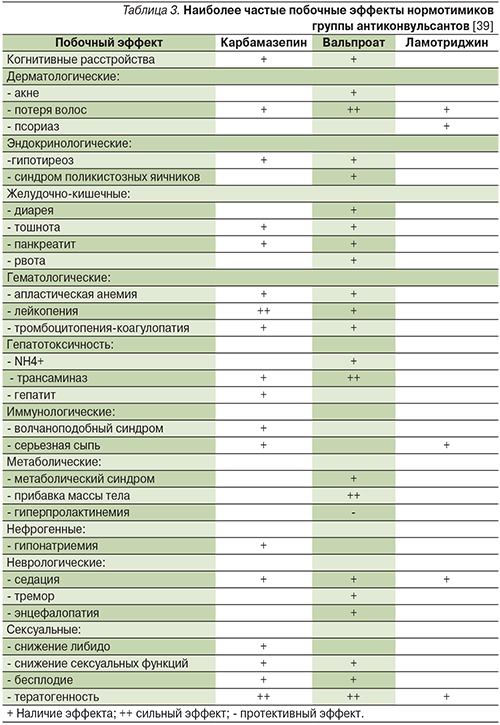
Ламотриджин обладает значительно более благоприятным профилем побочных эффектов по сравнению с другими антиконвульсантами, применяемыми для лечения БАР (табл. 3). При применении в суточной дозе 100–200 мг он отличается прекрасной переносимостью, а убедительные данные о повышении эффективности препарата больными БАР в дозах выше 200 мг/сут отсутствуют [13].
В клинических исследованиях, в т.ч. продолжительностью 18 месяцев, частота отмены из-за побочных эффектов не различалась в группах ламотриджина и плацебо [36, 37]. Наиболее частым побочным эффектом ламотриджина в РКИ была головная боль, однако достоверно чаще, чем в группе плацебо, она встречалась лишь в одном исследовании [9]. Головная боль, а также другие относительно частые побочные эффекты, такие как головокружение и тошнота, наиболее часто развиваются при одновременном применении с вальпроатом [38].
Ламотриджин может вызывать гематологические нарушения (нейтропению, лейкопению, анемию, тромбоцитопению, панцитопению, апластическую анемию, агранулоцитоз) и нарушение функции печени, в связи с чем в период лечения рекомендуется мониторинг картины крови и уровня печеночных ферментов, однако эти побочные эффекты встречаются значительно реже, чем при применении других нормотимиков (табл. 3).
Ламотриджин не оказывает существенного влияния на лабораторные показатели, не вызывает метаболических побочных эффектов, прибавку массы тела и инверсию фазы у больных БАР [9, 35, 36, 40, 41]. При длительном применении он не влияет на прогрессирование атеросклеротического процесса [42] и имеет более благоприятный нейрокогнитивный профиль по сравнению с другими антиконвульсантами [43].
В отличие от карбамазепина и вальпроата ламотриджин не только не ухудшает сексуальные функции, а возможно, и улучшает их [44].
Наибольшее беспокойство при применении ламотриджина вызывает риск развития синдрома Стивенса–Джонсона и токсического эпидермального некролиза. Повышение частоты развития этих осложнений в 3 раза по сравнению с группой плацебо было выявлено в первых клинических исследованиях препарата на пациентах с эпилепсией при применении в более высокой, чем рекомендуется в настоящее время, стартовой дозы, быстрой титрации доз и при одновременном применении вальпроата [9]. Риск развития серьезной сыпи составил 0,3% у взрослых и около 1% у детей [45]. Однако впоследствии было показано, что при правильном режиме подбора дозы эти реакции развиваются редко [32]. Частота развития серьезной сыпи у пациентов с БАР во всех клинических исследованиях составила 0,1%, в т.ч. 0,08% у пациентов, получавших ламотриджин в виде монотерапии, и 0,13% – у пациентов, получавших его в качестве адъювантного препарата [46]. Согласно мета-анализу 21 проспективного постмаркетингового исследования, риск развития сыпи при правильном применении ламотриджина (табл. 4), достоверно не отличается от такового при применении других противосудорожных препаратов, лития и плацебо [47].
Существенным преимуществом ламотриджина перед традиционными антиконвульсантами является отсутствие у него выраженного отрицательного влияния на когнитивные и поведенческие функции [48]. Он редко ассоциируется с когнитивным дефицитом [49, 50], а при его применении в качестве дополнительной терапии при эпилепсии наблюдается улучшение когнитивных проблем [48]. У взрослых и детей с БАР применение ламотриджина ассоциировалось с улучшением памяти [43, 51].
Ламотриджин хорошо сочетается с большинством психотропных препаратов [13]. Осторожность следует соблюдать лишь при одновременном применении вальпроата, угнетающего метаболизм ламотриджина, и карбамазепина, индуцирующего его клиренс.
Отличная переносимость ламотриджина способствует повышению приверженности пациентов лечению, что является важной проблемой для пациентов с БАР, более половины из которых не могут аккуратно соблюдать назначения врача в течение года [52]. Важным для больных БАР является отсутствие у ламотриджина (в отличие от вальпроата и атипичных антипсихотиков) метаболических побочных эффектов и негативного влияния на массу тела, поскольку у них повышен риск развития ожирения, сахарного диабета 2 типа и сердечно-сосудистых заболеваний [53, 56].
Благоприятный профиль безопасности, редкая частота побочных эффектов и отсутствие отрицательного влияния на настроение, когнитивные функции способствуют повышению качества жизни пациентов, что является одной из целей лечения БАР [57]. Эти свойства также обусловливают преимущества ламотриджина для лиц пожилого и старческого возраста, в т.ч. с деменцией [58], и у детей [59]. Есть данные, согласно которым пожилые пациенты даже лучше, чем молодые, переносят ламотриджин, в частности, у них ниже риск развития кожных сыпей [60].
Ламотриджин имеет существенные преимущества перед вальпроатом у женщин детородного возраста [61, 62]. Он представляется самым безопасным антиконвульсантом во время беременности [63]. В анализах регистров беременности и других исследований большие врожденные аномалии наблюдались у 0–3,2% детей (по сравнению с 6,2–16,0% при применении вальпроата), внутриутробно подвергшихся действию этого препарата, что не отличается от частоты врожденных аномалий у населения в целом [64–67].
В нескольких исследованиях показано небольшое повышение риска развития ротолицевых расщелин под его влиянием, однако оно не подтвердилось в недавно опубликованном анализе 21 регистра беременности (10,1 млн рождений в период с 1995 по 2011 г.) [67]. Акушерских или неонатальных осложнений, связанных с применением во время беременности монотерапии ламотриджином, не описано. В отличие от вальпроата он не ассоциировался с нейроповеденческой токсичностью у детей, внутриутробно подвергшихся его воздействию [68].
Таким образом, ламотриджин является эффективным препаратом для лечения БАР с преобладающей антидепрессивной активностью. Он эффективен при остром эпизоде депрессии, но наиболее большое значение имеет для длительной поддерживающей терапии пациентов с преобладающей депрессивной симптоматикой. Преимуществом ламотриджина перед другими нормотимиками, особенно при длительном применении, является его высокая безопасность, в т.ч. в отношении детей, лиц пожилого возраста и беременных женщин.
Литература
1. Karanti A., Kardell M., Lundberg U., Landén M. Changes in mood stabilizer prescription patterns in bipolar disorder. J. Affect Disord. 2016;195:50–6.
2. Kessing L.V., Vradi E., Andersen P.K. Nationwide and population-based prescription patterns in bipolar disorder. Bipolar. Disord. 2016;18(2):174–82.
3. Chang C.M., Wu C.S., Huang Y.W., et al. Utilization of Psychopharmacological Treatment Among Patients With Newly Diagnosed Bipolar Disorder From 2001 to 2010. J. Clin. Psychopharmacol. 2016;36(1):32–44.
4. Ketter T.A., Manji H.K., Post R.M. Potential mechanisms of action of lamotrigine in the treatment of bipolar disorders. J. Clin. Psychopharmacol. 2003;23(5):484–95.
5. Hahn C.G., Gyulai L., Baldassano C.F., et al. 2004. The current understanding of lamotrigine as a mood stabilizer. J. Clin. Psychiatry, 65:791–804.
6. Бурчинский С.Г. Антиконвульсанты нового поколения и стандарты монотерапии эпилепсии. Международный неврол. журн. 2007;6(16).
7. Muck-Seler D., Sagud M., Mustapic M., et al. The effect of lamotrigine on platelet monoamine oxidase type B activity in patients with bipolar depression. Prog. Neuropsychopharmacol Biol. Psychiatry. 2008;32(5):1195–98.
8. Shim S.E., Mansari M., Blier P. Modulation of the antidepressant-like effects of sustained administration of carisbamate and lamotrigine on monoaminergic systems: electrophysiological studies in the rat brain. J. Pharmacol. Exp. Ther. 2013;347:487–96.
9. Ng F.Hallam K., Lucas N., Berk M. The role of lamotrigine in the managementof bipolar disorder. Neuropsychiatr. Dis. Treat. 2007;3(4):463–74.
10. Chowdhury D. New drugs for the treatment of epilepsy: a practical approach. J. Assoc. Physicians India. 2013;61(Suppl. 8):19–23.
11. Мосолов С.Н., Костюкова Е.Г., Цукарзи Э.Э. Федеральные клинические рекомендации по диагностике и лечению биполярного аффективного расстройства 2013. http://psychiatr.ru/news/183.
12. Rosa A.R., Fountoulakis K., Siamouli M., Gonda X., Vieta E. Is anticonvulsant treatment of mania a class effect? Data from randomized clinical trials. CNS Neurosci Ther. 2011;17(3):167–77.
13. Bowden C.L., Singh V. Lamotrigine (Lamictal IR) for the treatment of bipolar disorder. Expert Opin. Pharmacother. 2012;13(17):2565–71.
14. Vieta E., Valentí M. Pharmacological management of bipolar depression: acute treatment, maintenance, and prophylaxis. CNS Drugs. 2013;27(7):515–22.
15. Azorin J.M., Belzeaux R., Cermolacce M., Kaladjian A., et al. Recommendations for the treatment of mixed episodes in current guidelines. Encephale. 2013;39(Suppl. 3):S185–87.
17. Kaplan Y.C., Abdelkader N. Valproate prescribing trends for non-epilepsy indications in women of reproductive age warrants effective measures and increased surveillance. Seizure. 2016;40:13–4.
18. Fountoulakis K.N., Kasper S., Andreassen O., et al. Efficacy of pharmacotherapy in bipolar disorder: a report by the WPA section on pharmacopsychiatry. Eur. Arch. Psychiatry Clin. Neurosci. 2012;262(Suppl. 1):1–48.
19. Calabrese J.R., Huffman R.F., White R.L., et al. Lamotrigine in the acute treatment of bipolar depression: results of five double-blind, placebo-controlled clinical trials. Bipolar. Disord. 2008;10:323–33.
20. Geddes J.R., Calabrese J.R., Goodwin G.M. Lamotrigine for treatment of bipolar depression: independent meta-analysis and meta-regression of individual patient data from five randomised trials. Br. J. Psychiatry. 2009;194:4–9.
21. Mitchell P.B., Hadzi-Pavlovic D., Evoniuk G., et al. Factor analysis in bipolar depression and response to lamotrigine. CNS Spectr. 2013;18(4):214–24.
22. Srivastava S., Ketter T.A. Clinical relevance of treatments for acute bipolar disorder: balancing therapeutic and adverse effects. Clin. Ther. 2011;33(12):B40–84:4–9.
23. Vázquez G.H., Holtzman J.N., Tondo L., Baldessarini R.J. Efficacy and tolerability of treatments for bipolar depression. J. Affect. Disord. 2015;183:258–62.
24. Swartz H.A., Thase M.E. Pharmacotherapy for the treatment of acute bipolar II depression: current evidence. J. Clin. Psychiatry. 2011;72(3):356–66.
25. Vieta E., Locklear J., Günther O., et al. Treatment options for bipolar depression: a systematic review of randomized, controlled trials. J. Clin. Psychopharmacol. 2010;30:79–590.
26. Brown E.B., McElroy S.L., Keck P.E.Jr., et al. (2006) A 7-week, randomized, double- blind trial of olanzapine/fluoxetine combination versus lamotrigine in the treatment of bipolar I depression. J. Clin. Psychiatry 67:1025–33.
27. Amann B., Born C., Crespo J.M., Pomarol-Clotet E., McKenna P. Lamotrigine: when and where does it act in affective disorders? A systematic review. J. Psychopharmacol. 2010;10:1289–94.
28. Price A.L., Marzani-Nissen G.R. Bipolar disorders: a review. Am. Fam. Physician. 2012;85(5):483–93.
29. Pfennig A., Bschor T., Falkai P., Bauer M. The diagnosis and treatment of bipolar disorder: recommendations from the current s3 guideline. Dtsch. Arztebl. Int. 2013;110(6):9–100.
30. Woo Y.S., Lee J.G., Jeong J.H., et al. Korean Medication Algorithm Project for Bipolar Disorder: third revision. Neuropsychiatr. Dis. Treat. 2015;11:49–506.
31. Goodwin G.M., Bowden C.L., Calabrese J.R., et al. A pooled analysis of 2 placebo-controlled 18-month trials of lamotrigine and lithium maintenance in bipolar I disorder. J. Clin. Psychiatry. 2004;65:432–41.
32. Grunze H., Vieta E., Goodwin G., Bowden C., Licht R.W., Moller H.J., Kasper S. The World Federation of Societies of Biological Psychiatry (WFSBP) Guidelines for the Biological Treatment of Bipolar Disorders: update 2009 on the treatment of bipolar depression. World J. Biol. Psychiatry. 2009;10(2):85–116.
33. Beynon S., Soares-Weiser K., Woolacott N., Duffy S., Geddes J.R. Pharmacological interventions for the prevention of relapse in bipolar disorder: a systematic review of controlled trials. J. Psychopharmacol. 2009;23:574–91.
34. Vieta E., Gunther O., Locklear J., Ekman M., Miltenburger C., Chatterton M.L., Åström M., Paulsson B. Effectiveness of psychotropic medications in the maintenance phase of bipolar disorder: a meta-analysis of randomized controlled trials. Int. J. Neuropsychopharmacol. 2011;14(8):1029–49.
35. Goldsmith D.R., Wagstaff A.J., Ibbotson T., Perry C.M. Spotlight on lamotrigine in bipolar disorder. CNS Drugs. 2004;18(1):63–7.
36. Goldberg J.F., Calabrese J.F., Saville B.R., et al. Mood stabilization and destabilization during acute and continuation phase treatment for bipolar I disorder with lamotrigine or placebo. J. Clin. Psychiatry. 2009;79(9):1273–80.
37. Bowden C.L., Asnis G.M., Ginsberg L.D., et al. Safety and tolerability of lamotrigine for bipolar disorder. Drug. Saf. 2004;27:173–84.
38. French J.A., Gazzola D.M. New generation antiepileptic drugs: what do they offer in terms of improved tolerability and safety? Ther. Adv. Drug. Saf. 2011;2(4):141–58.
39. Murru A., Popovic D., Pacchiarotti I., et al. Management of adverse effects of mood stabilizers. Curr. Psychiatry Rep. 2015;17(8):603.
40. Bowden C.L., Calabrese J.R., Ketter T.A., et al. Impact of lamotrigine and lithium on weight in obese and nonobese patients with bipolar I disorder. Am. J. Psychiatry. 2006;163(7):1199–201.
41. Sachs G., Bowden C., Calabrese J.R., et al. Effects of lamotrigine and lithium on body weight during maintenance treatment of bipolar I disorder. Bipolar Disord. 2006;8(2):175-81.
42. Chuang Y.C., Chuang H.Y., Lin T.K., et al. Effects of long-term antiepileptic drug monotherapy on vascular risk factors and atherosclerosis. Epilepsia. 2012;53(1):120–28.
43. Daban C., Martínez-Arán A., Torrent C., et al. Cognitive functioning in bipolar patients receiving lamotrigine: preliminary results. J. Clin. Psychopharmacol. 2006;26(2):178–81.
44. Gil-Nagel A., López-Muñoz F., Serratosa J.M., et al. Effect of lamotrigine on sexual function in patients with epilepsy. Seizure. 2006;15(3):142–49.
45. National Collaborating Centre for Mental Health. Bipolar disorder: the assessment and management of bipolar disorder in adults, children and young people in primary and secondary care. London (UK): National Institute for Health and Care Excellence (NICE); 2014;58. (Clinical guideline; no. 185).
46. Seo H.J., Chiesa A., Lee S.J., et al. Safety and tolerability of lamotrigine: results from 12 placebo-controlled clinical trials and clinical implications. Clin. Neuropharmacol. 2011; 34(1):39–47.
47. Wang X.Q., Xiong J., Xu W.H., et al. Risk of a lamotrigine-related skin rash: current meta-analysis and postmarketing cohort analysis. Seizure. 2015;25:52–61.
48. Lee S.A., Lee H.W., Heo K., et al. Cognitive and behavioral effects of lamotrigine and carbamazepine monotherapy in patients with newly diagnosed or untreated partial epilepsy. Seizure. 2011;20(1):49–54.
49. Aldenkamp A.P., Baker G. A systematic review of the effects of lamotrigine on cognitive function and quality of life. Epilepsy Behav. 2001;2:85–91.
50. Blum D., Meador K., Biton V., et al. Cognitive effects of lamotrigine compared with topiramate in patients with epilepsy. Neurology. 2006;67:400–6.
51. Pavuluri M.N., Passarotti A.M., Mohammed T., et al. Enhanced working and verbal memory after lamotrigine treatment in pediatric bipolar disorder. Bipolar. Disord. 2010;12(2):213–20.
52. Keck P.E., Jr,. McElroy S.L., Strakowski S.M., et al. Compliance with maintenance treatment in bipolar disorder. Psychopharmacol. Bull. 1997;33:87–9.
53. Zhao Z., Okusaga O.O., Quevedo J., et al. The potential association between obesity and bipolar disorder: A meta-analysis. J. Affect Disord. 2016;202:120–3.
54. Vancampfort D., Sienaert P., Wyckaert S., et al. The Metabolic Syndrome Is Associated with Self-Reported Physical Complaints in Patients with Bipolar Disorder. Psychiatr. Danub. 2016;28(2):139–45.
55. Vancampfort D., Correll C.U., Galling B., et al. Diabetes mellitus in people with schizophrenia, bipolar disorder and major depressive disorder: a systematic review and large scale meta-analysis. World Psychiatry. 2016;15(2):166–74.
56. Pérez-Piñar M., Mathur R., Foguet Q., et al. Cardiovascular risk factors among patients with schizophrenia, bipolar, depressive, anxiety, and personality disorders. Eur. Psychiatry. 2016;35:8–15.
57. Gonda X., Kalman J., Dome P., Rihmer Z. Changes in quality of life and work function during phase prophylactic lamotrigine treatment in bipolar patients: 6 month, prospective, observational study. Neuropsychopharmacol. Hung. 2016;18(1):57–67.
58. Suzuki H., Gen K. Clinical efficacy of lamotrigine and changes in the dosages of concomitantly used psychotropic drugs in Alzheimer’s disease with behavioural and psychological symptoms of dementia: a preliminary open-label trial. Psychogeriatrics. 2015;15(1):32–7.
59. Bailly D. Pharmacological treatment of bipolar disorder in children and adolescents. Encephale. 2016.
60. Greil W., Häberle A., Schuhmann T., et al. Age and adverse drug reactions from psychopharmacological treatment: data from the AMSP drug surveillance programme in Switzerland. Swiss Med. Wkly. 2013;143:w13772.
61. Gerard E.E., Meador K.J. Managing Epilepsy in Women. Continuum (Minneap Minn). 2016;22(1 Epilepsy):204–26.
62. Khan S.J., Fersh M.E., Ernst C., et al. Bipolar Disorder in Pregnancy and Postpartum: Principles of Management. Curr. Psychiatry Rep. 2016;18(2):13.
63. Costoloni G., Pierantozzi E., Goracci A., Bolognesi S., Fagiolini A. Mood stabilisers and pregnancy outcomes – a review. Psychiatr. Pol. 2014;48(5):865–87.
64. Meador K., Reynolds M.W., Crean S., et al. Pregnancy outcomes in women with epilepsy: a systematic review and meta-analysis of published pregnancy registries and cohorts. Epilepsy Res. 2008;81(1):1–13.
65. Nguyen H.T., Sharma V., McIntyre R.S. Teratogenesis associated with antibipolar agents. Adv. Ther. 2009;26(3):281–94.
66. Tomson T., Battino D., Bonizzoni E., Craig J., Lindhout D., Sabers A., Perucca E., Vajda F., EURAP study group. Dose-dependent risk of malformations with antiepileptic drugs: an analysis of data from the EURAP epilepsy and pregnancy registry. Lancet Neurol. 2011;10(7):609–17.
67. Dolk H., Wang H., Loane M., et al. Lamotrigine use in pregnancy and risk of orofacial cleft and other congenital anomalies. Neurology. 2016;86(18):1716–25.
68. Forsberg L., Wide K. Long-term consequences after exposure to antiepileptic drugs in utero. Ther. Adv. Drug. Saf. 2011;2(5):227–34.
Об авторах / Для корреспонденции
А.В. Ушкалова – к.м.н., врач-психиатр клиники «Душевное здоровье», Москва