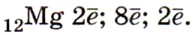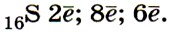Неметаллические свойства алюминия выражены слабее чем у
Усиление металлических и неметаллических свойств в таблице
Периодическая таблица Дмитрия Ивановича Менделеева очень удобна и универсальна в своём использовании. По ней можно определить некоторые характеристики элементов, и что самое удивительное, предсказать некоторые свойства ещё неоткрытых, не обнаруженных учёными, химических элементов (например, мы знаем некоторые свойства предполагаемого унбигексия, хотя его ещё не открыли и не синтезировали).
Что такое металлические и неметаллические свойства
Эти свойства зависят от способности элемента отдавать или притягивать к себе электроны. Важно запомнить одно правило, металлы – отдают электроны, а неметаллы – принимают. Соответственно металлические свойства – это способность определённого химического элемента отдавать свои электроны (с внешнего электронного облака) другому химическому элементу. Для неметаллов всё в точности наоборот. Чем легче неметалл принимает электроны, тем выше его неметаллические свойства.
Металлы никогда не примут электроны другого химического элемента. Такое характерно для следующих элементов;
С неметаллами дела обстоят похожим образом. Фтор больше всех остальных неметаллов проявляет свои свойства, он может только притянуть к себе частицы другого элемента, но ни при каких условиях не отдаст свои. Он обладает наибольшими неметаллическими свойствами. Кислород (по своим характеристикам) идёт сразу же после фтора. Кислород может образовывать соединение с фтором, отдавая свои электроны, но у других элементов он забирает отрицательные частицы.
Список неметаллов с наиболее выраженными характеристиками:
Неметаллические и металлические свойства объясняются тем, что все химические вещества стремятся завершить свой энергетический уровень. Для этого на последнем электронном уровне должно быть 8 электронов. У атома фтора на последней электронной оболочке 7 электронов, стремясь завершить ее, он притягивает ещё один электрон. У атома натрия на внешней оболочке один электрон, чтобы получить 8, ему проще отдать 1, и на последнем уровне окажется 8 отрицательно заряженных частиц.
Благородные газы не взаимодействуют с другими веществами именно из-за того, что у них завершён энергетический уровень, им не нужно ни притягивать, ни отдавать электроны.
Как изменяются металлические свойства в периодической системе
Периодическая таблица Менделеева состоит из групп и периодов. Периоды располагаются по горизонтали таким образом, что первый период включает в себя: литий, бериллий, бор, углерод, азот, кислород и так далее. Химические элементы располагаются строго по увеличению порядкового номера.
Группы располагаются по вертикали таким образом, что первая группа включает в себя: литий, натрий, калий, медь, рубидий, серебро и так далее. Номер группы указывает на количество отрицательных частиц на внешнем уровне определённого химического элемента. В то время, как номер периода указывает на количество электронных облаков.
Металлические свойства усиливаются в ряду справа налево или, по-другому, ослабевают в периоде. То есть магний обладает большими металлическими свойствами, чем алюминий, но меньшими, нежели натрий. Это происходит потому, что в периоде количество электронов на внешней оболочке увеличивается, следовательно, химическому элементу сложнее отдавать свои электроны.
В группе все наоборот, металлические свойства усиливаются в ряду сверху вниз. Например, калий проявляется сильнее, чем медь, но слабее, нежели натрий. Объяснение этому очень простое, в группе увеличивается количество электронных оболочек, а чем дальше электрон находится от ядра, тем проще элементу его отдать. Сила притяжения между ядром атома и электроном в первой оболочке больше, чем между ядром и электроном в 4 оболочке.
Сравним два элемента – кальций и барий. Барий в периодической системе стоит ниже, чем кальций. А это значит, что электроны с внешней оболочки кальция расположены ближе к ядру, следовательно, они лучше притягиваются, чем у бария.
Сложнее сравнивать элементы, которые находятся в разных группах и периодах. Возьмём, к примеру, кальций и рубидий. Рубидий будет лучше отдавать отрицательные частицы, чем кальций. Так как он стоит ниже и левее. Но пользуясь только таблицей Менделеева нельзя однозначно ответить на этот вопрос сравнивая магний и скандий (так как один элемент ниже и правее, а другой выше и левее). Для сравнения этих элементов понадобятся специальные таблицы (например, электрохимический ряд напряжений металлов).
Как изменяются неметаллические свойства в периодической системе
Неметаллические свойства в периодической системе Менделеева изменяются с точностью до наоборот, нежели металлические. По сути, эти два признака являются антагонистами.
Неметаллические свойства усиливаются в периоде (в ряду справа налево). Например, сера способна меньше притягивать к себе электроны, чем хлор, но больше, нежели фосфор. Объяснение этому явлению такое же. Количество отрицательно заряженных частиц на внешнем слое увеличивается, и поэтому элементу легче закончить свой энергетический уровень.
Неметаллические свойства уменьшаются в ряду сверху вниз (в группе). Например, фосфор способен отдавать отрицательно заряженные частицы больше, чем азот, но при этом способен лучше притягивать, нежели мышьяк. Частицы фосфора притягиваются к ядру лучше, чем частицы мышьяка, что даёт ему преимущество окислителя в реакциях на понижение и повышение степени окисления (окислительно-восстановительные реакции).
Сравним, к примеру, серу и мышьяк. Сера находится выше и правее, а это значит, что ей легче завершить свой энергетический уровень. Как и металлы, неметаллы сложно сравнивать, если они находятся в разных группах и периодах. Например, хлор и кислород. Один из этих элементов выше и левее, а другой ниже и правее. Для ответа придётся обратиться к таблице электроотрицательности неметаллов, из которой мы видим, что кислород легче притягивает к себе отрицательные частицы, нежели хлор.
Периодическая таблица Менделеева помогает узнать не только количество протонов в атоме, атомную массу и порядковый номер, но и помогает определить свойства элементов.
Видео
Видео поможет вам разобраться в закономерности свойств химических элементов и их соединений по периодам и группам.
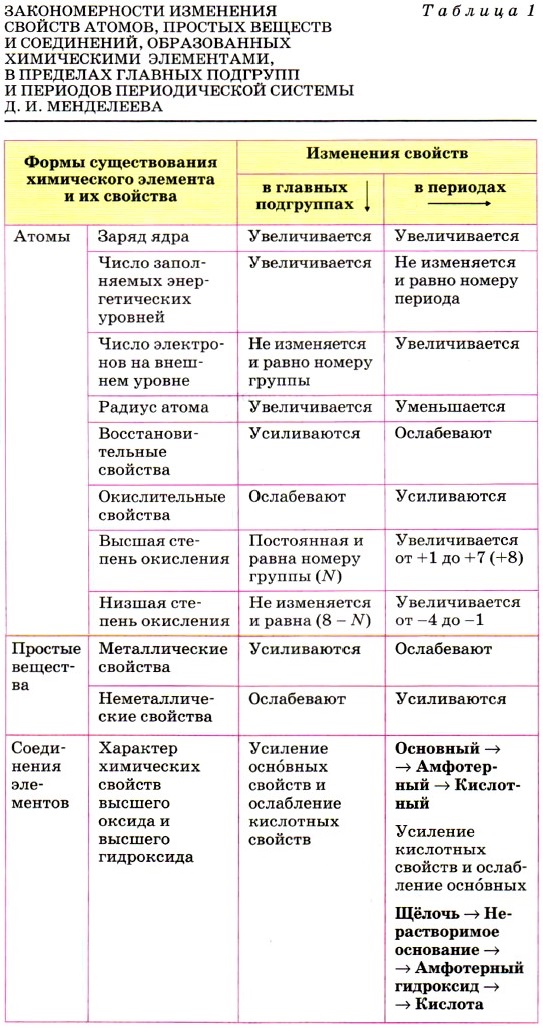
§ 1. Характеристика химического элемента на основании его положения в Периодической системе Д. И. Менделеева
Как и литературным героям, химическим элементам — «героям» химических процессов дают характеристики. Только если для первых в качестве первоисточника используют литературное произведение, то для вторых — Периодическую систему химических элементов Д. И. Менделеева. Однако и в первом, и во втором случае необходим план.
Характеризуя химический элемент, будем придерживаться следующего плана.
1. Положение элемента в Периодической системе Д. И. Менделеева и строение его атомов.
2. Характер простого вещества (металл, неметалл).
3. Сравнение свойств простого вещества со свойствами простых веществ, образованных соседними по подгруппе элементами.
4. Сравнение свойств простого вещества со свойствами простых веществ, образованных соседними по периоду элементами.
5. Состав высшего оксида, его характер (основный, кислотный, амфотерный).
6. Состав высшего гидроксида, его характер (кислородсодержащая кислота, основание, амфотерный гидроксид).
7. Состав летучего водородного соединения (для неметаллов).
В приведённом плане для вас незнакомыми являются следующие химические понятия: переходные металлы, амфотерные оксиды и гидроксиды. Их смысл будет раскрыт в следующем параграфе. Пока же рассмотрим характеристики металла и неметалла.
При этом будем руководствоваться уже известными вам из курса 9 класса основными закономерностями изменения свойств атомов, простых веществ и соединений, образованных химическими элементами главных подгрупп (А групп) и периодов Периодической системы Д. И. Менделеева (табл. 1).
Характеристика металла на примере магния.
Элемент магний находится в 3-м периоде Периодической системы, значит, все электроны атома располагаются на трёх энергетических уровнях. Строение электронной оболочки атома магния можно отразить с помощью следующей схемы:
Исходя из строения атома, можно предсказать и степень окисления магния в его соединениях. В химических реакциях атом магния отдаёт два внешних электрона, проявляя восстановительные свойства, следовательно, он получает степень окисления +2.
Восстановительные свойства у магния выражены сильнее, чем у бериллия, но слабее, чем у кальция (элементы IIА группы), что связано с увеличением радиусов атомов при переходе от Be к Mg и Са. Соответственно в ряду Be — Mg — Са два внешних электрона всё более удаляются от ядра, ослабевает их связь с ядром, и они всё легче покидают атом, который при этом переходит в ион М2 + (М — металл).
2. Для магния — простого вещества — характерна металлическая кристаллическая решётка и металлическая химическая связь, а отсюда и все типичные для металлов свойства (вспомните какие).
3. Металлические свойства у магния выражены сильнее, чем у бериллия, но слабее, чем у кальция (объясните почему, учитывая, что металлические свойства определяются в первую очередь способностью атомов отдавать электроны).
4. Металлические свойства у магния выражены слабее, чем у натрия, но сильнее, чем у алюминия (соседние элементы 3-го периода) (объясните почему).
5. Оксид магния MgO является основным оксидом и проявляет все типичные свойства основных оксидов (iвспомните какие).
6. В качестве гидроксида магнию соответствует основание Mg(OH)2, которое проявляет все характерные свойства оснований (вспомните какие).
7. Летучего водородного соединения магний не образует.
Характеристика неметалла на примере серы.
1. Сера — элемент VIA группы и 3-го периода, Z = 16, А = 32. Соответственно атом серы содержит в ядре 16 протонов и 16 нейтронов и на электронной оболочке — 16 электронов. Строение его электронной оболочки можно отразить с помощью следующей схемы:
Сера — менее сильный окислитель, чем кислород, но более сильный, чем селен, что связано с увеличением радиусов атомов от кислорода к селену. По этой же причине восстановительные свойства элементов в главной подгруппе VI группы (VIA группы) при переходе от кислорода к селену усиливаются. (Дайте объяснения указанных изменений окислительных и восстановительных свойств.)
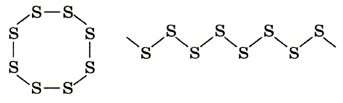
2. Сера — простое вещество, типичный неметалл. Сере свойственно явление аллотропии. Разные простые вещества, образованные химическим элементом серой, имеют различные свойства, так как кристаллическое строение их различно. Например, у ромбической серы молекулярная кристаллическая решётка состоит из циклических молекул состава S8, а у пластической серы молекулы представляют собой длинные открытые цепи атомов:
3. Неметаллические свойства у серы выражены слабее, чем у кислорода, но сильнее, чем у селена.
4. Неметаллические свойства у серы выражены сильнее, чем у фосфора, но слабее, чем у хлора (соседние элементы в 3-м периоде).
5. Высший оксид серы имеет формулу SO3. Это кислотный оксид. Он проявляет все типичные свойства кислотных оксидов какие?).
6. Высший гидроксид серы — хорошо известная вам серная кислота H2SO4, раствор которой проявляет все типичные свойства кислот (какие?).
7. Сера образует летучее водородное соединение — сероводород H2S.
Подобные характеристики можно привести для большинства элементов-металлов и элементов-неметаллов главных подгрупп. На их основе можно составить генетические ряды металла и неметалла.
1. Обратитесь к электронному приложению. Изучите материал урока и выполните предложенные задания.
2. Найдите в Интернете электронные адреса, которые могут служить дополнительными источниками, раскрывающими содержание ключевых слов и словосочетаний параграфа. Предложите учителю свою помощь в подготовке нового урока — сделайте сообщение по ключевым словам и словосочетаниям следующего параграфа.
1. Дайте характеристику элементов: а) фосфора; б) калия.
2. Запишите уравнения химических реакций, характеризующие свойства: a) MgO и SO3; б) Mg(OH)2 и H2SO4. Уравнения реакций с участием электролитов запишите также в ионной форме.
3. Дайте характеристику магния — простого вещества. Какой тип связи наблюдается в нём? Какие физические свойства имеет металл магний? Запишите уравнения реакций магния со следующими веществами: а) кислородом; б) хлором Сl2; в) серой; г) азотом N2; д) соляной кислотой. Рассмотрите их с позиций процессов окисления-восстановления.
4. Что такое аллотропия? Какой тип химической связи реализуется в молекулах состава: a) S8; б) H2S? Какие физические свойства имеет наиболее устойчивая модификация серы — ромбическая сера? Запишите уравнения реакций серы со следующими веществами: а) натрием; б) кальцием;в) алюминием; г) кислородом; д) водородом; е) фтором F2. Рассмотрите их с позиций процессов окисления-восстановления.
5. Сравните свойства простого вещества кремния со свойствами простых веществ, образованных химическими элементами — соседями кремния по периоду.
6. У высшего оксида какого химического элемента наиболее выражены кислотные свойства: а) азота или фосфора; б) фосфора или серы?
7. Вычислите объём воздуха (примите объёмную долю кислорода в нём равной 0,2), который потребуется для сжигания 120 мг образца магния, содержащего 2% негорючих примесей.
8. Вычислите объём оксида серы (IV) (н. у.), который может быть получен при сжигании 1,6 кг серы, если выход продукта составляет 80% от теоретически возможного. Указание. Сначала по уравнению реакции рассчитайте объём оксида серы (IV) — это теоретический объём Итеор, затем найдите практический объём Упракт, исходя из известного выхода продукта W:
Аналогично можно найти массу продукта реакции, используя формулу:
9. Можно ли утверждать, что высшему оксиду серы SO3 соответствует сернистая кислота H2SO3? Почему?
10. Используя метод электронного баланса, определите коэффициенты в схемах химических реакций:
Неметаллические свойства алюминия выражены слабее чем у
В каком ряду химических элементов усиливаются металлические свойства соответствующих им простых веществ?
1) калий → натрий → литий
2) сурьма → мышьяк → фосфор
3) углерод → кремний → германий
4) алюминий → кремний → углерод
Металлические свойства простых веществ в периодической системе усиливаются в группах — сверху вниз, в периодах — справа налево. Поэтому верен ряд № 3.
Правильный ответ указан под номером: 3.
правильным ответом является вариант 1, а не 3, так как это соответствует пояснению
Ряд номер один перечислен в порядке снизу вверх, поэтому неверен.
В условии написано металлические свойства, а углерод, кремний неметаллы же. Правильный ответ под номером 1
Диана, вот именно, что СВОЙСТВА.
В каком ряду химических элементов усиливаются металлические свойства соответствующих им простых веществ?
1) кислород → фтор → неон
2) кремний → сера → хлор
3) селен → сера → кислород
4) алюминий → магний → натрий
Металлические свойства простых веществ усиливаются по ряду элементов периодической системы сверху вниз и справа налево. Поэтому верен ряд №4.
Правильный ответ указан под номером: 4.
Неметаллические свойства фосфора выражены сильнее, чем неметаллические свойства
Неметаллические свойства простых веществ в периодической системе усиливаются в группах — снизу вверх, а в периодах — слева направо.
Поэтому неметаллические свойства фосфора выражены сильнее, чем неметаллические свойства кремния, и слабее остальных представленных элементов.
Правильный ответ указан под номером 4.
2 варианта ответа правильны и 4 и 3
Никита, необходимо найти элемент, у которого неметаллические свойства слабее, чем у фосфора.
В каком ряду химические элементы расположены в порядке возрастания их атомного радиуса?
1)
2)
3)
4)
Атомный радиус увеличивается по периоду справа налево, по группе сверху вниз. Поэтому в ряду №2 химические элементы расположены в порядке возрастания их атомного радиуса.
Правильный ответ указан под номером: 2.
правильный ответ номер 1 по таблице Менделеева с начало идёт C, потом N, затем O.
Атомный радиус увеличивается по периоду справа налево.
От кислотных к основным меняются свойства оксидов в ряду
1)
2)
3)
4)
Основные свойства оксидов усиливаются по периоду справа налево.
В первом ряду свойства оксидов меняются от основных к кислотным, во втором — от основных к амфотерным, в четвёртом — представлены только кислотные оксиды, а в третьем — от кислотного через амфотерный к основному.
Периодический закон
Периодический закон был открыт Д.И. Менделеевым в 1868 году. Его современная формулировка: свойства химических элементов и образуемых ими соединений (простых и сложных) находятся в периодической зависимости от величины заряда атомного ядра.
Периодический закон лежит в основе современного учения о строении вещества. Периодическая система Д.И. Менделеева является наглядным отражением периодического закона.
Группой называют вертикальный ряд химических элементов в периодической таблице. Элементы собраны в группы на основе степени окисления в высшем оксиде. Каждая из восьми групп состоит из главной подгруппы (а) и побочной подгруппы (б).
Периодическая таблица Д.И. Менделеева содержит колоссальное число ответов на самые разные вопросы. При умелом ее использовании вы сможете предполагать строение и свойства веществ, успешно писать химические реакции и решать задачи.
Радиус атома
Радиусом атома называют расстояние между атомным ядром и самой дальней электронной орбиталью. Это не четкая, а условная граница, которая говорит о наиболее вероятном месте нахождения электрона.
В периоде радиус атома уменьшается с увеличением порядкового номера элементов (“→” слева направо). Это связано с тем, что с увеличением номера группы увеличивается число электронов на внешнем уровне. Запомните, что для элементов главных подгрупп номер группы равен числу электронов на внешнем уровне.
С увеличением числа электронов они становятся более скученными, так как притягиваются друг к другу сильнее: это и есть причина маленького радиуса атома.
Чем меньше электронов, тем больше у них свободы и больше радиус атома, поэтому радиус увеличивается в периоде “←” справа налево.
Период, группа и электронная конфигурация
Правило составления электронной конфигурации, которое вы только что увидели, универсально. Если вы имеете дело с элементом главной подгруппы, то увидев номер группы вы знаете, сколько электронов у него на внешнем уровне. Посмотрев на период, знаете номер его внешнего уровня.
Длина связи
Убедимся в этом на наглядном примере, сравнив длину связей в четырех веществах: HF, HCl, HBr, HI.
Чем больше радиусы атомов, которые образуют химическую связь, тем больше между ними и длина связи. Радиус атома водорода неизменен во всех трех веществах, а в ряду F → Cl → Br → I происходит увеличение радиуса атома. Наибольшим радиусом обладает йод, поэтому самая длинная связь в молекуле HI.
Металлические и неметаллические свойства
Сравним металлические и неметаллические свойства Rb, Na, Al, S. Натрий, алюминий и сера находятся в одном периоде. Металлические свойства возрастают S → Al → Na. Натрий и рубидий находятся в одной группе, металлические свойства возрастают Na → Rb.
Основные и кислотные свойства
Замечу, что здесь есть одно важное исключение. Как и в общем случае: исключения только подтверждают правила. В ряду галогенводородных кислот HF → HCl → HBr → HI происходит усиление кислотных свойств (а не ослабление, как должно быть по логике нашего правила).
Восстановительные и окислительные свойства
Электроотрицательность (ЭО), энергия связи, ионизации и сродства к электрону
Для примера сравним ЭО-ость атомов Te, In, Al, P. Индий расположен в одной группе с алюминием, ЭО-ость In → Al возрастает (снизу вверх). Алюминий расположен в одном периоде с серой, ЭО-ость возрастает Al → S (слева направо). Сравнивая серу и теллур, мы видим, что сера расположена в группе выше теллура, значит и ее электроотрицательность тоже выше.
Энергия связи (а также ее прочность) возрастают с увеличением электроотрицательности атомов, образующих данную связь. Чем сильнее атом тянет на себя электроны (чем больше он ЭО-ый), тем прочнее получается связь, которую он образует.
Продемонстрирую на примере. Сравним энергию связи в трех молекулах: H2O, H2S, H2Se.
Высшие оксиды и летучие водородные соединения (ЛВС)
В периодической таблице Д.И. Менделеева ниже 7 периода находится строка, в которой для каждой группы указаны соответствующие высшие оксиды, ниже строка с летучими водородными соединениями.
Для элементов главных подгрупп начиная с IV группы (в большинстве случае) максимальная степень окисления (СО) определяется по номеру группы. К примеру, для серы (в VI группе) максимальная СО = +6, которую она проявляет в соединениях: H2SO4, SO3.
На экзамене строка с готовыми “высшими” оксидами, как в таблице наверху, может отсутствовать. Считаю важным подготовить вас к этому. Предположим, что эта строчка внезапно исчезла из таблицы, и вам нужно записать высшие оксиды для фосфора и углерода.
С летучими водородными соединениями (ЛВС) ситуация аналогичная: их может не быть в периодической таблице Д.И. Менделеева, которая попадется на экзамене. Я расскажу вам, как легко их запомнить.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.