Нитроэтан что это такое



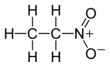
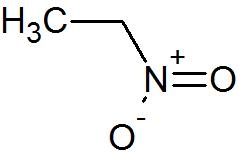
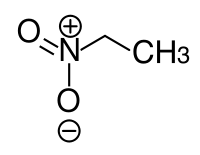
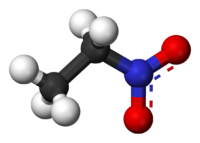
Нитроэтан является органическое соединение имеющий химическую формулу C2ЧАС5НЕТ2. Во многом похож на нитрометан, нитроэтан представляет собой маслянистую жидкость при стандартной температуре и давлении. Чистый нитроэтан бесцветен и имеет фруктовый запах.
Содержание
Подготовка
В качестве альтернативы нитроэтан может производиться Виктор Мейер реакция галогенэтанов, таких как хлорэтан, бромэтан, или же йодэтан с нитритом серебра в диэтиловый эфир или же THF. Модификация этой реакции Корнблюма использует нитрат натрия в любом диметилсульфоксид или же диметилформамид растворитель. [6]
Использует
Через конденсации, такие как Реакция Генри, нитроэтан превращается в несколько соединений, представляющих коммерческий интерес. Конденсация с 3,4-диметоксибензальдегид дает предшественник антигипертензивный препарат, средство, медикамент метилдопа; конденсация с незамещенным бензальдегидом дает фенил-2-нитропропен. Нитроэтан конденсируется с двумя эквивалентами формальдегид дать, после гидрирование, 2-амино-2-метил-1,3-пропандиол, который, в свою очередь, конденсируется с олеиновой кислотой с образованием оксазолина, который протонируется с образованием катионного поверхностно-активное вещество. [5]
Как и некоторые другие нитрованные органические соединения, нитроэтан также используется в качестве топливная добавка и предшественник Ракетное топливо.
Нитроэтан ранее успешно использовался в качестве химического сырья (ингредиентов-прекурсоров) в лабораториях для синтеза множества веществ и потребительских товаров, например Первитин в медицине использовался широко в XIX и XX веках (особенно популярным во время Второй мировой войны союзными войсками и нацистами для повышения настроения, подавления аппетита и сна, а также повышения концентрации внимания и внимания), нитроалканы были одним из многих ингредиентов, используемых в синтезе многих фенэтиламины, включая лекарства, такие как первитин и рацемическое соединение Бензедрин. [7] анорексическое лекарство от ожирения. [8]
Токсичность
Предполагается, что нитроэтан вызывает генетические повреждения и вреден для нервная система. Типичное значение TLV / TWA составляет 100 частей на миллион. Типичное значение STEL составляет 150 частей на миллион. Причины контакта с кожей дерматит в людях. В исследованиях на животных наблюдалось, что воздействие нитроэтана вызывает слезотечение, одышка, легочные хрипы, отек, повреждение печени и почек и наркоз. [9] Дети отравились в результате случайного проглатывания жидкости для снятия искусственных ногтей. [10]
Нитроэтан 100 гр 30 % (250мл раствора в дхм)
Нитроэтан используется в органическом синтезе и в качестве растворителя.
Купить нитроэтан
Брутто-формула вещества — C2H5NO2, текстовый вариант — CH3CH2NO2.
Молекулярная масса (в а.е.м.) соединения — 75,07.
Это вещество может растворять воски, жиры и другие вещества, вообще это — неплохой растворитель:
Особенности получения
Нитроэтан получают в результате нитрования пропана азотной кислотой в газовой фазе при атмосферном давлении, температура при этом находится в диапазоне от 390 до 480 ℃.
В результате пиролиза углеводородных радикалов образуются нитроалканы (число атомов меньше, чем было у исходного пропана). В состав полученного соединения входит: нитрометан, 1-нитропропан, нитроэтан, 2-нитропропан. В процессе реакции также образуются нитроалканы и продукты окисления углеводорода. Соединение разделяется в результате фракционной перегонки.
Используется для проведения органического синтеза, а также в качестве растворителя.
Доставка осуществляется во все города России, поэтому купить нитроэтан могут все, кому необходимо: вы получите заказ в течение нескольких дней или часов (жители Челябинска и области).
Нитроэтан 100 гр 30 % (250мл раствора в дхм) отзывы
Нитроэтан используется в органическом синтезе и в качестве растворителя.
Купить нитроэтан
Брутто-формула вещества — C2H5NO2, текстовый вариант — CH3CH2NO2.
Молекулярная масса (в а.е.м.) соединения — 75,07.
Это вещество может растворять воски, жиры и другие вещества, вообще это — неплохой растворитель:
Особенности получения
Нитроэтан получают в результате нитрования пропана азотной кислотой в газовой фазе при атмосферном давлении, температура при этом находится в диапазоне от 390 до 480 ℃.
В результате пиролиза углеводородных радикалов образуются нитроалканы (число атомов меньше, чем было у исходного пропана). В состав полученного соединения входит: нитрометан, 1-нитропропан, нитроэтан, 2-нитропропан. В процессе реакции также образуются нитроалканы и продукты окисления углеводорода. Соединение разделяется в результате фракционной перегонки.
Используется для проведения органического синтеза, а также в качестве растворителя.
Доставка осуществляется во все города России, поэтому купить нитроэтан могут все, кому необходимо: вы получите заказ в течение нескольких дней или часов (жители Челябинска и области).
Нитроэтан что это такое
1. Из хлоруксусной/хлорпропионовой кислот.
А) Предоставлено Химическим Мозгом
Б) Предоставлено Zealot’ом.
CH3CH(Cl)COONa + NaNO2 => CH3CH(NO2)COONa + NaCl,
CH3CH(NO2)COONa + H2O => CH3CH2NO2 + NaHCO3,
CH3CH(NO2)COONa + NaHCO3 => CH3CH(OH)COONa + NaCl + CO2;
Третья реакция приводит к уменьшению выхода нитроэтана, но может быть частично задержана
прибавлением борной кислоты. Выход нитроэтана может быть, таким образом, повышен до 58%.
К смеси 50 г а-хлорпропионовой кислоты прибавляют мелкими порциями
50 г кальцинированной соды,
следя за тем, чтобы температура не превышала 10°С, раствор точно нейтрализуют 0,5М соляной кислотой
в присутствии фенолфталеина, прибавляют к нему раствор 32 г азотистокислого натрия в 50 мл воды и
25-30 г борной кислоты, после чего смесь нагревают на небольшом пламени в колбе, снабженной погруженным в жидкость термометром и длинным нисходящим холодильником. При 45° начинает выделяться углекислота и небольшое количество окислов азота. Жидкость приобретает зеленую окраску, которая при
80° становится очень интенсивной. При этом начинает отгоняться нитрометан, а зеленая окраска раствора постепенно исчезает. Смесь нагревают до 110°, причем раствор становится оранжево-желтым. Водный слой дестиллата отделяют от нитроэтана, прибавляют к нему примерно одну треть по весу хлористого натрия и снова перегоняют, повышая температуру до 110°. Эту операцию повторяют несколько раз. Нитроэтан высушивают хлористым кальцием и перегоняют над небольшим количеством окиси ртути. Ткип. 98-102°.
Выход 18,7 г (54%). В водном дестиллате можно обнаружить лишь очень незначительное, количество синильной кислоты. Реакция протекает очень гладко и без вспенивания. При работе с нитроэтаном
необходимо соблюдать меры предосторожности.
Аналогичным образом из 50 г а-бромпропионовой к-ты, 35 г соды и 23 г нитрита натрия можно получить до 12,5 г нитроэтана (50% от теор.).
От себя добавлю, что я получал около полулитра нитроэтана этим способом. Он превосходно работает. Только вот при добавлении борной к-ты у меня никогда не происходило позеленение р-ра. Он всегда оставался светло-желтым. А указанное кол-во борной к-ты не сразу растворяется в РМ, но по мере нагревания все растворяется. В остальном все работает в точности как описано.
2. Нитрометан и нитроэтан из метил/этилсульфата натрия.
Вчера я непринуждённо прогуливался возле своего дома и вдруг обнаружил, что что-то липкое, горячее и вонючее стекает по моей голове – причиной этого был, конечно, голубь, который, пролетая надо мной, сиранул. В порыве ненависти к неопрятной птице, я сдёрнул с плеча свою пятиствольную полуавтоматическую винтовку и всадил в наглеца весь магазин. Придя домой и ощипав то, что осталось от бездыханной тушки, я с удивлением обнаружил, что на её коже мелкими китайскими иероглифами вытатуировано послание! Вот приблизительный перевод того, что возможно было разобрать:
« Ну что же, мой дорогой император, позволь мне с радостию и удовлетворением сообщить тебе, что получение нитрометана на кухне не только реалистично, но и практически опробовано! Для того, чтобы обзавестись неким количеством оного, прикажи своим придворным алхимикам поступить следующим образом:
Нитрометан отгоняется весьма медленно, примерно 5-10 капель в минуту, под конец – реже. Когда выделение прекратится, объём полученного нитрометана составит 6 мл, что соответствует 46% выходу (в точности как в древних манускриптах) в пересчёте на метилсульфат. Он лишь совсем чуть-чуть желтоватый, причём большая часть желтизны проходит в самом начале отгонки.
Элементарный расчёт показывает, что из всего полученного на первой стадии метилсульфата На таким образом выйдет около 20 мл.»
На этом бедное животное обрывалось.
Нитроэтан может быть получен аналогичным образом заменой в вышеприведённом синтезе метилового спирта на этиловый. Первенство в этой области принадлежит другу великолепного Витша, который не только первый получил нитроэтан на кухне, но и вообще был первым юхимиком, экспериментально подтвердившим работоспособность этой реакции. К сожалению, подробное описание Витша действий своего друга всё ещё в пути.
Эта реакция не оптимизирована, и выходы, особенно в случае нитроэтана, часто оставляют желать лучшего. Однако известно, что она катализируется водой.
Вот что пишет по этому поводу тот же самый МунЛайт:
Там, на баржЕ! Чё, уснули все?
Лан, не ссыте, я вас ща повеселю.
Вот, например, был один мальчик по имени Федя, но вот он вырос и стал бабушкой.
А ещё у меня в комнате не так давно появилась розетка под кроватью. Если в неё засунуть провода от наушников, то некоторое время всё темнеет перед глазами, становится расплывчатым, а потом в наушниках раздаётся отчётливый голос:
«…знаете ли Вы, уважаемые, что реакия этилсульфата калия с нитритом натрия и впрямь катализируется водой?
Намёки на это впервые были высказаны Циммерманом. Были и косвенные причины предполагать о пользе воды в такого типа р-ции: ведь известно, что, по крайней мере, нитрометан, можно получать пропусканием метил хлорида (а лучше, бромида) в кипящий водный р-р нитрита натрия.
Но причины, сподвергшие НЕКОЗЛЮ на опыт с водой были совсем иного рода. Просто ему хотелось попробовать выдуть из р-ционной смеси остаточный нитроэтан из того ничтожно малого кол-ва, что, увы, неизменно получалось у него раз за разом при проведении этой р-ции.
Итак, вот что он сделал.
1. Этилсерная кислота.
Сульфат мельчить не надо. Засыпаете в горячую после смешивания смесь кты со спиртом и охлаждаете под струёй воды при непрерывном встряхивании до примерно КТ (во избежание образования комков – ибо NaSO4 начинает связывать 10 молекул воды ниже 32 С). Просто хорошенько встряхивайте смесь периодически. Через двое суток она приобретет слабую красно/желтоватую окраску, что НЕКОЗЛЮ всегда рассматривал как индикатор полного обезвоживания (точнее, его наступления какое-то время назад). Если оставить её стоять ещё на денёк не встряхивая, то нижние солянистые слои слипнутся и позволят слить верхний слой без фильтрации, каковая есть весьма неприятна.
Пока этилсерная кта готовится, приготовьте насыщенный р-р КОН в 95% EtOH (именно калиевой щёлочи – оная куда как лучше р-рима в спирте). Р-р станет интенсивно жёлтым – это ОК (храните такие р-ры только в плотно укупореной полиэтиленовой таре – например, в бутылке из-под Белизны.) Этот р-р обязательно должен быть протитрован (20% серняга+кубик льда), т.к. все щёлочи частично состоят из воды – вам необходимо узнать точную конц-ю КОН в р-ре. Сам же раствор положите в холодильник (в морозилке он встанет колом и вам потом придётся его отогревать). Р-р НЕКОЗЛЮ был 22,9% вес/объём (т.е., 22,9г КОН на 100мл р-ра).
85мл этилсерной кты (плотность=1,28, теоретическая конц. кты по весу=93,8%) наливают в капельную воронку и охлаждают в морозилке. Колбу на 300мл помещают на водноледяную баню под мешалку и наливают в неё 190мл 22,9% р-ра КОН в спирте (где-то 5% избыток от теории). Когда всё охладится, этилсерная кта добавляется в щёлочь со скоростью три капли в секунду при интенсивном перемешивании (и периодически помешивайте лёд в бане, кст).
5мл кты, за р-цией нужно начинать сериозно следить – т.е., мерить рН каждые 5-10 секунд. Заранее подготовьте 5 мл р-ра щёлочи, чтобы вылить их при первых признаках покисления среды. Если вы всё сделаете правильно (т.е., как описано выше), то это произойдёт в самом-самом конце. И элементарный расчёт покажет, что полученный Вами этилсульфат калия имеет 94%-ную чистоту.
Спирт затем частично отгоняется, пока не надоест, и остаток высушивается в эмалированной миске на кипящей водяной бане под тягой (без тяги этого достичь, кст, затруднительно, так что ищите тягу).
2. Нитроэтан «на мокрую» (бета, гамма, а то и дельта-версия).
НЕКОЗЛЮ рассуждал: «успех р-ции зависит в основном от того, насколько велика поверхность соприкосновения солей. Стало быть, попробую-ка я всыпать нитрит в ещё влажную кашицу этилсульфата и выпарить влагу из них в смеси. Наверное, будут улучшения!» И вот он ставит свои кашу из двух говён (о двух говнах) под тягу на ковшик с кипящей водой. И уезжает прочь на пару-тройку часов.
Приехав обратно, он обнаруживает, что смесь ещё не выпарилась, запах спирта очень силён, да только вроде как не совсем спирта, а чего-то ещё такого спиртоподобного (в общем, типа нитроэтан). С охами и ахами густое двуговние было скатано в комочки и запхнуто в 250мл колбу, кояя окуналась в масло при темп. 130-140 С.
Сначала отогнался густой туман с ароматным запахом «этилсульфатного» нитроэтана – т.е., не спиртоподобным, а каким-то таким, сладким. Потом смесь стала сухой, и НЕКОЗЛЮ заметил, как вверх и вниз текут тонкие струйки нитроэтана. Обычно в это месте он нагревал колбу до опупения, чтобы всё отогнать, и получал ничтожный объём никуда не годной жидкости. Но в этот раз он вспомнил про свой коварный план отгонки с паром. И впрыснул внутрь колбы
Каково же было его удивление, когда он увидел, что продолжительное кипение и пузырение смеси (содержимое как бы стало полужидким) не может объясняться одной лишь водой – кроме того, струйки жидкости, стекавшей вниз по холодильнику, совсем не были похожи на воду, а были похожи как раз на нитроэтан. Эта отгонка продолжалась 30-60 минут, после чего затихла. В смесь прыснули ещё несколько порций воды, но видимыми признаками реакции это не сопровождалось и дистиллят, протестированный после 3-ей порции насыщением хлористым кальцием, заметного кол-ва нитроэтана не содержал.
Полученный отгон насытили CaCl2, верхний слой отделили и посушили на ночь ещё немножечком СаХл2. В общем целом – около 9мл (17,6%). Грязного.
В любом случае, это первый реальный выход нитроэтана из всех МНОГОЧИСЛЕННЫХ предыдущих попыток НЕКОЗЛЮ.
Но кто знает, быть может, много продукта испарилось во время совместной упарки солей?
Быть может, их вообще смешивать в сухом виде – раз р-ция всё равно «разжижается»?
Альтернативный способ получения метил/алкилсульфата натрия, с проведением нейтрализации алкилсерной кты в водной среде (с также практически количественным выходом) можно увидеть в процедуре метилирования гидрохинона, также опробованной НЕКОЗЛЮ.
3. Нитроэтан из этилбромида или этилиодида в ДМСО или ДМФ.
Этот метод дорог, но единственный на сегодняшний день пригодный для получения нитроэтана в средних или больших кол-вах. Правда, реакция эта весьма капризна и также работает не всегда. Подробнее об этом см. вот здесь.
О получении этил бромида и этил иодида см. получение алкилгалогенидов.
нитроэтан
В промышленности производят четыре нитроалкана (нитро-парафина). Они получаются нитрованием пропана в паровой фазе. Обычно эти нитросоединения содержат в качестве примесей формальдегид и уксусный альдегид, которые можно определить с помощью метода, основанного на использовании солянокислого гидроксиламмония. Вода может присутствовать в нитропара-финах в количествах, соответствующих ее растворимости, однако, как правило, ее содержание невелико.
Если содержание воды не превышает 0.1%, то оно может быть определено методом К. Фишера с точностью приблизительно до + 0.005%. Этиловый и метиловый спирты обычно содержатся в нитропарафинах в небольших количествах.
Нитроалканы характеризуются весьма высокой реакционной способностью. В водных растворах первичные и вторичные нитро-алканы находятся в равновесии с их таутомерными аци-формами, представляющими собой псевдокислоты. Они слабо растворимы в воде; аци-форма растворима лучше и может обратимо реагировать со щелочами с образованием растворимых в воде солей. Концентрированные щелочи и безводные амины превращают нитроалканы в триалкилизоксазолы. Нитрометан очень чувствителен к действию щелочей.
Сильные минеральные кислоты превращают нитроалканы в соответствующие гидроксамовые кислоты, которые могут подвергаться дальнейшему гидролизу до карбоновых кислот и гидроксиламина. Альдегиды под действием сильных щелочей конденсируются с нитроалканами, образуя нитроспирты. В присутствии слабых оснований, например алкиламина, нитроалканы конденсируются, образуя β-диоксимы.
Осушка нитроалканов. Наиболее удобным методом осушки нитроалканов является азеотропная перегонка. Не рекомендуется кипятить эти вещества слишком долго, поскольку при температурах кипения, отвечающих атмосферному давлению они несколько разлагаются. В тех случаях, когда содержание воды не превышает 0.25%, в качестве осушителя рекомендуется использовать драйерит. Нитроалканы, содержащие максимально 0.002% воды, могут быть получены азеотропной перегонкой с последующей осушкой драйеритом. Райт, Марей-Раст и Хартли показали, что пятиокись фосфора не может быть использована для осушки нитрометана. Если осушить нитроалкан пятиокисью фосфора и перегнать, то в холодильнике соберется белый остаток.
Продажные нитроалканы темнеют при хранении. В то же время очень чистые препараты при хранении в темных склянках в отсутствие прямого освещения и в достаточно холодном месте портятся очень незначительно.
Химические свойства нитроалканов свидетельствуют о том, что они не могут служить в качестве растворителей для щелочей, кислот, сильных восстановителей и окислителей. Заметное изменение диэлектрической постоянной этих растворителей по времени (если определять ее при 30° с использованием частот от 3 до 48 килоциклов) является дополнительным указанием на их реакционную способность.
В сборнике «Organic Syntheses» описана методика получения нитрометана из хлоруксусной кислоты и нитрита натрия. Вальден получал нитрометан из нитрита натрия и диметилсульфата.
Методика, описанная в сборнике, является предпочтительной. В результате тщательной осушки сырого продукта, синтезированного по этой методике, драйеритом и его фракционированной перегонки на специальной колонке (типа колонки Penn State) с 25 тарелками при давлении 100 мм можно получить препарат, содержащий 99.98 мол.% нитрометана. Суммарный выход, в расчете на чистое вещество, составляет 25%.
Райт, Марей-Раст и Хартли измеряли, электропроводность нитрометана, полученного из продажного препарата путем осушки над хлористым кальцием и удаления остатков воды азеотропной перегонкой. Летучие примеси удаляли кипячением с обратным холодильником в течение нескольких часов в струе сухого воздуха.
Тернбал и Марон очищали нитрометан, нитроэтан и 2-нитропропан, предназначаемые для определения констант ионизации аци- и нитроформ. Индивидуальные нитропарафины тщательно очищали фракционированной перегонкой. Окислы азота и воду, которые могли присутствовать в препаратах, удаляли, обрабатывая их сначала мочевиной, а затем безводным сульфатом натрия и. в заключение, отделяя осушитель перегонкой препарата при низкой температуре.
Нитроалкан/ Число теоретическихтарелок
Нитроалкан кипятят в течение 1 часа при давлении 100 мм с полной конденсацией флегмы, после чего отбирают дистиллат до тех пор, пока температура не достигнет температуры кипения нитроалкана. Затем отбор прекращают, жидкость кипятят в течение 30 мин. и перегоняют, как описано выше, при полном отборе. Эту процедуру повторяют до удаления всего азеотропа. Затем спускают воду из холодильника и дают возможность парам нитроалкана вытеснить всю воду из трубки для отбора дистиллата. После этого нитроалкан кипятят в течение 2 час с обратным холодильником, а затем перегоняют при флегмовом числе 25: 1, до тех пор пока 25 мл жидкости не будет отгоняться при постоянной температуре, и дистиллат отбрасывают. Перегонку продолжают при флегмовом числе 5:1 (за исключением случая нитро-этана, который отбирают при флегмовом числе 15: 1). В случае 2-нитропропана первые 100 мл отбрасывают, поскольку он может содержать нитроэтан. Для отделения нитроэтана от 2-нитропропана необходимо, чтобы флегмовое число нитроэтана возрастало в процессе перегонки. Количество очищенного нитроалкана лежит в пределах от 800 до 1000 мл для нитрометана, 2-нитропропана и 1-нитропропана и в пределах от 700 до 900 мл для нитроэтана.
Сравнение методов очистки показывает, что получающиеся в настоящее время в промышленности нитроалканы не требуют химической обработки. Достаточной является тщательная перегонка.
Критерии чистоты. Нирмен разработал масс-спектроскопический метод анализа нитроалканов с точностью до + 2%. Точность зависит от чистоты нитроалкана, используемого для калибровки масс-спектрометра.
Дрейсбах и Мартин определяли чистоту нитрометана, нитроэтана и 1-нитропропана на основании кривой замерзания.
Токсикология. Патти считает, что максимально допустимая концентрация нитрометана и нитроэтана в воздухе составляет 0.02%, а 1-нитропропана 0.01%. Для 2-нитропропана Скиннер рекомендует в качестве максимально допустимой концентрации принять концентрацию, равную 0.0025%.
Подробное исследование токсического действия 2-нитропропана при вдыхании было осуществлено Треоном и Дутра. При высоких концентрациях наблюдаются нарушение дыхания, кислородное голодание, цианоз, прострация, а иногда судороги, оканчивающиеся комой и смертью. У кошек, подвергнутых несколько раз действию 2-нитропропана при концентрации, равной 00328%, наблюдалось заболевание печени, а также более или менее сильное перерождение сердца и почек. Была обнаружена также различная степень отека легких. Треон и Дутра пришли к выводу, согласно которому концентрацию 0.005% 2-нитро-пропана в воздухе можно, по-видимому, считать еще переносимой. В настоящее время в качестве максимально допустимых концентраций приняты следующие: для нитрометана 0.0100%, для нитроэтана 0.0100% и для нитропропана 0.0050%.
Данные взяты из справочника А.Вайсбергер, Э.Проскауэр, Дж.Риддик, Э.Тупс
Органические растворители.- М.:Издатинлит, 1958.