Нодулярный склероз что это такое
Лимфома Ходжкина
Информация для родителей
Лимфома Ходжкина (болезнь Ходжкина или лимфогранулематоз) – злокачественное заболевание лимфатической системы.
Причины развития
Лимфома Ходжкина (ЛХ) возникает из-за злокачественного изменения (мутации) В-лимфоцитов. В-лимфоциты — это белые кровяные клетки крови, которые находятся в основном в лимфатической ткани. Поэтому лимфома Ходжкина может развиваться везде, где есть лимфатическая ткань, также она может поражать и другие органы (печень, костный мозг, лёгкие и/или селезёнку).
Распространенность
Формы
Морфологическим субстратом опухоли являются клетки Березовского-Штенберга-Рид, однако, их количество в опухолевой ткани редко превышает 10%. Второй вариант клеток – клетки Ходжкина, которые являются провариантом клетки Березовского-Штенберга-Рид. В зависимости от того, как выглядит ткань опухоли под микроскопом, выделяют пять форм лимфомы Ходжкина.
Клинические стадии
Клиническая стадия определяется согласно классификации Ann Arbor (1971), дополненной рекомендациями, принятыми в Котсвольде (1989):
I стадия — поражение одной или двух группы лимфатических узлов (I) или одного нелимфатического органа (или ткани) — (IE);
II стадия — поражение двух или более лимфатических областей по одну сторону диафрагмы (II) или вовлечение одного нелимфатического органа (или ткани) и одной (или более) лимфатических областей по одну сторону диафрагмы (IIE), поражение селезенки (IIS);
III стадия — поражение лимфатической системы по обе стороны диафрагмы (III), которое может сочетаться с локализованным вовлечением одного нелимфатического органа или ткани (IIIE), или с вовлечением селезенки (IIIS), или поражением того и другого (IIIES);
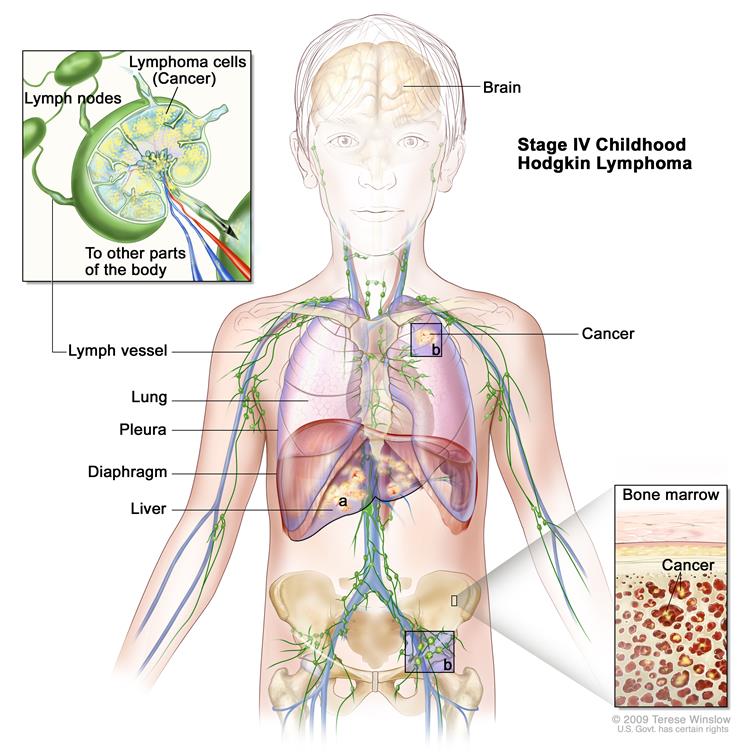
IV стадия — распространенное поражение одного и более нелимфатических органов (легких, плевры, перикарда, костного мозга, костей и проч.) в сочетании или без вовлечения лимфатических узлов.
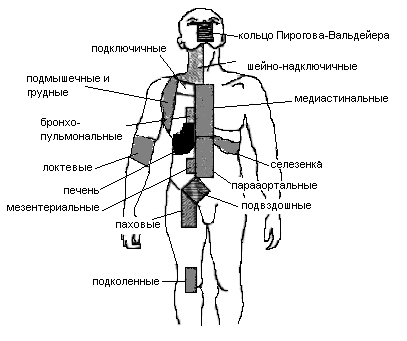
На рис. 1 представлены зоны поражения при лимфоме Ходжкина.
Рис. 1. Зоны поражения при болезни Ходжкина
Симптомы
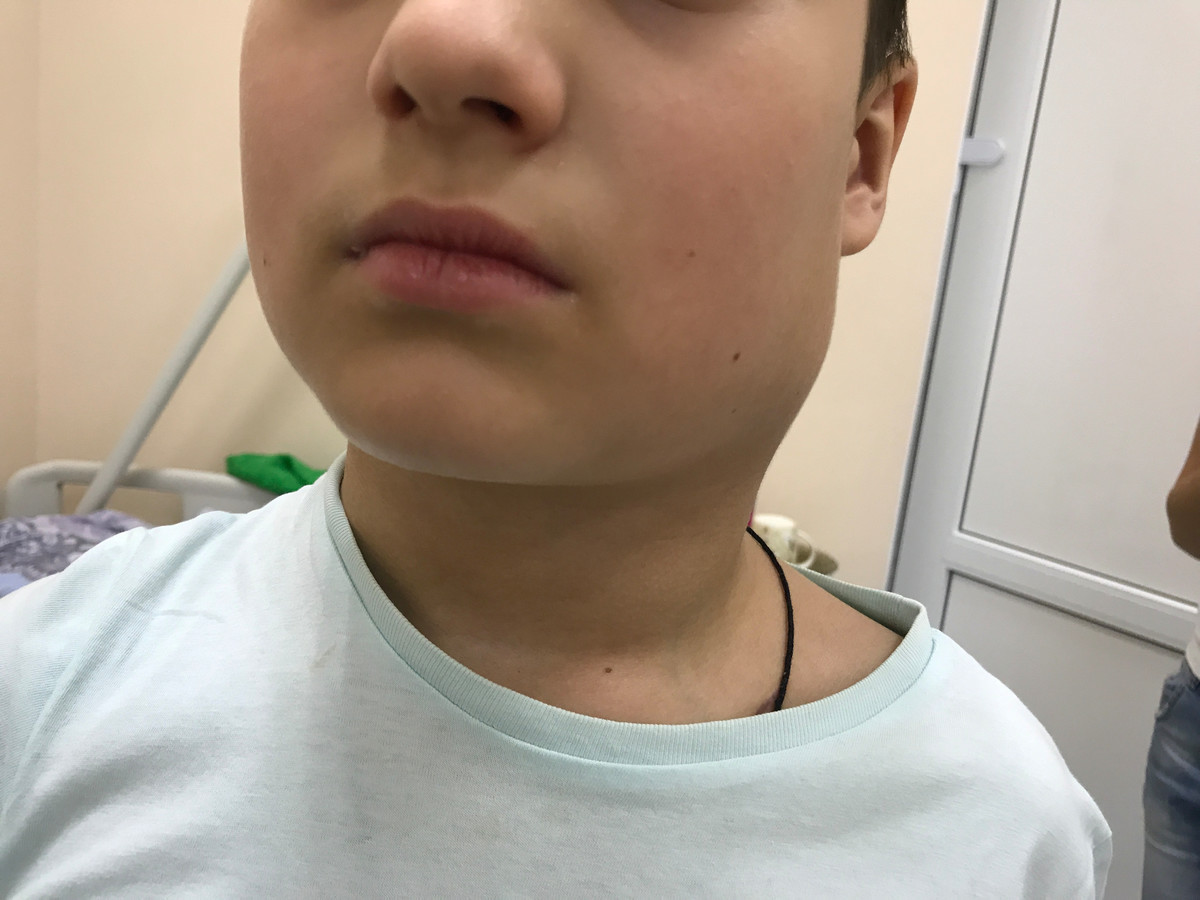
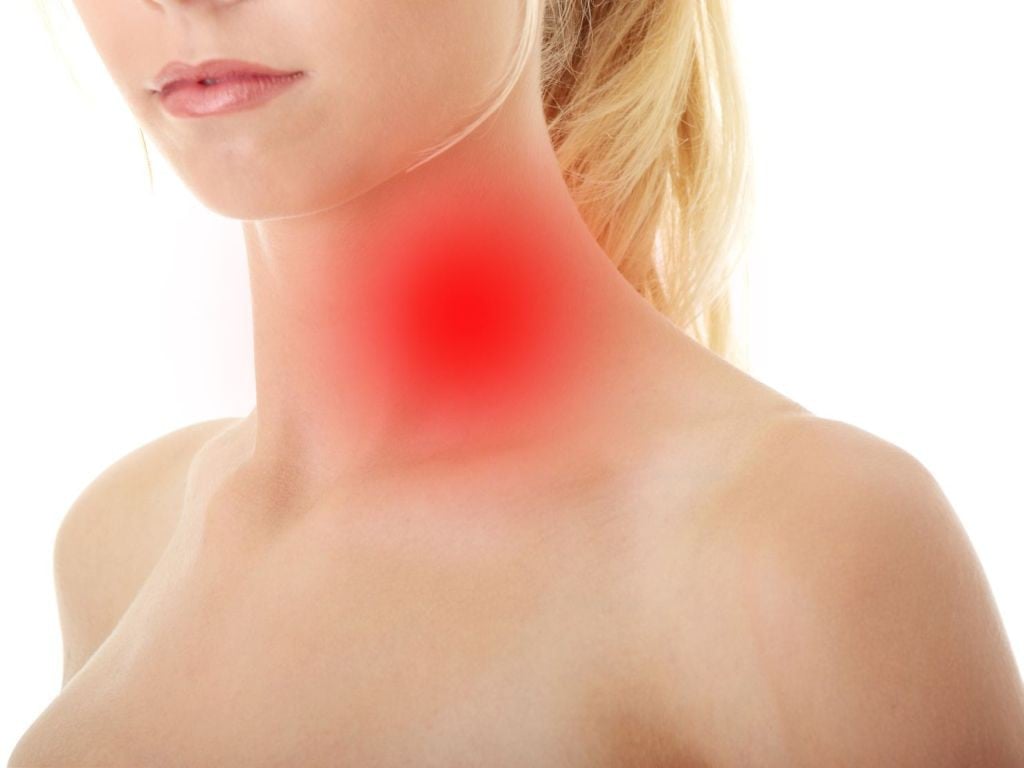
Первым и наиболее характерным симптомом при лимфоме Ходжкина является увеличение лимфатических узлов. Лимфатические узлы, как правило, безболезненные, плотные, подвижные, часто в виде конгломератов (напоминают «мешок с картошкой»). Наиболее часто увеличенные лимфоузлы можно заметить на шее (рис. 2), в области подмышек, рядом с ключицей, в паху или одновременно в нескольких местах. Лимфатические узлы могут увеличиваться и там, где их нельзя прощупать, например, в грудной клетке, животе, в области таза.
Рис. 2. Поражение шейных лимфатических узлов при лимфоме Ходжкина.
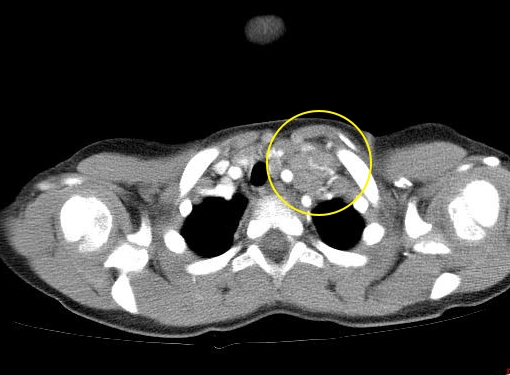
Если увеличенные лимфоузлы находятся в грудной клетке (средостении) (рис. 3), могут появляться приступы кашля или одышка.
Иногда увеличиваются печень и селезенка (в медицинской практике это называется гепатомегалия и спленомегалия).
Поражение ЦНС может развиться в далеко зашедших случаях лимфомы Ходжкина.
Поражение костей: чаще поражаются позвонки, тазобедренные суставы.
Вовлечение костного мозга встречается в 5-10% случаев болезни Ходжкина.
У детей могут появляться общие симптомы заболевания: повышение температуры тела выше 38°С в течение трех дней без признаков инфекционных заболеваний, сильные ночные поты, потеря веса более, чем на 10% за последние 6 месяцев без видимой причины, утомляемость, слабость, кожный зуд по всему телу. Эти симптомы в медицинской практике называют В-симптомами и обозначают буквой «В», их используют в определении стадии заболевания.
Для стадирования необходимо учитывать биологическую активность заболевания. Определяется она на основании двух и более следующих показателей: СОЭ ≥ 30 мм/час; фибриноген ≥ 4 г/л; альбумин ≤ 40 %; СРБ (++ и более); число лейкоцитов ≥ 12х10 /л; альфа-2-глобулин ≥ 12%
Диагностика
Если после тщательного осмотра педиатр находит признаки лимфомы Ходжкина, то он дает направление в специализированный стационар (клинику детской онкологии и гематологии).
В стационаре проводятся:
Рис. 3. Поражение внутригрудных лимфатических узлов при лимфоме Ходжкина
Современные подходы к лечению
Основное место в лечении лимфомы Ходжкина занимает химиотерапия.
Химиотерапия – это лечение лекарственными препаратами (цитостатиками), которые блокируют деление или убивают опухолевые клетки. Максимального эффекта можно добиться используя комбинации цитостатиков (полихимиотерапия — ПХТ), которые по-разному действуют на клетки.
Полихимиотерапия проводится в соответствии с группой риска, в которую отнесен больной при первичном стадировании, в специализированном стационаре.
Первый цикл ПХТ начинается сразу же после подтверждения диагноза и установления стадии, в случае проведения оперативного лечения полихимиотерапия начинается через 5 дней после операции.
После химиотерапии проводится лучевая терапия (облучение) пораженных зон. Лучевая терапия должна начинаться в течение 14 дней от окончания химиотерапии при нормальных показателях крови.
В России сегодня используются две основные программы лечения лимфомы Ходжкина: DAL-HD и СПбЛХ. Оба протокола включают в себя полихимиотерпию и завершающую лучевую терапию. Количество циклов ПХТ зависит от стадии болезни и от выбора терапевтической группы, по которой лечат пациента. Больные обычно получают следующую программу: при благоприятных вариантах (1-я группа риска) – 2 цикла химиотерапии, при промежуточном прогнозе (2-я группа риска) – 4 цикла химиотерапии, при неблагоприятных вариантах (3-я группа риска) – 6 циклов химиотерапии. Разделение больных на группы риска имеет некоторые отличия в зависимости от применяемого протокола.
В программе DAL-HD используются схемы OPPA/OEPA и COPP. В протоколе СПбЛХ – схемы VBVP и ABVD.
Лучевая терапия
Завершающим этапом лечения лимфомы Ходжкина является облучение всех пораженных зон лимфатических узлов. Как правило, лучевую терапию начинают через 2 недели после окончания лекарственной терапии при нормализации показателей крови.
Доза облучения зависит от полноты ремиссии после лекарственной терапии: при достижении полной ремиссии (исчезновение всех клинических и радиологических признаков заболевания) в лимфатической зоне по данным ПЭТ-КТ доза облучения составляет 20 Гр. Если размер опухоли после полихимиотерапии уменьшился на 75% и более от первоначальной опухоли и/или отмечается снижение гиперфиксации РФП по ПЭТ-КТ до 2-3 по Deauville, то доза облучения составляет 25 Гр. При уменьшении опухолевых образований менее чем на 75% и/или сохранении гиперфиксации РФП по ПЭТ-КТ 4-5 по Deauville, то дозу облучения увеличивают до 30 Гр.
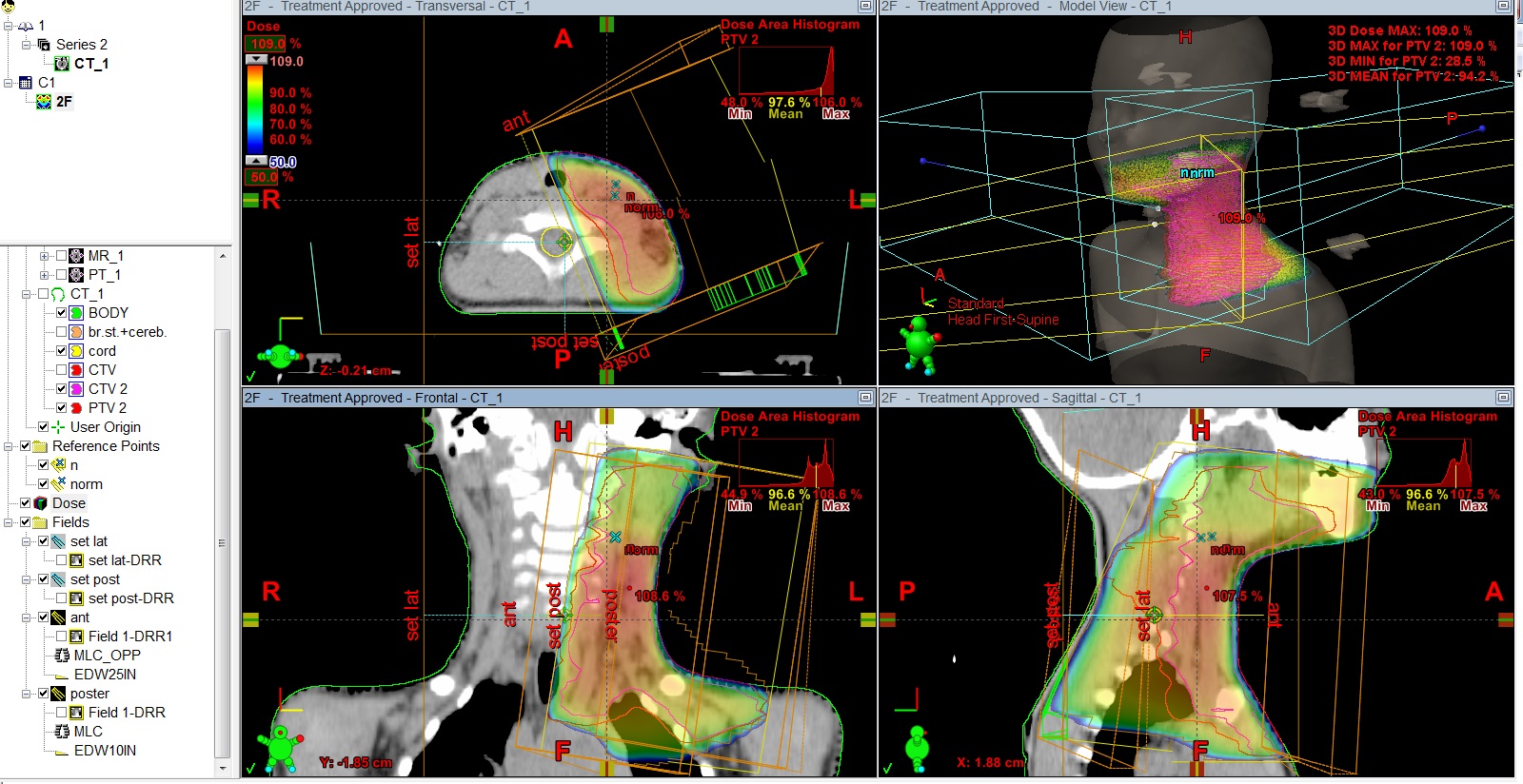
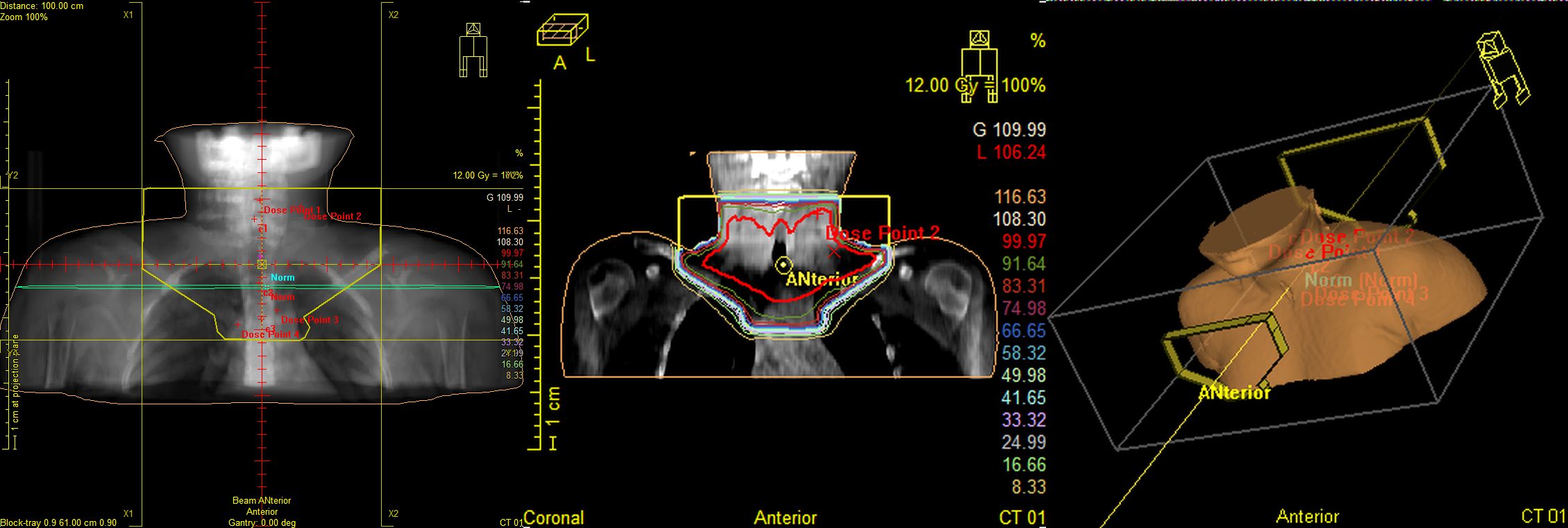
Рис.5 План лучевого лечения. Пациент И., 4 года 6 мес. Лимфома Ходжкина IIст. с поражением шейных, надключичных, подключичных л/у слева, вилочковой железы, носоглотки. Состояние после 4 курсов курсов ПХТ, ремиссия. Облучение шейно-над-подключичных л/у слева с консолидирующей целью, СОД 20 Гр.
Рис.6 Пациентка М., 11лет. Лимфома Ходжкина II ст. с поражением мягких тканей шеи, лимфатических узлов шеи. Состояние после 2 курсов ПХТ. По данным контрольного ПЭТ/КТ метаболически значимых очагов не выявлено, ремиссия. Проведение лучевой терапии первично вовлеченных зон в суммарной очаговой дозе 20,0Гр с целью консолидации.
Критерии оценки полноты ремиссии
Критерии оценки ремиссии нужны врачу для определения необходимости продолжения лечения или интенсификации программ терапии, либо перевода пациента под динамическое наблюдение.
Диспансерное наблюдение
Наблюдение детей и подростков с лимфомой Ходжкина проводится в течение не менее 3-х лет после завершения лечебной программы.
В первом квартале пациент обследуется каждый месяц, в последующие 9 месяцев – каждый квартал и в последующие годы – раз в полгода.
Лимфома Ходжкина относится к числу наиболее излечиваемых онкологических заболеваний и около 80% пациентов живут более 10 лет после окончания лечения.
Авторская публикация:
КУЛЕВА СВЕТЛАНА АЛЕКСАНДРОВНА
заведующая отделением химиотерапии и комбинированного лечения злокачественных опухолей у детей, доктор медицинских наук
Нодулярный склероз
Классическая лимфома Ходжкина (нодулярный склероз) представляет собой тяжёлое заболевание, при котором происходит неопластическая трансформация лимфоидной ткани. Морфологическим субстратом является полиморфноклеточная гранулёма Опухолевый процесс сначала развивается в лимфатических узлах, вилочковой железе, селезёнке, миндалинах, а позднее распространяется на другие органы. Пятилетняя выживаемость взрослых составляет 80%, детей – 90%. Онкологи Юсуповской больницы применяют самые эффективные схемы лечения данной патологии, добиваясь отличных результатов.
Этиология заболевания неизвестна. Патологический процесс может начаться под воздействием следующих факторов:
Диагностика заболевания обязательно включает точное определение стадии болезни. Только после этого онкологи Юсуповской больницы проводят эффективное лечение. При помощи современных методов диагностики проводят:
В большинстве случаев, для диагностики лимфом используют ПЭТ-КТ:
Для постановки диагноза онкологи Юсуповской больницы используют следующие критерии:
После всестороннего обследования устанавливают вид лимфомы и стадию заболевания.
Симптомы лимфомы Ходжкина
В связи с тем, что патологический процесс поражает различные группы лимфатических узлов и многие органы, клиническая картина болезни Ходжкина разнообразна. Чаще всего нодулярный склероз начинается с устойчивого увеличения лимфатических узлов надключичной области. Они подвижные, не спаянные с кожей. Со временем лимфоузлы становятся плотно эластичными, срастаются между собой.
Началом заболевания может быть увеличение селезёнки. При локализации патологического процесса в печени, костном мозге или селезёнке часто отмечаются следующие симптомы:
Чаще всего симптомы интоксикации присоединяются на более поздних стадиях болезни, когда патологический процесс распространяется на все органы. В терминальной стадии заболевания пациентов беспокоит выраженный зуд кожи, который осложняется пиодермией на месте расчёсов, и высыпания различного характера.
Лечение лимфомы Ходжкина
Терапия заболевания зависит от стадии патологического процесса. Для лечения болезни Ходжкина в Юсуповской больнице применяют химиотерапию. В отдельных случаях после химиотерапии назначают лучевую терапию (проводят облучение лимфоузлов, поражённых опухолью, на линейном ускорителе). Во время лечения проводят мониторинг клинико-лабораторных показателей. При наличии выраженной интоксикации проводят внутривенную инфузию кровезаменителей дезинтоксикационного действия, применяют методы экстракорпоральной детоксикации.
При необходимости схему лечения подбирает консилиум специалистов разного профиля. Для предупреждения гематологических осложнений химиотерапевтического лечения используют ростковые факторы. Эффективным методом лечения является трансплантация стволовых клеток. Операцию можно выполнить в клиниках-партнёрах Юсуповской больницы.
Терапия лимфомы Ходжкина онкологами Юсуповской больницы проводится по индивидуально составленному для каждого пациента плану лечения после получения результатов всех необходимых исследований. Цель лечения – достижение полной ремиссии и уничтожение всех атипичных клеток в организме. Если добиться такого результата удаётся, врачи говорят о частичной ремиссии. После лечения в Юсуповской больнице у большинства пациентов улучшается качество жизни, уменьшается выраженность симптомов, приостанавливается прогрессирование лимфомы Ходжкина. Получить консультацию онкогематолога можно, предварительно записавшись на приём по телефону.
Лимфома Ходжкина у взрослых
1. Опасен ли лимфогранулематоз
2. Виды болезни Ходжкина
3. Стадии и категории недуга
4. Диагностика заболевания
5. Методы лечения онкопатологии
6. Борьбы с рецидивом лимфомы
7. Прогноз выживаемости
8. Ведущие клиники
Лимфома Ходжкина – это злокачественное поражение лимфатической системы. Ее также называют болезнью Ходжкина или лимфогранулематозом. Недуг поражает людей всех возрастов. В 60% случаев патологию диагностируют у взрослых. Чаще всего она развивается у пациентов в 20-40 лет и после 50-ти.
Лимфогранулематоз характеризуется медленным течение и имеет благоприятный прогноз. Однако при отсутствии терапии выживаемость больных сокращается в несколько раз. Больше информации о лимфоме Ходжкина, методах ее диагностики и лечения узнайте из статьи.
Слушать статью:
Лимфома Ходжкина – это рак или нет?
Лимфома Ходжкина – онкологическое заболевание, которое образуется из-за патологического роста зрелых В-лимфоцитов (белых кровяных клеток). Она поражает лимфатическую систему – сеть желез и соединяющих их сосудов, распространенных по всему телу.
Поврежденные раком лимфоциты теряют свои свойства борьбы с инфекциями. Это снижает способность организма противостоять вирусным заболеваниям. Cамым ранним симптом недуга является безболезненная опухоль в лимфатическом узле. Как правило, рак затрагивает лимфоузлы в области шеи, подмышек или паха.
По мере прогрессирования заболевания у пациентов отмечается сильная ночная потливость, лихорадка, снижение веса и постоянная усталость. Симптомы онкопатологии могут долгие годы не проводятся, что усугубляет возможность ранней диагностики.
Почему лимфома Ходжкина появляется у взрослых?
Точная причина развития болезни Ходжкина у взрослых неизвестна. Недуг появляется, когда происходит мутация В-клеток крови. Аномальные лимфоциты начинают бесконтрольно делиться в одном или нескольких лимфатических узлах, например в области шее или паха. Со временем злокачественный процесс распространиться на другие части тела.
Риски развития лимфомы Ходжкина увеличиваются при перенесенной инфекции Эпштейна-Барра, наличии семейного анамнеза заболевания, врожденных или приобретенных иммунодефицитах.
Какие виды лимфомы Ходжкина выявляют у взрослых пациентов?
Нодулярный склероз. Наиболее распространенная форма лимфомы Ходжкина. Она часто встречается у молодых людей старше 20 лет, особенно у женщин. Злокачественные узлы обнаруживаются в груди и/или шее. Болезнь вызывает фиброзные рубцы в лимфатических тканях.
Смешанно-клеточный подтип. На него приходится около 25% всех случаев лимфомы Ходжкина. Патологию чаще выявляют у пожилых людей. Она поражает лимфоузлы в брюшной полости и метастазирует в селезенку.
Богатая лимфоцитома. Эта форма заболевания затрагивает примерно 15% всех пациентов с лимфомами. Недуг преимущественно диагностируют у мужчин.
Узловая лимфома. Поражает около 5% пациентов. Характеризуется наличием дольчатых клеток Рида-Штернберга, которые напоминают попкорн. Заболевание чаще всего обнаруживают у людей 30-45 лет.
Стадии и категории лимфомы Ходжкина у взрослых
Лимфома Ходжкина классифицируют по стадиям и категориям. Стадии – 1, 2, 3 и 4 – определяют насколько болезнь распространилась из одного лимфатического узла по всему организму. Например:
Категории – A, B, E, S и X – отвечают за наличие определенных симптомов и распространение онкологического процесса. Согласно этим показателям лимфогранулематоз делится на:
Как диагностируют болезнь Ходжкина у взрослых?
Чтобы диагностировать лимфому Ходжкина, применяют лабораторные тесты, в частности, общий анализ крови для оценки уровня эритроцитов, лейкоцитов и тромбоцитов. Также пациенту выполняют биопсию лимфоузлов и костного мозга. Для определения степени прогрессирования онкопатологии используют компьютерную, магнитно-резонансную томографии и ПЭТ-КТ.
Болезнь Ходжкина у взрослых имеет некоторые сложности диагностики. Она долго может не давать о себе знать, но медленно убивать человека. Поэтому комплексные онкологическое обследования являются залогом своевременного обнаружения недуга и высоких шансов на успех в лечении. Чтобы записаться на онкологический чек-ап за границу, жмите на кнопку ниже и оставляйте свои контакты.
Какое лечение показано при лимфоме Ходжкина у взрослых?
Лечение лимфомы Ходжкина зависит от стадии заболевания. Основными методами борьбы с недугом является химиотерапия и облучение. Химию принимают по схеме ABVD. Она рассчитана на 4-6 курсов, которые проводят за полгода.
Для этого используют комбинацию из нескольких химических препаратов. Их назначают в виде таблеток или внутривенных инъекций. При запущенной форме болезни проводят около 8 курсов химии. Ее сочетают со стероидными лекарствами.
Лучевую терапию при лимфоме Ходжкина применяют как отдельно, так и с химиотерапией. Комбинация этих методов дает наилучшие результаты на 1-2 стадии недуга. Как самостоятельный метод борьбы облучение возможно только на первой стадии или в качестве паллиативной помощи.
Хирургия обычно не используется для этого заболевания. Исключением является биопсия, которая показана для диагностики лимфомы.
Иммунная и таргетная терапии или трансплантация стволовых клеток могут использоваться, если пациент не отвечает на первую линию лечения. В качестве таргетных препаратов рекомендуют моноклональные антитела. Они идентифицируют раковые клетки и блокируют их рост. В настоящее время доступно 2 таргетных лекарства для борьбы с лимфомой Ходжкина. Их вводят путем внутримышечной инъекции.
Иммунная терапия предполагает использование ингибиторов контрольных точек. Эти препараты делают раковые клетки видимыми для иммунной системы и помогают их уничтожить. Они не повреждают здоровые органы и ткани. Ниволумаб и Пембролизумаб – биологические лекарства, которые часто назначают для лечения рецидивирующей лимфомы Ходжкина.
Для борьбы с запущенной лимфомой высокие дозы химиотерапии или радиации сочетают вместе с трансплантацией костного мозга (ТКМ). Перед химией или облучением стволовые клетки удаляются из крови и костного мозга пациента или донора. Затем они замораживаются и хранятся.
После того, как больной завершит агрессивное лечение химическими препаратами или радиацией, сохраненные материал размораживают и обратно вводят в организм.
Для беременных женщин с лимфомой Ходжкина лечение тщательно подбирается мультидисциплинарной командой врачей. Оно направлено на противостояние болезни и максимальную защиту будущего ребенка. Решение о терапии зависит от матери, стадии недуга и срока беременности. Обычно используют иммунные препараты или радиотерапию. При облучении живот женщины покрывают специальным свинцовым экраном, который позволяет защитить ребенка от радиации.
Лечение рецидива лимфомы Ходжкина
Рецидив болезни пациентов на 1-2 стадии развивается у 5-10% случаев. При 3-4 степени онкопатологии ее повторное развитие отмечается у 30% больных. Варианты лечения рецидивирующей лимфомы Ходжкина включают другой режим химиотерапии, лучевую терапию и трансплантацию стволовых клеток с использованием донорского материала, а также таргетные и иммунные препараты.
За рубежом повторное лечение помогает 90% пациентов преодолеть 5-летний порог выживаемости. Для стран СНГ этот показатель ниже. Это связано с доступом к инновационным препаратам и методам онкотерапии.
Сколько можно прожить с болезнью Ходжкина?
За последние несколько десятилетий лечение лимфомы Ходжкина вышло на новый уровень. Внедрение новых химических препаратов, иммунной и таргетной терапии значительно увеличили прогнозы выживаемости. Согласно данным Американского онкологического общества, общие показатели 5-летней выживаемости для всех людей с болезнью Ходжкина составляют около 86%. При этом порог 10-летней выживаемости преодолевает примерно 80%.
По стадиям показатель 5-летней выживаемости выглядит следующим образом:
Где лечат лимфому Ходжкина у взрослых за границей?
Клиника Лив Вадистанбул
Больница Хаима Шибы
Госпиталь СунЧонХян
Университетская клиника Кельна
Больница Медикана Аташехир
Клиника Текнон
Резюме
Чтобы выбрать клинику для лечения лимфомы Ходжкина за рубежом, обращайтесь к врачам-координаторам международной медицинской платформы МедиГлобус. Наши специалисты подберут медцентр, который максимально соответствует Вашим запросам. Они свяжутся с лучшими онкологами и организуют консультацию с ними.
Пресс-центр
Лимфома Ходжкина
В обзорной клинической статье приводятся сведения о патогенезе, диагностике и лечении лимфомы Ходжкина, рассматриваются вопросы ранней диагностики, подчеркивается роль раннего морфологического исследования, лучевых методов диагностики, необходимость создания семенного фонда у молодых мужчин перед началом химиотерапии, важность строгого соблюдения стадирования, уточнения факторов прогноза, неукоснительного соблюдения программ терапии.
Лимфома Ходжкина (болезнь Ходжкина, лимфогранулематоз) – группа заболеваний лимфоидной ткани, включающая как минимум классическую лимфому Ходжкина и нодулярный тип лимфоидного преобладания. Классическая лимфома Ходжкина (ЛХ) – моноклональная опухоль, субстратом которой являются клетки Березовского-Рид-Штернберга (БРШ) и Ходжкина, которые происходят из В-клеток герминального центра фолликула. Они составляют около 1% от массы всей опухолевой ткани, состоящей из реактивных, неопухолевых Т- и В-лимфоцитов с примесью гранулоцитов и макрофагов.
ЛХ впервые описана в 1832 г. Томасом Ходжкином как «заболевание, при котором поражаются лимфатические узлы и селезенка». Спустя 23 года С. Уилкс назвал это состояние болезнью Ходжкина, изучив описанные Т. Ходжкином случаи и добавив к ним 11 собственных наблюдений. Термин «лимфогранулематоз» введен в 1904 г. на VII съезде немецких патологов в Вене. В 2001 г. ВОЗ утвердила название «лимфома Ходжкина» в классификации лимфом.
В РФ общее количество впервые заболевших лимфогранулематозом составляет около 3,5 тыс. человек в год. Выявляются 2 основных пика заболеваемости ЛХ: первый приходится на 15–35 лет, второй наблюдается после 60 лет; соотношение мужчины/женщины примерно равное. В средней полосе России заболеваемость ЛХ составляет около 2,5 на 100 тыс. человек за год. В Москве и Московской области с численностью около 20 млн человек число заболевших может составить около 500 человек в год.
Этиология заболевания не известна. Пристально изучается роль вируса Эпштейна-Барр в возникновении заболевания.
В патогенезе ЛХ рассматриваются следующие проблемы. Морфологическим субстратом болезни является небольшое количество опухолевых клеток в массе опухоли, которая в основном состоит из реактивных Т-клеток, в частности CD4+. Цитокины, выделяемые этими клетками в ответ на опухоль, определяют клинические В-симптомы болезни, а также структуру опухоли, инвазирующей соседние ткани.
С.М. Алещенко с соавт. выделили группы генов, сцепленные с плохим прогнозом – резистентностью к терапии и рецидивирующим на фоне полихимиотерапии (ПХТ) течением.
В целом патогенез ЛХ может рассматриваться как ряд последовательных событий: больной ЛХ получает по одному неблагоприятному признаку вероятности развития ЛХ от каждого из родителей, став гомозиготой по этому признаку. Родители больного ЛХ передают HLA-DR признак, который выявляется определенным набором HLA-DR маркеров. Гены системы HLA-DR локализованы на коротком плече 6-й хромосомы.
По данным Алещенко, у части больных ЛХ выявлены генетические маркеры. Она исследовала 112 больных ЛХ, наблюдавшихся в отделении химиотерапии гематологических заболеваний и интенсивной терапии (ГИИТ) ГНЦ РАМН с 1996 по 2000 г. Изучены образцы геномной ДНК из лимфоцитов периферической крови. Показано, что существует положительная ассоциация между развитием ЛХ и наличием генов Cw7 и DRB1*11. Для носителей специфичности DRB1*07 выявлена значимая отрицательная ассоциация с восприимчивостью к ЛХ. Выявлено снижение риска развития ЛХ в молодом возрасте для лиц, имеющих в HLА-генотипе специфичность DRB1*01. Установлено повышение частоты общих НLA-специфичностей 1-го класса у родительских пар, имеющих больного ребенка. Значение данного показателя составляет соответственно 100% против 60%. Ген DRB1*04 ассоциирован у больных ЛХ с достижением полной ремиссии – частота DRВ1*04 в группе пациентов в ремиссии 5 и более лет (20%) выше частоты данной специфичности в группе больных, рефрактерных к ПХТ первой линии (8%) [1]. У пациентов с факторами риска по системе немецких авторов Хасанклевера и Уолкера Диля, основанной на наблюдении почти 6 тыс. больных ЛХ (мужской пол, возраст старше 45 лет, IV стадия заболевания, уровень гемоглобина менее 105 г/л, лейкоцитоз более 16х10/*9, лимфопения
Представляет интерес изучение полиморфизма генов, ответственных за метаболизм цитостатических препаратов, т. к. в ряде случаев при малой активности соответствующих ферментов мы не получаем противоопухолевого эффекта, при повышенной активности ферментов наблюдаются проявления избыточной токсичности. Возможно, полиморфизм генов системы HLA-DR и генетические механизмы лекарственной резистентности взаимосвязаны.
При изучении изолированных клеток БРШ выявлены глобальные механизмы, которые подавляют специфическую экспрессию генов В-клеток. Показано нарушение активности рецептора тирозинкиназы в клетках БРШ при классическом варианте ЛХ и в меньшей степени при варианте лимфоцитарного преобладания. Эта находка является уникальной для ЛХ и может способствовать более успешной химиотерапии [2].
Наши наблюдения за больными ЛХ с ВИЧ-инфекцией выявляют очень интересную проблему. При рассмотрении кривых заболеваемости ВИЧ-инфицированных больных разными болезнями в течение 15 лет до начала высокоактивной антиретровирусной терапии (ВААРТ) (1981–1996 гг.) и в течение такого же времени после введения ВААРТ (1996 – по настоящее время) оказалось, что в левой части графика заболеваемость злокачественными лимфомами, включая первичную лимфому ЦНС и саркому Капоши, возросла в сравнении с неинфицированной популяцией в 168 раз! Заболеваемость ЛХ и солидными опухолями до начала ВААРТ не отличалась от таковой в здоровой популяции (2,5 на 100 тыс. населения). Напротив, в правой половине графика (т. е. после начала ВААРТ) кривые первых двух болезней резко снизились, первичная лимфома ЦНС и саркома Капоши стали встречаться очень редко. Заболеваемость солидными опухолями не изменилась. Интересным фактом стало увеличение заболеваемости ЛХ до 8 раз с началом приема ВААРТ! Это означает, что для реализации ЛХ как болезни необходимо как минимум присутствие CD4+-лимфоцитов. Продолжение наблюдения за больными ЛХ с ВИЧ-инфекцией показало, что ЛХ у этой группы пациентов излечивается лучше, чем у неинфицированных больных: быстрый регресс симптомов, возможность достичь излечения при грубых нарушениях протокола лечения по времени (чрезмерно затянутые интервалы между курсами ПХТ). Эти два факта, полученные при непосредственном наблюдении и лечении больных ЛХ с ВИЧ-инфекцией, нуждаются в научном объяснении, которого пока нет.
Известен воспалительный синдром иммунологического восстановления у ВИЧ-инфицированных больных (Immune Reconstitution Inflammatory Syndrome – IRIS) –появление новых или обострение ранее пролеченных инфекционных или неинфекционных заболеваний на фоне положительного иммунологического и вирусологического ответа на ВААРТ. Он изучен при туберкулезе и грибковых инфекциях у ВИЧ-инфицированных больных. Оказалось, что при сочетании туберкулеза и ВИЧ-инфекции начало ВААРТ с повышением CD4+ клеток приводит к резкому ухудшению течения туберкулеза, и, напротив, первоначальная терапия туберкулеза с последующим присоединением ВААРТ не сопровождается развитием IRIS. CD4+ клетки необходимы для реализации туберкулезного процесса. Аналогичную картину мы наблюдаем при росте заболеваемости ЛХ в начале ВААРТ. Рассмотрение этого феномена в рамках IRIS заслуживает внимательного изучения. Если при туберкулезе в случае IRIS этиологическим фактором являются микобактерии, то при ЛХ одним из этиологических факторов может быть вирус Эпштейна-Барр.
При смешанно-клеточном варианте ЛХ, который преобладает у ВИЧ-инфицированных больных, нередко обнаруживается геном вируса Эпштейна-Барр в геноме опухолевых клеток.
Особенности характера и личности больных ЛХ заставили нас обратиться к нейрофизиологам, что привело к совместной работе со специалистами по биохимии белка.
В работах А.А. Карелина с соавт. [3] показано, что эритроцит является «эндокринной железой», которая выделяет во внешнюю среду пептиды цепей гемоглобина (Hb) разной длины. В норме и при нескольких изученных заболеваниях (черепно-мозговые травмы, сосудистые поражения головного мозга и др.) при краткосрочном культивировании эритроцитов наблюдали процесс расщепления цепей глобина. При этом обнаруживали короткие пептиды длиной в 50 аминокислотных остатков, которые выделялись через поры мембраны эритроцита. При ЛХ выявили, что пептидные фрагменты короче (30 аминокислотных остатков альфа-цепи гемоглобина), но механизм этого явления до настоящего времени не исследован.
Ранее в комплексе работ акад. В.Т. Иванова с соавт., А.А. Карелина с соавт. [3, 4] показано, что короткие пептиды обладают действием нейропептидов, обусловливая, в частности, гибернацию некоторых животных (медведей). Поводом для этих экспериментов явились клинические наблюдения врачей-гематологов за проявлением высшей нервной деятельности у пациентов, страдающих ЛХ. А.В. Пивник с соавт. [5] отметил своеобразные черты личности и характера этих пациентов: эмоциональная холодность, упрямство, скрытность. Отмечено, что характерологические особенности больных ЛХ ярко проявляются у матерей заболевших. До трети пациентов ЛХ категорически отказываются от рекомендованной полихимио- и лучевой терапии, что ведет к гибели больных в течение ближайших лет.
В результате обсуждений этих психологических особенностей пациентов с ЛХ с психологами и психиатрами было сделано заключение, что для больных ЛХ характерна особенность, отмеченная ранее у пациентов со злокачественными опухолями, а именно инфантильность – отказ согласиться с существованием болезни.
Психиатрами отмечены пограничные состояния и достоверное увеличение числа истинной шизофрении среди пациентов с ЛХ.
Таким образом, накапливается все больше данных об этиотропном действии вируса Эпштейна-Барр у субъекта с широким фоном разнообразных событий, таких как наличие сцепленных с плохим прогнозом генов системы HLA, наличие коротких пептидов, факты их онкогенного действия (О.Н. Блищенко с соавт.), наличие достаточного количества CD4+ Т-лимфоцитов [6, 7].
Морфологические варианты ЛХ
Выделяют следующие морфологические варианты лимфо¬гранулемато¬за (классификация ВОЗ, 2008 г.):
Лимфома Ходжкина, нодулярный тип лимфоидного преобладания.
Классическая лимфома Ходжкина:
• классическая лимфома Ходжкина, лимфоидное преобладание (С81.0 по МКБ);
• классическая лимфома Ходжкина, нодулярный склероз (С81.1);
• классическая лимфома Ходжкина, смешанно-клеточная (С81.2);
• классическая лимфома Ходжкина, лимфоидное истощение (С81.3).
При диагностике обычно биопсии подвергается один из увеличенных периферических лимфоузлов. В случае увеличения только внутригрудных или абдоминальных лимфоузлов или селезенки производится диагностическая торакотомия и лапаротомия или спленэктомия.
При первичном осмотре отсутствие общих симптомов (т. н. В-симптомы активности заболевания) определяется как А-стадия заболевания.
Эта стадия коварна отсутствием серьезных симптомов заболевания, которое проявляется только увеличением одного лимфоузла, например надключичного слева. Пациенты и его семья игнорируют как сам факт увеличения лимфоузла, так и его неуклонный рост. Нередко больной впервые предстает перед врачом с массивной периферической лимфаденопатией, развивающейся за годы болезни. Уместно выделить несколько периодов в «маршруте» больного: обнаружение увеличенного лимфоузла – обращение к врачу – биопсия лимфоузла – начало терапии. Нередко время между этими событиями исчисляется месяцами и годами. Так, больной обращается к врачу через много месяцев или 1–2 года после первого обнаружения увеличенного безболезненного надключичного лимфоузла. Процесс обследования может занимать долгие месяцы, когда больной обходит многих специалистов и сдает огромное количество ненужных анализов, и нередко в раздражении от проволочек покидает лечебное учреждение, иногда навсегда. При первичном обращении пациента и знакомстве с медицинскими документами нередко врач впервые обращает внимание больного на четкие признаки увеличения средостения на флюорограмме, сделанной от 1 года до 3 лет назад. Это происходит из-за плохой организации медицинской помощи. Так, ответ по флюорограмме, сделанной в районном туберкулезном диспансере, на которой выявлено увеличение размеров средостения, при пересылке в районную поликлинику может затеряться. Врач считает, что флюорограмма в норме и поэтому не вызывает больного, а тот уверен, что раз не последовал вызов от врача, значит оснований для беспокойства нет. Врач-кардиолог, который консультирует больного по поводу предполагаемого порока сердца, отвергает свой диагноз, но не направляет больного к онкологу, хотя увеличение размеров средостения требует этого безотлагательно. На просьбу гематолога представить препараты биопсии и блоки удаленного ранее лимфоузла пациент разводит руками: препараты утеряны, блок недоступен, важный материал не сохранился. Наконец, после биопсии, подтверждающей диагноз ЛХ, пациент приступает к лечению.
Увеличение лимфоузлов относится к местным симптомам ЛХ, чаще всего это периферические лимфоузлы выше диафрагмы (подчелюстные, шейные, надключичные, подмышечные, лимфоузлы средостения). Выявление увеличенных лимфоузлов в нетипичных местах – по ходу нервно-сосудистого пучка плеча, в кубитальной ямке, в поясничной области или экстранодальной локализации (молочная железа, мягкие ткани) – всегда свидетельствует о запущенной стадии ЛХ и неблагоприятном прогнозе. В этих случаях проводится дифференциальная диагностика между неопухолевым и опухолевым поражением лимфоузлов. Поражения ЦНС крайне редки, мы наблюдали одну пожилую больную ЛХ с общемозговой симптоматикой и объемным поражением мозга, доказанным с помощью МРТ. Обязательно исключается диагноз боковой кисты шеи, нередко симулирующей ЛХ. Увеличение размеров селезенки обычно выявляется при первичном осмотре, она плотная, гладкая, пальпируется ниже края реберной дуги на несколько сантиметров. Иногда спленомегалия может быть массивной, достигая массы 1 кг и более. Чаще небольшая спленомегалия выявляется при УЗИ живота, превышая нормальные размеры 11х4 см. Значительное увеличение размеров печени подтверждает IV стадию заболевания, которая выявляется нечасто. При ЛХ отмечается появление В-симптомов: лихорадка 38 °С в течение нескольких недель, профузная потливость с необходимостью смены постельного белья, потеря веса на 10% за последние 6 месяцев. Кожный зуд исключен из этих признаков, однако он является прогностическим признаком, который, так же как и гиперэозинофилия, превышающая 10–15% в общем анализе крови, определяет эффект терапии и возникновение рецидивов.
Дифференциальный диагноз проводится с метастазами рака, опухолями головы и шеи, включая назофарингеальную карциному, опухоль Шнитке, опухоли щитовидной железы, опухоли слюнных желез, а также опухолями других локализаций – молочной железы, ЖКТ, гениталий, внегонадными герминогенными опухолями. К неопухолевым заболеваниям относятся: вирусные лимфаденопатии, в первую очередь инфекционный мононуклеоз, в этих случаях не следует торопиться с биопсией лимфоузла, наблюдая за больным несколько недель. Также нельзя забывать о бактериальных лимфаденитах, обычно одонтогенного происхождения. В этих случаях следует назначить пациенту санацию полости рта, лечение антибиотиками и понаблюдать больного в течение нескольких недель. Все чаще при биопсии шейных и надключичных лимфоузлов наблюдается туберкулезное поражение. Мы наблюдали больных с шейной лимфаденопатией при локализации сифилитического шанкра на миндалине и губе. Нам приходилось за 1 неделю работы получать заключения по биопсии лимфоузлов этой области с диагнозами: беспигментная меланома, саркома Капоши, болезнь Гоше, туберкулезный лимфаденит.
Диагноз ЛХ всегда ставится морфологически – по результатам биопсии лимфоузла, селезенки или другой пораженной ткани. Исследование включает описание гистологических срезов, окрашенных гематоксилин-эозином, при световой микроскопии. Недопустимым является предположительный диагноз по цитологическому анализу тонкоигольной пункционной биопсии, полученной при пункции лимфоузла.
Диагноз лимфогранулематоза не выставляется на основании радиологического исследования. Не приемлемы диагнозы ЛХ по «характерной клинической картине и характерной рентгенологической картине». За последние годы выяснилось, что этот стандартный классический метод недостаточен для детальной характеристики вариантов ЛХ. Так называемые лимфомы переходной – «серой» – зоны трактовались как ЛХ, лечились как ЛХ, однако результаты терапии были неудовлетворительными. Это относится к таким формам лимфом, как анаплаcтические В- и Т-лимфомы, В-крупноклеточная лимфома, медиастинальная В-клеточная лимфома со склерозом.
Морфологи ввели новые методы исследования, без которых современный диагноз лимфомы, ЛХ был нередко недостижим. Были введены анти-CD-антитела – иммунные маркеры, прицельно высвечивающие характерные для каждого варианта лимфом клетки. Молекулярно-биологические методы с использованием единичной изолированной опухолевой клетки позволяют изучать в деталях геном опухолевой клетки. Именно комплексные исследования (световое микроскопическое, иммуногистохимическое, молекулярно-биологическое) позволяют сделать патологоанатомическое заключение по поводу конкретного больного [8]. Результаты этих методов исследований, проведенных у нескольких тысяч больных лимфомами, легли в основу классификации злокачественных заболеваний кроветворной и лимфоидной ткани, предложенной ВОЗ в 2008 г.
Поражение одной лимфатической зоны или одного лимфоидного органа (селезенка, тимус, Вальдейрово кольцо) или одного нелимфоидного органа
Поражение 2 и более лимфатических зон с одной стороны диафрагмы (поражение воротных лимфоузлов с обеих сторон диафрагмы относят ко II стадии); локализованное поражение только одного нелимфоидного органа или ткани (например, стенки грудной клетки) по протяжению с одной стороны диафрагмы (IIE). Число пораженных анатомических зон указывается арабской цифрой, нижним индексом (II 3 )
Поражение лимфатических зон с обеих сторон диафрагмы (III), которое может сопровождаться поражением селезенки (III S ) или локальным поражением по протяжению только одного нелимфоидного органа/ткани или и того и другого (IIISE).
III 1 с поражением селезеночных, воротных или портальных лимфоузлов либо без него
III 2 с поражением парааортальных, подвздошных и мезентериальных лимфоузлов
Диффузное или диссеминированное поражение нелимфоидного органа (или ткани) с поражением лимфоузлов или без него
Дополнительные обозначения, указываемые с любой стадией