Нормотрофия у ребенка что это
Гипотрофия у детей
Гипотрофия у детей – хроническое нарушение питания, сопровождающееся недостаточным приростом массы тела ребенка по отношению к его росту и возрасту. Гипотрофия у детей выражается отставанием ребенка в весе, задержкой в росте, отставанием в психомоторном развитии, недоразвитием подкожно-жирового слоя, снижением тургора кожных покровов. Диагностика гипотрофии у детей основывается на данных осмотра и анализа антропометрических показателей физического развития ребенка. Лечение гипотрофии у детей предусматривает изменение режима, рациона и калорийности питания ребенка и кормящей матери; при необходимости – парентеральную коррекцию метаболических нарушений.
Общие сведения
Гипотрофия у детей – дефицит массы тела, обусловленный нарушением усвоения или недостаточным поступлением питательных веществ в организм ребенка. В педиатрии гипотрофия, паратрофия и гипостатура рассматриваются как самостоятельные виды хронического расстройства питания у детей – дистрофии. Гипотрофия является наиболее распространенным и значимым вариантом дистрофии, которому особенно подвержены дети первых 3-х лет жизни. Распространенность гипотрофии у детей в различных странах мира, в зависимости от уровня их социально-экономического развития, колеблется от 2-7 до 30 %.
О гипотрофии у ребенка говорят при отставании массы тела более чем на 10% по сравнению с возрастной нормой. Гипотрофия у детей сопровождается серьезными нарушениями обменных процессов, снижением иммунитета, отставанием психомоторного и речевого развития.
Причины гипотрофии у детей
К хроническому расстройству питания могут приводить различные факторы, действующие в пренатальном или постнатальном периоде.
Внутриутробная гипотрофия у детей связана с неблагоприятными условиями, нарушающими нормальное развитие плода. В пренатальном периоде к гипотрофии плода и новорожденного могут приводить патология беременности (токсикоз, гестоз, фетоплацентарная недостаточность, преждевременные роды), соматические заболевания беременной (сахарный диабет, нефропатии, пиелонефрит, пороки сердца, гипертония и др.), нервные стрессы, вредные привычки, недостаточное питание женщины, производственные и экологические вредности, внутриутробное инфицирование и гипоксия плода.
Внеутробная гипотрофия у детей раннего возраста может быть обусловлена эндогенными и экзогенными причинами. К причинам эндогенного порядка относятся хромосомные аномалии и врожденные пороки развития, ферментопатии (целиакия, дисахаридазная лактазная недостаточность, синдром мальабсорбции и др.), состояния иммунодефицита, аномалии конституции (диатезы).
Экзогенные факторы, приводящие к гипотрофии у детей, делятся на алиментарные, инфекционные и социальные. Алиментарные влияния связаны с белково-энергетическим дефицитом вследствие недостаточного или несбалансированного питания. Гипотрофия у ребенка может являться следствием постоянного недокармливания, связанного с затруднением сосания при неправильной форме сосков у матери (плоские или втянутые соски), гипогалактией, недостаточным количеством молочной смеси, обильным срыгиванием, качественно неполноценным питанием (дефицитом микроэлементов), плохим питанием кормящей матери и пр. К этой же группе причин следует отнести заболевания самого новорожденного, не позволяющие ему активно сосать и получать необходимое количество пищи: расщелины губы и неба (заячья губа, волчья пасть), врожденные пороки сердца, родовые травмы, перинатальные энцефалопатии, пилоростеноз, ДЦП, алкогольный синдром плода и пр.
К развитию приобретенной гипотрофии склонны дети, болеющие частыми ОРВИ, кишечными инфекциями, пневмонией, туберкулезом и др. Важная роль в возникновении гипотрофии у детей принадлежит неблагоприятным санитарно-гигиеническим условиям – плохому уходу за ребенком, недостаточному пребыванию на свежем воздухе, редким купаниям, недостаточному сну.
Классификация гипотрофии у детей
Таким образом, по времени возникновения различают внутриутробную (пренатальную, врожденную), постнатальную (приобретенную) и смешанную гипотрофию у детей. В основе развития врожденной гипотрофии лежит нарушение маточно-плацентарного кровообращения, гипоксия плода и, как следствие, нарушение трофических процессов, приводящих к задержке внутриутробного развития. В патогенезе приобретенной гипотрофии у детей ведущая роль принадлежит белково-энергетическому дефициту вследствие недостаточного питания, нарушения процессов переваривания пищи или всасывания питательных веществ. При этом энергетические затраты растущего организма не компенсируются пищей, поступающей извне. При смешанной форме гипотрофии у детей к неблагоприятным факторам, действовавшим во внутриутробном периоде, после рождения присоединяются алиментарные, инфекционные или социальные воздействия.
По выраженности дефицита массы тела у детей различают гипотрофию I (легкой), II (средней) и III (тяжелой) степени. О гипотрофии I степени говорят при отставании ребенка в весе на 10-20% от возрастной нормы при нормальном росте. Гипотрофия II степени у детей характеризуется снижением веса на 20-30% и отставанием роста на 2-3 см. При гипотрофии III степени дефицит массы тела превышает 30 % от долженствующей по возрасту, имеется значительное отставание в росте.
В течении гипотрофии у детей выделяют начальный период, этапы прогрессирования, стабилизации и реконвалесценции.
Симптомы гипотрофии у детей
При гипотрофии I степени состояние детей удовлетворительное; нервно-психическое развитие соответствует возрасту; может иметь место умеренное снижение аппетита. При внимательном осмотре обнаруживается бледность кожных покровов, снижение тургора тканей, истончение толщины подкожно-жирового слоя на животе.
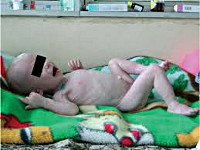
Гипотрофия III степени у детей характеризуется резким истощением: подкожно-жировой слой атрофируется на всем туловище и на лице. Ребенок вял, адинамичен; практически не реагирует на раздражители (звук, свет, боль); резко отстает в росте и нервно-психическом развитии. Кожные покровы бледно-серого цвета, слизистые оболочки сухие и бледные; мышца атрофичны, тургор тканей полностью утрачен. Истощение и обезвоживание приводят к западению глазных яблок и родничка, заострению черт лица, образованию трещин в углах рта, нарушению терморегуляции. Дети склонны к срыгиванию, рвоте, поносам, урежению мочеиспускания. У детей с гипотрофией III степени часто отмечаются конъюнктивиты, кандидозный стоматит (молочница), глоссит, алопеция, ателектазы в легких, застойные пневмонии, рахит, анемии. В терминальной стадии гипотрофии у детей развивается гипотермия, брадикардия, гипогликемия.
Диагностика гипотрофии у детей
Внутриутробная гипотрофия плода, как правило, выявляется при УЗИ-скрининге беременных. В процессе акушерского УЗИ определяются размеры головки, длина и предполагаемая масса плода. При задержке внутриутробного развития плода акушер-гинеколог направляет беременную в стационар для уточнения причин гипотрофии.
У новорожденных детей наличие гипотрофии может выявляться неонатологом сразу после рождения. Приобретенная гипотрофия обнаруживается педиатром в процессе динамического наблюдения ребенка и контроля основных антропометрических показателей. Антропометрия у детей включает оценку параметров физического развития: длины, массы, окружности головы, груди, плеча, живота, бедра, толщины кожно-жировых складок.
При выявлении гипотрофии проводится углубленное обследование детей для уточнения возможных причин ее развития. С этой целью организуются консультации детских специалистов (детского невролога, детского кардиолога, детского гастроэнтеролога, инфекциониста, генетика) и диагностические исследования (УЗИ брюшной полости, ЭКГ, ЭхоКГ, ЭЭГ, исследование копрограммы и кала на дисбактериоз, биохимическое исследование крови и пр.).
Лечение гипотрофии у детей
Лечение постнатальной гипотрофии I степени у детей проводится амбулаторно, гипотрофии II и III степени — в условиях стационара. Основные мероприятия включают устранение причин нарушения питания, диетотерапию, организацию правильного ухода, коррекцию метаболических нарушений.
Диетотерапия при гипотрофии у детей реализуется в 2 этапа: уточнение переносимости пищи (от 3-4 до 10-12 дней) и постепенное увеличение объема и калорийности пищи до физиологической возрастной нормы. Реализация диетотерапии при гипотрофии у детей базируется на дробном частом кормлении ребенка, еженедельном расчете пищевой нагрузки, регулярном контроле и коррекции лечения. Кормлением детей с ослабленным сосательным или глотательным рефлексами проводится через зонд.
Медикаментозная терапия при гипотрофии у детей включает назначение ферментов, витаминов, адаптогенов, анаболических гормонов. При гипотрофии тяжелой степени детям производится внутривенное введение белковых гидролизатов, глюкозы, солевых растворов, витаминов. При гипотрофии у детей полезны массаж с элементами ЛФК, УФО.
Прогноз и профилактика гипотрофии у детей
При своевременном лечении гипотрофии I и II степени прогноз для жизни детей благоприятный; при гипотрофии III степени смертность достигает 30-50%. Для предупреждения прогрессирования гипотрофии и возможных осложнений, дети должны еженедельно осматриваться педиатром с проведением антропометрии и коррекции питания.
Профилактика пренатальной гипотрофии плода должна включать соблюдение режима дня и питания будущей мамы, коррекцию патологии беременности, исключение воздействия на плод различных неблагоприятных факторов. После рождения ребенка важное значение приобретает качество питания кормящей матери, своевременное введение прикормов, контроль динамики нарастания массы тела ребенка, организация рационального ухода за новорожденным, устранение сопутствующих заболеваний у детей.
Хронические расстройства питания у детей раннего возраста
Известно, что хронические расстройства питания у детей могут проявляться в виде в различных формах в зависимости от характера нарушений трофики и возраста:
Старшие возраста:
III. Дистрофия типа ожирения (тучность) детей
IV. Маразм алиментарный (истощение у детей дошкольного и школьного возраста).
Гипотрофии
В англо-американской литературе чаще используют термин malnutrition. Наиболее частой причиной хронических расстройств питания является белково-энергетическая недостаточность в сочетании с недостатком витаминов и/или микроэлементов. Распространенность гипотрофии в различных странах в зависимости от экономического развития составляет 7-30 % (в развивающихся странах 20-30%).
В настоящее время доказано, что любое тяжелое соматическое заболевание приводит к повышению секреции соматостатина и вследствие этого происходит снижение массы тела.
Классификация гипотрофий
По времени возникновения
Пренатальные
По этиологии
Алиментарная
Инфекционная
Дефекты режима, диеты
Пренатальные факторы
Наследственная патология и врожденные аномалии развития
Клинические проявления гипотрофии могут быть сгруппированы в ряд синдромов:
Гипотрофия 1 степени:
Гипотрофия 2 степени:
Гипотрофия 3 степени (атрофия, маразм, атрепсия).
Обычно атрофия развивается у детей, которые родились с явлениями пренатальной гипотрофии, недоношенных.
Резко нарушена толерантность к пище, нарушены все виды обмена. У большинства больных отмечается рахит, анемия, дисбактериоз.
Терминальный период характеризуется триадой: гипотермией (32-33), брадикардией 60-49 уд.в мин, гипогликемией. Больной угасает постепенно и умирает незаметно, как «сгорающая свеча» (Дж.Парро).
Некоторые особые варианты разновидности гипотрофий
Квашиоркор
Гипотрофия у детей старшего возраста
Недосток микроэлементов (медь, селен)
Принципы лечения гипотрофии:
2. Принцип двухфазного питания
2.1. Период выяснения пищевой толерантности
2.2. Период переходного и оптимального питания
Гипотрофия 1 степени.
Период выяснения толерантности длится 1-3 дня.
1-й день назначают 1/2-2/3 суточной потребности в пище.
В отдельных случаях назначают панкреатические ферменты, витамины.
Лечение легкой гипотрофии при отсутствии сопутствующих заболеваний проводится в домашних условиях.
Гипотрофия 2 степени.
На 1 этапе проводят осторожное индивидуальное кормление:
На 1 неделе расчет питания по белкам и углеводам производится на фактическую массу + 20%, а жиров на фактическую массу. Количество кормлений увеличивают на 1-2 от возрастной нормы.
На 2 неделе 2/3 суточного количества пищи На 3 неделе соответственно суточной возрастной потребности.
В период выздоровления исходя из массы тела высчитывают суточную потребность в энергии:
1 квартал в сутки необходимо 523-502 кДж/кг (125-120 ккал/кг)
2 квартал 502-481 кДж/кг (120-115 ккал/кг)
3 квартал 481-460 кДж/кг (115-110- ккал/кг)
4 квартал 460-418 (110-100 ккал/кг).
При смешанном и искусственном вскармливании енергетическая ценность увеличивается на 5-10%
Гипотрофия 3 степени
Детей с гипотрофией 3 степени начинают кормить грудным молоком
( нативным или донорским). В крайнем случае адаптированными молочно-кислыми смесями.
1 неделя 1/3 суточной потребности. Число кормлений увеличено на 2-3. 2/3 суточной потребности обеспечивают жидкостью (овощные и фруктовые отвары, електролитные расстворы, парентеральное питание.
2 неделя 1/2 должной суточной потребности в пище.
3 неделя 2/3/ должной суточной потребности в пище.
Белки и углеводы расчитываются на должную массу, а жир только на фактическую.
Основные направления медикаментозной терапии:
3. Коррекция водно-электролитных нарушений и ацидоза. Назначаются инфузии глюкозо-солевых растворов, поляирузующая смесь.
Профилактика гипотрофии
Паратрофии.
ПАРАТРОФИЯ — это хроническое расстройство питания, сопровождающееся нарушением обменных функций организма и характеризующееся избыточной или нормальной массой тела и повышенной гндролабильностыо тканей
Этиология:
Среди этиолологических факторов, приводящих к паратрофии, наиболее важное значение имеют злоупотребление высококалорийными продуктами, высокобелковое питание, перекорм и одностороннее вскармливание употребление пищи повышенной калорийности во второй половине дня, а также эндокринные и нейроэндокринных расстройства
Предрасполагающими к паратрофии факторами являются особенности конституции ребенка, его малоподвижность и отягощенная по ожирению и обменным заболеваниям наследственность.
Перекорм наблюдается, как правило, за счет избыточного введения в питание углеводов: злоупотребление кашей, бесконтрольное введение творога и сливок идр..
Патогенез: углеводы в большем количестве поступают в пищеварительный тракт, что ведет к повышенной активности выработки ферментов. Повышенная выработка ферментов приводит к тому, что часть углеводов резорбируется, а часть углеводов включается в цикл Кребса, в результате чего углеводы перерабатываются в жир. Затем с пищей снова поступает большее количество углеводов, а возможность ферментативной системы ограничена. Это приводит к тому, что часть углеводов не усваивается и поступает в кишечник, где образуются органические кислоты, углекислый газ, вода. В кишечнике идет переработка их микроорганизмами, что приводит к процессам брожения.
Клиника: равномерная избыточная масса тела, бродильная диспепсия, вздутие живота, умеренно выраженный токсикоз за счет всасывания органических кислот, дисбаланс по углеводам и белкам в сторону повышения углеводов. Снижение количества белка приводит к дефициту иммунологического статуса, следовательно, эти дети склонны к развитию интеркурентных инфекций. Дети малоподвижны, повышено отложение подкожного жира, кожные покровы бледные, так как присутствуют симптомы анемии, признаки мышечной гипотонии, симптомы рахита, приглушенность тонов сердца, систолический шум, отставание в моторном развитии. Отметим, что у этих детей закладываются дополнительные жировые клетки, что заставляет включить их в группу риска по развитию эндокринной патологии, манифест которой происходит в предпубертатном и пубертатном периоде.
Формы паратрофии:
1. липоматозная форма.
2. липоматозно-пастозная форма
Связана с особенностями эндокринно-обменных процессов, поскольку эта форма наблюдается у детей с лимфатико-гипопластической аномалией конституции. У 95% этих детей имеются изменения морфо-функционального характера гипоталамо-гипофизарной системы и нарушение функции периферических желез внутренней секреции (склероз сосудов в гипоталамусе, повышение ликворного давления в III желудочке мозга, снижение числа АКТГ-продуцирующих клеток, увеличение числа клеток, продуцирующих соматотропин и тиреотропин). У этих детей отмечено нарушение водно-электролитного обмена. Поэтому возможно, что в основе патогенеза лежит нарушение функции гипоталамо-гипофизарно-надпочечниковой системы.
Липоматозно-пастозная форма паратрофии наиболее часто наблюдается у детей со своеобразным типом внешности (округлое лицо, широкие плечи, широко расставленные глаза), с наличием множественных стигм дизэмбриогенеза. Отмечается пастозность, снижен тургор, выражена бледность кожи и мышечная гипотония. Дети с этой формой паратрофии имеюг неустойчивый эмоциональный тонус, беспокойный сон.
Клинические признаки, которые имеют дифференциально-диагностическое значение, представлены в таблице 2.
Таблица 2.
Основные клинические признаки липоматозной и липоматозно-пастозной формы паратрофии
| Основные клинические симтомы | Липоматозная форма гипотрофии | Липоматозно-пастозная форма гипотрофии |
| Избыток массы тела | Чаще 2-3 степени | Нередко 2-3 степени |
| Окраска кожи и спизистых тых оболочек | Нормальная | Бледные, нередки проявления аллергодер- матозов, типична их стойкость |
| Признаки полигиповитаминозов | Отсутствуют | У большинства детей развивается рахит |
| Гидрофильность тканей | Умеренная (выявляется только специальными проьбами) | Выраженная |
| Симптомы диэнцефальных расстройств | Отсутствуют | На 2-м году жизни нередки вегето-сосудистые дисфункции, жажда, субфебрилитет, склонность к желудочно-кишечным заболе ваниям, сопровождаю щимся быстрой потерей жидкости |
| Течение сопутствующих заболеваний | Без особенностей | Частое рецидивирование, затяжное, ОРВИ с обструктивным синдромом |
| Анализ крови | Без отклонений | Нередко анемия |
| Биохимическое иссле дование крови | Умеренная гиперлипидемия, гиперхолестеринемия | Высокие показатели общих липидов, холестерина |
Общие подходы к лечению паратрофии:
Диетотерапия паратрофии:
При паратрофии комплекс лечебно-организационных мероприятий должен быть направлен на уточнение и устранение возможной причины заболевания, организацию рационального диетического режима, не вызывающего замедления роста ребенка, организацию двигательного режима в своевременное выявление и лечение сопутствую шей патологии.
Диетотерапия является основным методом лечения паратрофии, она должна строиться на следующих основных принципах:
Проведение этапного диетического лечения включает:
I этап (разгрузки) предусматривает отмену высококалорийных продуктов и всех видов прикорма. Общий объем пищи соответствует возрастным нормам. Лучшим продуктом является женское молоко, при его отсутствии — кисломолочные смеси. Длительность этапа- 7-10 дней.
11 этап (переходный) длится 3-4 недели- Ребенку первых 4 месяцев жизни вводят корригирующие добавки, а старше 4 месяцев — также вводят соответствующие возрасту прикормы; начиная с овощного пюре.
III этап (минимально-оптимальной диеты) — ребенок получает все корригирующие добавки и виды прикорма, соответствующие возрасту. Расчет необходимого количества белка прово-
дится на фактическую массу, жиров и углеводов, калорий — на долженствующую (соответствует минимально-оптимальным потребностям ребенка).
Лечение также включает организацию двигательного режима ежедневный массаж и гимнастику, показано плавание, регулярное (не менее 3-4 часов в сутки) пребывание на свежем воздухе аэро- и гидропроцедуры. По показаниям проводится витамннотерапия.
Гипостатура
ГИПОСТАТУРА — это хроническое расстройство питания, характеризующееся более или менее равномерным отставанием в росте и массе тела при удовлетворительном состоянии упитанности и тургора тканей.
Гипостатура характерна для детей с врожденными пороками сердца, с пороками развития ЦНС, с энцефалопатиями и эндокринной патологией.
Гипостатура — одна из форм хронического расстройства питания, и это подтверждается тем, что после лечения основного заболевания (оперативное лечение врожденного порока сердца, лечение энцефалопатии, эндокринной патологии и др.) физическое развитие ребенка нормализуется.
Дифференцировать гипостатуру следует с хондродистрофией, врожденной ломкостью костей, витамин-D-резистентным рахитом, с тяжелыми формами витамин-D-зависимого рахита, карликовым нанизмом.
Университет
Длительно некомпенсированные нарушения углеводного обмена у беременной — наиболее частая причина рождения ребенка с макросомией. Длительная гипергликемия у беременной при недиагностированном (гестационном), суб- или декомпенсированном сахарном диабете приводит к гиперплазии β-клеток поджелудочной железы плода, вызывая повышение секреции фетального инсулина. Хроническая гиперинсулинемия стимулирует увеличение экспрессии ИФР-1, что проявляется повышениями концентрации ИФР-1 при рождении ребенка. С другой стороны, инсулин, обладая анаболическим действием, оказывает ростстимулирующий эффект на плод.
При наличии тяжелой плацентарной дисфункции, сосудистых нарушений у новорожденного от матери с сахарным диабетом может наблюдаться внутриутробная задержка роста, врожденные пороки развития (сердца, мочевыводящей системы, глаз, каудальная дисгенезия, микроцефалия). Частая проблема — транзиторная ранняя постнатальная гипогликемия. У матерей с некомпенсированным сахарным диабетом повышен риск рождения недоношенных, детей с болезнью гиалиновых мембран, гипокальциемией, пролонгированной гипербилирубинемией, тромбозом (почечных вен), транзиторной кардиомиопатией.
Это группа врожденных заболеваний, в основе которых лежит дефект развития или функционирования β-клеток поджелудочной железы, вызывающий неконтролируемую секрецию инсулина. Последняя приводит к повышенной утилизации глюкозы и развитию тяжелых гипогликемий. Частота встречаемости ПГГ составляет 1 случай на 50 000 новорожденных в европейской популяции.
Выделяют две формы ПГГ новорожденных: фокальную (изолированную) и диффузную гиперплазию -клеток поджелудочной железы. Большинство семейных и спорадических случаев заболевания имеет аутосомно-рецессивный тип наследования. При некоторых семейных формах ПГГ обнаруживаются мутации в KCNJ11 и ABCC8 генах (SUR1 и Kir6.2 субъединицах панкреатического КАТФ-канала).
Классическое клиническое проявление ПГГ — макросомия для данного гестационного возраста и стойкая симптоматическая гипогликемия в первые дни жизни.
Для коррекции требуется высокая скорость подачи глюкозы — более 10 мг/кг/минуту. К лабораторным критериям гиперинсулинемической гипогликемии относят низкий уровень кетоновых тел и свободных жирных кислот, высокие показатели инсулина и С-пептида.
Синдром Беквита — Видемана (СБВ)
Описана группа синдромов, которые сопровождаются макросомией новорожденного с увеличением внутренних органов. В их основе лежит избыточная секреция инсулиноподобного фактора роста — 2 (ИФР-2). Наиболее распространенным заболеванием является синдром Беквита — Видемана (синоним: синдром висцеромегалии, омфацеле и макроглоссии). Частота встречаемости СБВ составляет 1 случай на 13 700 новорожденных.
Причина СБВ — изменение количества рострегуляторных генов, расположенных на конце короткого плеча 11-й хромосомы (11р15.5). Молекулярные нарушения при данном заболевании имеют сложный характер и объясняют вариабельность фенотипа. 10% больных СБВ имеют хромосомные нарушения. В других 90% случаев определяются молекулярные дефекты известных генов, участвующих в патогенезе синдрома, и генов-кандидатов, выявляемых в спорадических случаях.
Минимальные диагностические признаки СБВ включают макроглоссию, грыжу пупочного канатика, макросомию, насечки на мочках ушных раковин, гипогликемию.
Частые аномалии — макроглоссия и омфацеле (реже расхождение прямых мышц живота). Макросомия отмечается с рождения (длина новорожденного более 52 см и масса свыше 4 кг) или развивается постнатально. Могут наблюдаться микроцефалия или гидроцефалия; выступающий затылок; аномалии прикуса, связанные с гипоплазией верхней челюсти и относительной гиперплазией нижней; экзофтальм; относительная гипоплазия орбит. Нередко имеют место гемигипертрофия и пигментные невусы.
Отмечаются висцеромегалия (гепатомегалия, спленомегалия, нефромегалия, панкреатомегалия, реже — кардиомегалия), гиперплазия матки, мочевого пузыря, клитора, тимуса.
У 30–50% больных наблюдают гиперинсулинемическую гипогликемию вследствие гиперплазии -клеток поджелудочной железы. В большинстве случаев она носит транзиторный характер и купируется введением глюкозы и диазоксида. У части больных для нормализации показателей гликемии требуется частичная панкреатоэктомия. Умеренная умственная отсталость обычно связана с гипогликемиями.
У пациентов с СБВ повышен риск развития эмбриональных опухолей (опухоль Вильмса, гепатобластома, адренокортикальная карцинома, гонадобластома).
Синдром Симпсона — Голаби — Бемеля (СГБ)
Заболевание относится к Х-связанным синдромам с пренатальной и постнатальной высокорослостью. Минимальные диагностические признаки — макросомия (масса при рождении 4 000–5 000 г), аномалии лицевой части черепа, полидактилия, гипоплазия ногтей.
Другие фенотипические проявления сходны с СБВ. Отмечаются макроглоссия, висцеромегалия, гиперинсулинемическая гипогликемия, склонность к эмбриональным опухолям. Рост мужчин достигает 192–210 см.
В основе синдрома СГБ лежат функциональные нарушения гена, играющего роль в контроле роста эмбриональной мезодермальной ткани, glypican 3 (GPC3). Обсуждается потенциальная взаимосвязь рецептора этого гена и ИФР-2, что может объяснить сходные клинические признаки синдромов СГБ и СБВ.
Синдром Перлмана
Это редкое генетическое заболевание характеризуется пренатальной макросомией, почечной гамартомой, предрасположенностью к фетальным опухолям (опухоль Вильмса), гипогликемией на фоне гиперплазии островковых клеток поджелудочной железы, лицевыми дисморфиями. Большинство пациентов погибает в неонатальном периоде. Причина заболевания в настоящее время неизвестна.
Фетальная макросомия с нормальным уровнем инсулина
Синдром Сотоса
Популяционная частота синдрома Сотоса (синдром церебрального гигантизма) неизвестна. Большинство случаев носят спорадический характер. Семейные формы синдрома имеют аутосомно-доминантный тип наследования. Минимальные диагностические признаки включают акромегалию, усиленный рост, умственную отсталость, нарушение координации. При рождении характерно увеличение показателей массы тела и роста более 90-й перцентили. Отмечается ускорение роста в первые годы жизни, рост больных превышает 97-ю перцентиль. Акселерация роста продолжается до 4–5 лет. Половое развитие наступает в нормальные сроки, может отмечаться ранний пубертат.
Результаты уровней (базальные и в ходе ОГТТ) СТГ, ИФР-1, ИФРСБ-3 имеют нормальные значения. Отсутствуют специфические лабораторные и инструментальные признаки синдрома.
Наблюдаются макроцефалия с выступающими лобными буграми, прогнатия, гипертелоризм, антимонголоидный разрез глаз, выступающая нижняя челюсть, макроглоссия, высокое нёбо, косоглазие. Описаны сколиоз, увеличенные стопы и кисти, синдактилия пальцев стоп. Повышен риск неоплазий, в частности печеночной карциномы, опухоли Вильмса, яичников, паращитовидных желез. Степень умственной отсталости умеренная. Отмечаются судороги, нарушение координации.
Синдром Маршалла — Смита
Это заболевание относится к редким генетическим синдромам и характеризуется пренатальной высокорослостью, прогрессированием костного возраста, задержкой умственного развития, лицевыми стигмами, большими размерами кистей и стоп, утолщением проксимальных и средних фаланг пальцев рук. Основная причина смерти пациентов в раннем детском возрасте — легочная недостаточность. Молекулярная причина развития синдрома в настоящее время неизвестна.
Фетальная макросомия с нормальным уровнем инсулина
Синдром Вивера — Смита
Популяционная частота неизвестна. Большинство описанных случаев носят спорадический характер, возможен аутосомно-рецессивный, Х-сцепленный и (или) аутосомно-доминантный типы наследования. К минимальным диагностическим признакам относятся лицевые стигмы (эпикант, большие уши, длинный фильтр, микрогения, высокий лоб), рентгенологические (расширение метафизов костей, нарушение (диссоциация) костного созревания), камптодактилия, легкая умственная отсталость.
Отмечается пре- и постнатальная высокорослость. Средние показатели массы тела и роста при рождении у мальчиков составляют 4,8 кг и 56 см, у девочек — 3,9 кг и 53 см. С первых месяцев жизни — высокая скорость роста и прогрессирование костной зрелости. Окончательный средний рост мужчин достигает 194,2 см, женщин — 176,3 см.
Наблюдаются лицевые дисморфии, камптодактилия, контрактура коленных суставов, клинодактилия. Неврологическая симптоматика встречается в 80% случаев и включает легкую умственную отсталость, гипертонус мышц.
Синдром Нево
Характерен высокий рост при рождении, контрактуры стоп, врожденный отек, гипотония, прогрессия костного возраста, долихоцефалия, длинные конечности, задержка умственного развития.
Синдром Элеялде
Редкое генетическое заболевание с фетальной макросомией, полидактилией, избыточным развитием соединительной ткани и разрастанием волокон периваскулярных нервов во многих тканях, утолщением кожи, краниоостозом и поликистозом почек. Часто поражения органов и тканей при рождении ребенка не совместимы с жизнью.
Причина синдрома в настоящее время неизвестна.
Постнатальное опережение физического развития, ведущее к высокорослости в детском возрасте
Семейная (конституциональная) высокорослость
Свойственна большая скорость роста с рождения, родители высокие. Прогнозируемый рост ребенка по костному возрасту (рентгенограмма кисти и запястья) с расчетом по индексным таблицам совпадает с генетическим (целевым) ростом. Отсутствуют типичные клинико-лабораторные и инструментальные нарушения, характерные для патологической гиперсекреции соматотропного гормона (СТГ) — нормальные уровни инсулиноподобного фактора роста — 1 (ИФР-1) и инсулиноподобного фактора роста, связывающего белок — 3 (ИФРСБ-3), супрессия показателей СТГ при проведении орального глюкозотолерантного теста (ОГТТ), нормальный кариотип.
Синдром Вивера — Смита (см. выше).
Синдромы Беквита — Видемана и Сотоса
Синдром Марфана
Популяционная частота — 0,04 на 1 000 человек. Тип наследования аутосомно-доминантный с высокой пенетрантностью и различной экспрессивностью. Минимальные диагностические признаки: высокий рост, арахнодактилия, гиперподвижность суставов, подвывих хрусталика, аневризма аорты.
Типичны высокий рост, длинные тонкие конечности, особенно дистальные отделы. Отмечаются сколиоз, кифоз, воронкообразная или килевидная грудная клетка, долихоцефалия, готическое нёбо, плоскостопие. Поражения глаз включают двусторонний подвывих хрусталика, сферофакию, микрофакию. Наблюдаются миопия высокой степени, отслойка сетчатки, гетерохромия радужки, мегалокорнеа, голубые склеры.
Свойственны нарушения со стороны сердечно-сосудистой системы: расширение восходящей части (реже грудного или брюшного отдела) аорты с развитием расслаивающейся аневризмы и недостаточность сердечных клапанов. Встречаются грыжи (бедренные, диафрагмальные, паховые), гипоплазия мышц и подкожной клетчатки, нефроптоз.
Синдром хромосомы фрагильной Х (синдром Мартина — Белла)
Популяционная частота 0,5 на 1 000 мальчиков. Тип наследования Х-сцепленный рецессивный. Минимальные диагностические признаки: умеренная или глубокая умственная отсталость; большие оттопыренные ушные раковины; выступающий лоб и массивный подбородок; макроорхидизм; ломкость Xq 28 участка.
Масса тела и длина при рождении нормальные или незначительно превышают популяционную норму, увеличена окружность головы. У старших детей лицо имеет прямоугольную форму с высоким лбом, тонким длинным носом, гиперплазией нижней челюсти, часто встречаются расщелины нёба. Кисти широкие. С началом полового созревания отмечается макроорхидизм. Могут наблюдаться аутизм, гиперреактивность, мышечная гипотония, судороги.
У некоторых пациентов отмечаются ожирение, гинекомастия, гипоспадия, пролапс митрального клапана.
Синдром Клайнфелтера
Популяционная частота синдрома Клайнфелтера (ХХY синдром) — 1 на 500–1 000 мальчиков. Чаще отмечается кариотип 47ХХY. Возможны следующие варианты: 46ХY/ХХY мозаицизм; 48ХХYY; 48ХХХY; 49ХХХYY; 49ХХХХY. Клинические проявления заболевания наблюдаются у фенотипических мальчиков с кариотипом 46 ХХ в результате транслокации Y (SRY) на Х хромосому. Кариотип 46ХХ встречается у одного из 20 000 мальчиков. Большинство описанных случаев носят спорадический характер. Минимальные диагностические признаки — гипогенитализм, первичный гипогонадизм, аномалия кариотипа.
Обычно пациенты высокие, пропорции тела евнухоидные, нижние конечности непропорционально длинные. Отличительный признак — гипоплазия яичек и полового члена. Часто наблюдаются гинекомастия, ожирение, оволосение на лобке по женскому типу. При гистологическом исследовании яичек отмечается гиалиноз и фиброз семенных канальцев, уменьшение количества клеток Лейдига. Характерны снижение полового влечения, импотенция, бесплодие.
IQ — 85–90, выраженная умственная отсталость наблюдается редко (в основном у пациентов, имеющих в кариотипе три и более Х-хромосомы). Возможны трудности в обучении, задержка речевого развития.
Повышен риск снижения минеральной плотности костной ткани и развития остеопороза, сахарного диабета 2-го типа, варикозного поражения, тромбозов, легочной эмболии. Пациенты с кариотипом 46ХХ имеют нормальные пропорции скелета, низкорослость, снижение интеллекта выражено незначительно.
Ожирение
Экзогенно-конституциональное (алиментарное) ожирение часто сопровождается ускорением линейного роста. Костный возраст обычно незначительно опережает хронологический. Раннее половое созревание ускоряет закрытие эпифизарных зон роста, но окончательный рост пациентов с алиментарным ожирением входит в генетический ростовой коридор.
Проявления ожирения у детей:
б) нейроэндокринные (низкая концентрация кортикотропин-рилизинг-гормона, серотонина и его метаболитов в цереброспинальной жидкости);
Гиперпродукция гормона роста
Гигантизм — нейроэндокринное заболевание, вызванное хронической избыточной секрецией СТГ у пациентов с незаконченным физиологическим ростом. Характеризуется пропорциональным ростом костей скелета в длину, приводящим к значительному увеличению линейного роста ребенка. При отсутствии своевременной диагностики и адекватного лечения у детей с гигантизмом после завершения пубертатного периода развиваются все типичные симптомы акромегалии.
Выделяют микро- (мене 10 мм) и макроаденому (более 10 мм).
В большинстве случаев гигантизм обусловлен избыточной первичной секрецией СТГ аденомой гипофиза, которая возникает вследствие генных мутаций в α-субъединице G-белка (появление Gsp-онкогена). Под влиянием Gsp-онкогена происходит пролиферация опухолевых клеток и повышение секреции СТГ, которая не регулируется обычными секреторными механизмами. Избыток СТГ вызывает повышение секреции ИФР-1 в печени и его локальную продукцию в различных тканях, включая кости и хрящи. Под воздействием ростовых факторов увеличивается продукция коллагена, пролиферация хрящей, что приводит к росту и утолщению мягких, костной и хрящевой тканей с поражением кожи, мягких тканей (огрубение черт лица, утолщение пальцев, себорея, угри, гирсутизм, потливость) и костной системы (диастема, прогнатизм, фронтальный гиперостоз, заболевания височно-нижнечелюстного аппарата, остеоартрит, дорзальный кифоз). В процесс вовлекаются практически все органы и системы организма.
Дополнительные методы исследования при гиперпродукции СТГ: УЗИ щитовидной железы, сердца, органов малого таза; рентгенография органов грудной клетки; электрокардиограмма; МРТ(КТ) грудной и брюшной полости; определение СТГ в крови, оттекающей из нижних кавернозных синусов (при подозрении на эктопированную продукцию СТГ); определение уровня СТГ-рилизинг гормона в сыворотке крови (при подозрении на эктопическую продукцию соматолиберина).
Диагноз «гигантизм» подтверждается при повышении базального уровня СТГ>0,4 нг/мл, отсутствии подавления СТГ на фоне ОГТТ, увеличении показателя ИФР-1.
ГР-продуцирующая аденома как составляющая синдромов МакКьюна —Олбрайта или МЭН-1
Для синдрома МакКьюна — Олбрайта характерна специфическая триада: полиостатическая фиброзная дисплазия, преждевременное половое развитие, специфические пигментные пятна бледно-кофейного цвета.
Преждевременное половое развитие (ППР) начинается позже и протекает медленнее, чем при других формах преждевременного созревания. Часто первым признаком у девочек являются маточные кровотечения задолго до появления телархе и адренархе. Кровотечения вызваны повышенным уровнем эстрогенов. ППР у мальчиков наблюдается значительно реже и характеризуется гиперплазией клеток Лейдига. Уровни гонадотропных гормонов обычно низкие или супрессированы. У некоторых пациентов показатели лютеинизирующего гормона (ЛГ) и фолликулостимулирующего гормона (ФСГ) могут повышаться, вызывая развитие истинного ППР.
В основе эндокринных нарушений лежит спорадическая мутация гена GNAS1 (стимулятор α-субъединицы G-белка), который связывает рецепторы ЛГ и ФСГ с аденилатциклазой в гонадах. Мутантный белок постоянно активирует аденилатциклазу в отсутствие гонадотропных гормонов, что ведет к усилению секреции эстрогенов. Предполагают, что мутация гена происходит на ранних этапах эмбриогенеза.
Клинические проявления гигантизма у пациентов с синдромом МакКьюна — Олбрайта вызваны СТГ-продуцирующей аденомой гипофиза. Гиперпролактинемия — часто сопутствующий признак у детей с гиперпродукцией СТГ. Тиреотоксикоз и автономно функционирующие аденомы щитовидной железы наблюдаются у 33% пациентов с синдромом МакКьюна — Олбрайта. Возможно развитие синдрома Кушинга вследствие узловой гиперплазии или одиночной аденомы надпочечников. Неэндокринные поражения включают аритмии, тяжелый неонатальный холестаз.
Клиническая картина гигантизма с развитием аденомы может быть проявлением синдрома МЭН-1 (синдром Вермера). Для него обязательно наличие гормонально-активных опухолей паращитовидных желез, островков поджелудочной железы, аденомы гипофиза.
Частота — 1 случай на 30 000 человек; пик манифестации — на четвертой–пятой декадах жизни. Число известных наблюдений этого синдрома в детском возрасте невелико, выявление МЭН-1 до десятилетнего возраста ребенка отмечается в единичных случаях. МЭН-1 является заболеванием с аутосомно-доминантным типом наследования или встречается спорадически. В его основе часто лежат мутации гена супрессии опухолей МЭН-1 (менина), расположенного на хромосоме 11q13.
Клиническая диагностика основана на определении у пациента двух из трех характерных признаков (аденом паращитовидных желез, эндокринных неоплазий поджелудочной железы и опухолей аденогипофиза). Для семейной формы достаточно выявить у пациента один типичный симптом МЭН-1, если есть родственники первой степени родства с одной из трех упомянутых выше опухолей.
Описано более 20 различных эндокринных и неэндокринных неоплазий, лежащих в основе МЭН-1. Классической триаде заболевания могут сопутствовать опухоли надпочечников, бронхов, гастроинтестинального тракта, тимуса, липомы, ангиофибромы, шванномы, опухоли яичек, нейрофибромы.
Опухоли аденогипофиза — первый признак клинической манифестации МЭН-1 в 25% спорадических и менее 10% семейных случаев. Они встречаются у 15–90% пациентов с данным заболеванием и различаются показателями секреции гипофизарных гормонов (пролактина, гормона роста, адренокортикотропного гормона и др.) с развитием характерных клинических симптомов и (или) размерами образования с эффектом компрессии окружающих тканей.
Одна из наиболее часто встречаемых гормонально-активных неоплазий передней доли гипофиза — СТГ-продуцирующая аденома. К ее типичным клиническим признакам относят гигантизм, увеличение размеров конечностей, изменение внешности (укрупнение носа, языка, утолщение кожи, надбровных дуг, диастема, прогнатизм), синдром карпального канала, сужение полей зрения, проксимальная миопатия, артериальная гипертензия, нарушение углеводного обмена, галакторея.
Согласно принятому в 2001 году Консенсусу по диагностике и лечению пациентов с МЭН-1, скрининговое мониторирование аденом гипофиза включает определение сывороточных концентраций пролактина и ИФР-1, выполнение МРТ области гипофиза.
Преждевременное половое развитие
Высокорослость может быть одним из клинических признаков ППР. Среди других — появление некоторых или всех вторичных половых признаков у девочек младше 8 лет или у мальчиков до 10 лет.
При истинном ППР формирование вторичных половых признаков изосексуальное (соответствующее генетическому и гонадному полу ребенка), обусловленное активацией гипоталамуса и гиперсекрецией гонадотропных гормонов, является завершенным.
Ложное ППР вызвано автономной избыточной секрецией эстрогенов в надпочечниках или яичниках у девочек либо приемом эстрогенов или гонадотропных гормонов, у мальчиков — автономной гиперсекрецией андрогенов или хорионического гонадотропина. Всегда незавершенное. Может быть изосексуальным и гетеросексуальным.
Последовательность развития вторичных половых признаков обычно такая, как и при нормальном половом созревании, пубертатный скачок роста составляет 8–12 см в год. Под влиянием половых гормонов значительно ускоряется закрытие эпифизарных зон роста, вследствие чего окончательный рост пациентов значительно ниже генетического.
Постнатальное опережение физического развития, ведущее к высокорослости в детском возрасте
Гомоцистинурия (дефицит синтеза цистатионина)
Минимальные диагностические признаки: марфаноподобный фенотип, повышение концентрации метионина и гомоцистина в моче и крови. Популяционная частота неизвестна. Тип наследования аутосомно-рецессивный.
Внешне пациенты выглядят как страдающие синдромом Марфана. Скелетные аномалии включают долихостеномелию, воронкообразную или килевидную деформацию грудной клетки, сколиоз, деформацию коленных суставов, изменение формы и расположения зубов, остеопороз, склонность к переломам, ограничение подвижности суставов. Часто у детей с гомоцистинурией имеется подвывих хрусталика, миопия, атрофия зрительного нерва, отслойка сетчатки, глаукома. Отмечается умственная отсталость различной степени выраженности.
Нередко наблюдается тромбоз коронарных, сонных, почечных артерий, генерализованный венозный тромбоз, которые являются причиной ранней смерти.
В плазме выявляется повышение концентрации метионина, гомоцистеина и гомоцистина, уменьшение количества цистина. Повышена экскреция с мочой гомоцистина.
47 ХYY синдром (YY-синдром)
Частота встречаемости 47 XYY-синдрома составляет 1 случай на 800 мальчиков. Практически всегда мутация возникает de novo. Редко встречается мозаицизм с 45 Х или 46 XY. Добавочная Y-хромосома появляется в результате нерасхождения хромосом во втором делении отцовского мейоза с образованием сперматозоида YY. Возраст отца не является фактором риска. Связь кариотипа 47 XYY с крупными пороками развития не доказана.
Взрослые мужчины имеют нормальный мужской фенотип, для них характерно превышение генетического роста более чем на 10 см. Пубертатное ускорение роста наступает раньше и продолжается дольше, при этом показатели окончательного роста пациента достигают 1,95–2,15 см.
Наблюдаются непропорционально длинные конечности, кисти и стопы, макроцефалия, антимонголоидный разрез глаз, глубоко расположенные глаза, готическое нёбо, деформация ушных раковин. Характерно варикозное расширение вен, угри.
Умственное развитие в пределах нормы, IQ на 10–15 пунктов ниже средних цифр, отмечаются задержка речевого развития и трудности обучения чтению и письму. Дефицит внимания, гиперактивность и импульсивность поведения подтверждены для мальчиков с данным синдромом, но значимая агрессивность и психопатологическое поведение нехарактерны. Фертильность обычно нормальная, либидо повышено, значительного риска иметь хромосомно аномального ребенка нет.
Гормонального лечения не требуется. Половине мальчиков необходима педагогическая коррекция задержки речевого развития. Супружеским парам, в которых мужчина несет кариотип 47 XYY, рекомендуют провести пренатальную диагностику, несмотря на то, что дети в таких семьях обычно имеют нормальный кариотип.
Тиреотоксикоз
Обусловлен избыточным синтезом и секрецией гормонов щитовидной железы, характеризуется усилением обмена веществ во всех тканях — мишенях этих гормонов.
Причины тиреотоксикоза: диффузный токсический зоб (болезнь Грейвса — Базедова); токсическая аденома щитовидной железы; передозировка тиреоидных гормонов; избыток тиреотропного гормона; тиреотоксическая стадия подострого тиреоидита; хашитоксикоз при хроническом лимфоцитарном тиреоидите; йод-индуцированный тиреотоксикоз. В 98% случаев тиреотоксикоз у детей обусловлен развитием болезни Грейвса — Базедова. Более 75% детей заболевают в период полового созревания, девочки — в 4–6 раз чаще. Генетическая предрасположенность определяется ассоциацией с антигенами HLA B 8 и Bw 35.
Основные клинические проявления: офтальмопатия Грейвса — 50%; увеличение щитовидной железы — 99%; нарушения со стороны сердечно-сосудистой системы (тахикардия — 85%, аритмии, увеличение пульсового давления (митральная регургитация) — 40%). Отмечаются возбудимость, раздражительность, эмоциональная лабильность, нарушение концентрации внимания, мелкий тремор, гиперрефлексия. У девочек может наблюдаться задержка менархе, у мальчиков — гинекомастия.
При тиреотоксикозе характерно кратковременное ускорение роста, при этом костный возраст опережает паспортный более чем на 1 год. Окончательный рост пациентов с тиреотоксикозом не выходит за пределы генетического ростового коридора.
Диагноз тиреотоксикоза подтверждается определением в сыворотке низких или подавленных значений тиреотропного гормона, повышенных уровней общего/Т4 св и общего/свободного трийодтиронина (Т3-токсикоз характерен для ранних стадий заболевания и предшествует повышению тироксина), повышенными титрами антител к ТПО и рецепторам ТТГ.
Постнатальное опережение физического развития, ведущее к высокорослости у взрослых
Семейная (конституциональная) высокорослость (см. выше)
Дефицит андрогенов или эстрогенов/резистентность к эстрогенам (у мальчиков)
Основным симптомом дефицита половых гормонов у мальчиков является допубертатный объем яичек (до 4 мл) к 14 годам, у девочек отсутствие развития молочных желез к 13 годам и(или) менструальной функции к 15 годам. У подростков отсутствуют вторичные половые признаки: у мальчиков — мутация голоса, оволосение на лице, мышечная гипертрофия плечевого пояса, активность потовых и сальных желез; у девочек — перераспределение жира по женскому типу.
При длительной задержке полового созревания отмечается рост конечностей, уменьшение соотношения верхнего и нижнего сегментов тела, формирование евнухоидных пропорций. Дифференцировка костного скелета до пубертатного возраста соответствует фактическому возрасту ребенка, и только с 13–14 лет наблюдается отставание костного возраста. Конечный рост нелеченных детей может превышать генетически детерминированный, т. к. зоны роста долго остаются открытыми, способность к линейному росту сохраняется до 20 лет и более.
Тестикулярная феминизация
Синдром тестикулярной феминизации (резистентности к андрогенам) относится к группе ложного мужского гермафродитизма. Распространенность синдрома составляет 1 случай на 20 000–64 000 новорожденных мальчиков.
Минимальные диагностические признаки: аменорея, бесплодие, кариотип 46 ХY, недоразвитость вторичных половых признаков. Выделяют два основных варианта синдрома: полная форма, при которой наружные половые органы имеют нормальное строение по женскому типу, и частичная, когда строение наружных гениталий отражает различную степень маскулинизации.
В основе андрогеновой нечувствительности лежит отсутствие активации гена рецептора андрогена и нарушение связывания с ним тестостерона и его активного метаболита — дегидротестостерона. Из-за нарушения рецепторного связывания с тестостероном и его активной формой нет адекватного ответа на адрогеновый стимул, что проявляется формированием наружных гениталий по женскому типу. Нормальная продукция антимюллерового фактора яичками приводит к регрессии производных мюллеровых протоков (матки, фаллопиевых труб, верхней части влагалища), нижняя часть влагалища укорочена и слепо заканчивается, большие половые губы недоразвиты.
Производные вольфовых протоков (семявыносящий проток, семенные пузырьки и придаток семенника) в различной степени гипоплазированы и могут находиться в брюшной полости или паховых каналах, реже — в больших половых губах. Яички нормально развиваются в препубертатном возрасте, однако гистологически отмечается гиперплазия клеток Лейдига. В пубертате наблюдается диффузное или узловое перерождение гиперплазированных клеток Сертоли с развитием тубулярных аденом.
Процесс сперматогенеза заканчивается на ранней фазе, до созревания сперматозоидов.
При полной нечувствительности к андрогенам больные с рождения воспитываются в женском паспортном поле.
Психосексуальное поведение соответствует женскому типу. В пубертатном возрасте формируется нормальный женский фенотип. Хорошо развиты молочные железы с дифференцированной железистой тканью, половое оволосение слабо выражено или отсутствует. Отмечается превышение конечного роста данной группы пациентов относительно их фенотипически-генетических показателей, что, вероятно, обусловлено влиянием генов, экспрессирующихся на Y-хромосоме.
При лабораторном обследовании пациентов с полной формой заболевания уровни лютеинизирующего гормона (ЛГ) повышены, фолликулостимулирующего гормона (ФСГ) — нормальные. Высокие значения тестостерона являются результатом усиленной по механизму обратной связи секреции ЛГ. Конверсия тестостерона в дегидротестостерон снижена. Концентрации эстрадиола превышают уровни, характерные для нормальных мужчин, но низкие по сравнению с нормативами для женщин в фолликулиновую фазу цикла. Повышенные показатели эстрадиола являются следствием периферической ароматизации большого количества тестостерона и достаточны для реализации феминизации пациентов.
В периоде пубертата больные обращаются к врачу по поводу отсутствия менструаций.
Гиперпродукция гормона роста, cиндром Марфана, cиндром Клайнфельтера (см. выше)