Нутритивный статус что это
Оценка нутритивного статуса пациента
Для оценки нутритивного статуса пациента в повседневной клинической практике принято использование целого комплекса соматометрических и клинико-лабораторных параметров. Эти параметры условно подразделяются на обязательные (первого уровня) и дополнительные (второго уровня). Обязательные параметры включают в себя данные антропометрических, клинических и лабораторных исследований. Данные параметры могут и должны быть использованы врачом любой специальности для определения текущего нутритивного статуса. Дополнительные параметры необходимы для более детального анализа трофологического состояния пациента и обычно используются специалистами по искусственному питанию. Данные параметры позволяют определить отдельные конституциональные показатели, такие как, например, жировая масса тела, мышечная масса тела и их соотношение.
К антропометрическим (соматометрическим) параметрам, чье измерение формально является обязательным при физикальном обследовании больного, относятся: росто-весовые показатели и их производные (масса тела, рост, идеальная масса тела и величина ее отклонения, индекс массы тела), окружность плеча и толщина кожно-жировой складки.
Идеальная масса тела рассчитывается по следующим формулам:
ИдМТ для мужчин = Рост – 100 – (Рост – 152) х 0, 2.
ИдМТ для женщин = Рост – 100 – (Рост – 152) х 0, 4.
ИдМТ измеряется в килограммах, рост — в сантиметрах.
Отклонение фактической массы тела (ФМТ) от идеальной массы рассчитывают по формуле:
Снижение массы от идеальной (%) = 100 х (1 – ФМТ/ИдМТ).
Кроме того, для определения нормальной массы тела теоретически может быть применён целый ряд индексов: индекс Брока, индекс Брейтмана, индекс Бернгарда, индекс Давенпорта, индекс Одера, индекс Ноордена, индекс Татоня. Однако наиболее часто в клинической практике для ориентировочной оценки нутритивного статуса используется индекс массы тела. Данный показатель был разработан Adolphe Quetelet в 1869 г. и рассчитывается по формуле:
ИМТ = m/h2, где m – вес в кг, h – рост в метрах
В соответствии с рекомендациями ВОЗ показатели Индекса Массы Тела (ИМТ, индекс Кетле) с учетом возраста интерпретируются следующим образом:
Трофологический статус и панкреатические ферменты
Описаны методы оценки трофологического (нутритивного) статуса пациента, роль протеолитических ферментов поджелудочной железы для коррекции нутритивного статуса, показано, что препараты панкреатических ферменты должны использоваться в комплексных схемах те
Methods of evaluation of trophologic (alimentary) status of patient, the role of proteolytic enzymes of pancreas for correction of nutritive status are described. As it is shown pancreas enzymes preparations should be applied in complex therapy schemata for different pathologies.
Анализ трофологического (нутритивного) статуса пациента, являющийся необходимым компонентом оценки как здоровья, так и тяжести болезни, складывается из анализа широкого спектра данных, включая клинические и соматометрические. К первым относятся психомоторное развитие, психоэмоциональный статус (настроение), аппетит, состояние кожных покровов и подкожного жирового слоя, слизистых оболочек, мышечного тонуса и мн. др., включая особенности полового развития.
Соматометрические показатели включают массу тела, рост, окружность головы и плеча, толщину кожно-жировой складки над трицепсом, величину окружности мышц плеча и некоторые другие. Их нормальные значения лежат в пределах среднего квадратичного отклонения (M ± 1σ) или 25–75 перцентилей при использовании центильных таблиц.
Расчетные соматометрические индексы также широко используются в клинической практике. Наиболее известным из них является показатель отклонения массы тела (ПОМТ), выраженный в % и равный
ПОМТ = ФМТ (кг)/РМТ (кг) × 100%,
где ФМТ — фактическая масса тела, а РМТ — расчетная масса тела. Нормальными значениями ПОМТ принимаются 90–110%.
Индекс массы тела (ИМТ) (индекс Quetelet) рассчитывается как отношение ФМТ в кг к значению роста (в метрах), взятом в квадрате. Нормальные значения ИМТ представлены ниже:
Для оценки трофологического статуса используются также и специальные методы исследования, которые подразделяются на статические показатели и функциональные тесты. К последним относятся, в частности, определение аномальных метаболитов, активности ферментов, in vitro тесты, провокационные патофизиологические реакции.
Для оценки текущего питания могут быть использованы исследования кала (определение содержания минеральных веществ, липидов), мочи (витамины группы В, кроме В12 и фолацина, витамин С, макро- и микроэлементы, включая Na, K, Ca, Mg, Se, аминокислоты и мн. др.), желчи (холестерин), крови (липиды, витамины, макро- и микроэлементы).
Оценка среднесрочного и долгосрочного питания может быть проведена при исследовании эритроцитов (витамины В1, В2, В6, ниацин, фолацин, Se, Cu), лейкоцитов (витамин С, Zn), волос и ногтей (микроэлементы Zn, Cu и др.), жировой ткани (жирные кислоты) [1].
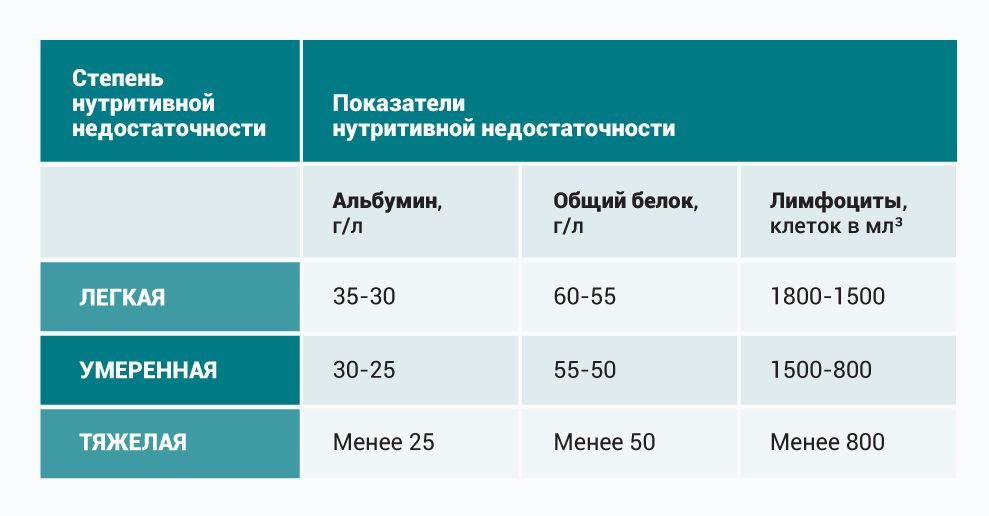
Маркерами белковой недостаточности являются показатели биохимического исследования крови. Определение уровня общего белка в крови и альбумина являются наиболее доступными из них, однако не самыми точными, что связано с относительно длительным периодом полураспада (в пределах 15–20 дней). Более точным является определение трансферрина (в норме: 2–4 г/л, Т1/2–8 дней) и транстиретина (в норме: 170–350 мг/л, Т1/2–2–3 дня).
По снижению белковых маркеров выделяют три степени белковой недостаточности: легкая — снижение показателей в пределах от 10% до 20%, средняя более 20% до 30%, тяжелая — более 30%.
Другими маркерами белковой недостаточности являются альфа1?кислый гликопротеин (орозомукоид), альфа1?
антитрипсин, С-реактивный белок (СРБ). При этом признаками белковой недостаточности считается повышение указанных показателей на 5% и выше.
Также может рассчитываться прогностический индекс воспаления и состояния питания (ПИВСП), предложенный Carpeintier и Ingenbleek, который опирается на концентрацию сывороточного альбумина и транстиретина, а также на активность воспалительного процесса [2, 3]:
ПИВСП = альфа-1 КГП × СРБ × Альб × ТТР,
где альфа-1 КГП — концентрация альфа-1 кислого гликопротеина (мг/л), СРБ — С-реактивный белок (мг/л), Альб — уровень альбумина (г/л), ТТР — уровень транстиретина (мг/л) [4].
Показателями трофологического статуса также являются абсолютное число лимфоцитов, фактический расход энергии и многие другие.
Коррекция нутритивного статуса представляет собой многоплановый процесс, включающий, помимо устранения основного патологического процесса, также коррекцию питания, процессов переваривания и всасывания и метаболических процессов.
Адекватная функция пищеварительных желез, очевидно, необходима для нормального течения метаболических процессов в организме, включая рост и развитие. Секреция панкреатических ферментов, обеспечивающих основные процессы переваривания белков, жиров и углеводов, приведена в табл. 1.
К протеолитическим ферментам поджелудочной железы относятся трипсин, химотрипсин, эластаза и многие другие. Все протеолитические ферменты поджелудочной железы продуцируются в неактивном виде, и в дальнейшем происходит их активация трипсином. Сам трипсин также секретируется в виде неактивного трипсиногена, и его активация происходит в двенадцатиперстной кишке кишечной энтерокиназой. В свою очередь неактивная энтерокиназа активируется дуоденазой, также продуцируемой клетками двенадцатиперстной кишки.
Протеолитическое действие панкреатического секрета обуславливается тремя эндопептидазами — трипсином, химотрипсином и эластазой, которые расщепляют белки и полипептиды, поступающие из желудка. Трипсин специфически действует на пептидные связи, образуемые основными аминокислотами, химотрипсин — на связи между остатками незаряженных аминокислот, в то время как эластаза расщепляет связи, примыкающие к остаткам малых аминокислот, таких как глицин, аланин и серин. Активация трипсиногена осуществляется энтерокиназой, которая гидролизует его лизиновую пептидную связь. Образовавшийся трипсин действует как на новые молекулы трипсиногена, так и на химотрипсиноген, проэластазу и прокарбоксипептидазу — с высвобождением соответственно химотрипсина, эластазы и карбоксипептидазы.
К липолитическим ферментам относятся триацилглицероллипаза (панкреатическая липаза, расщепляющая триглицериды), фосфолипазы и некоторые другие. Кроме того, желчные кислоты активируют липазы, а также предварительно эмульгируют жиры, облегчая воздействие на них ферментов. Амилолитическая активность (расщепление крахмала) панкреатического секрета определяется амилазой, единственным панкреатическим ферментом, который секретируется сразу в активной форме.
Таким образом, экзокринная панкреатическая секреция обеспечивает основные процессы переваривания нутриентов, в связи с чем функциональное состояние поджелудочной железы в значительной степени определяет характер трофологического статуса больного. Так, в экспериментальных исследованиях было показано, что прибавка массы молодых животных достоверно коррелирует с экзокринной функцией поджелудочной железы [5, 6]. Аналогичные закономерности выявлены и в клинической практике, в связи с чем важной составляющей процесса коррекции нутритивного статуса является терапия препаратами панкреатических ферментов.
Высокоактивные препараты панкреатических ферментов (такие как Креон ® ), характеризуются высоким качеством субстрата, защитой от преждевременной активации в полости рта и пищеводе (капсула), определенным размером минимикросфер (1,0–1,2 мм), обеспечивающим равномерное перемешивание с желудочным и кишечным содержимым, а также защитой от инактивации в желудке (рН-чувствительная оболочка минимикросфер).
Высокоактивные препараты пищеварительных ферментов широко используются для лечения заболеваний, сопровождающихся экзокринной панкреатической недостаточностью, как абсолютной, так и относительной. Высокая эффективность их как трофологического фактора была показана впервые при лечении больных с муковисцидозом. Применение этих препаратов не только эффективно корригировало тяжелую панкреатическую недостаточность, характерную для данного заболевания, но и позволило изменить характер питания, повысить усвоение всех нутриентов, существенно улучшить нутритивный статус и, в итоге, не только увеличить продолжительность жизни больных, но и повысить ее качество.
Панкреатическая недостаточность по данным Научно-клинического отдела муковисцидоза ГУ МГНЦ РАМН (Москва) наблюдается у 95,3% пациентов с манифестацией в первые дни жизни. Следствием ее является нарушение всасывания жиров и белков. При этом до 50% поступившего белка может быть потеряно со стулом. У больных муковисцидозом обычно отмечается хорошее всасывание углеводов, однако метаболизм их может быть нарушен, вплоть до развития в старшем возрасте сахарного диабета [7].
Так, по данным Н. И. Капранова и соавт. после введения в терапию детей с муковисцидозом препарата Креон ® число госпитализаций уменьшилось примерно на 30%, также как и число курсов антибактериальной терапии, а качество и продолжительность жизни существенно повысились. Более того, в среднем суммарная стоимость лечения высокоактивными препаратами оказалась примерно в 2–3 раза ниже, по сравнению с применением препаратов средней степени активности, не говоря уже о более высокой фармакологической эффективности [8].
В работах Н. Ю. Каширской и соавт. было показано, что переход на диету без ограничения жиров у больных муковисцидозом возможен при условии адекватной заместительной терапии [7]. При этом достоверно меняется липидный спектр сыворотки крови. Высокожировая, высококалорийная диета в сочетании с приемом микросферических ферментов с рН-чувствительной оболочкой в состоянии поддерживать нормальный нутритивный статус и липидный состав плазмы крови больного муковисцидозом на нормальном уровне, что согласуется с данными зарубежных исследователей [9]. Кроме того, увеличение жирового состава пищи и применение новых форм панкреатических ферментов ведет к увеличению полиненасыщенных жирных кислот в составе фосфолипидов и их метаболитов. Последние работы в области повышения эффективности лечения больных муковисцидозом подтверждают и развивают эту концепцию [10].
Целиакия, наследственное заболевание, связанное с непереносимостью глютена, белка некоторых злаков, характеризуется синдромом мальабсорбции, при котором нарушеается кишечное всасывание практически всех нутриентов. Основой лечения целиакии является безглютеновая диета, которая дополняется посиндромной терапией, в т. ч. направленной на улучшение пищеварительных процессов в кишечнике. Практически обязательным компонентом этой терапии в последние годы стало применение высокоактивных препаратов панкреатических ферментов (Креон ® 10 000 или Креон ® 25 000).
По нашим данным, повышение экскреции триглицеридов с калом, указывающее на экзокринную недостаточность поджелудочной железы, наблюдается у 18% больных в активную стадию целиакии и у 52% — в стадию ремиссии. Механизм вовлечения поджелудочной железы в патологический процесс при целиакии, в первую очередь, связан с нарушением ее гуморальной регуляции со стороны кишечника на фоне атрофических изменений в слизистой оболочке, а также с неспецифическими метаболическими нарушениями у ребенка с тяжелой мальабсорбцией [11].
Исходя из этого, в план обследования больного целиакией должны входить ультразвуковое исследование поджелудочной железы, оценка ее экзокринной функции (оптимальным методом является определение эластазы-1 в кале, но могут быть использованы такие косвенные методы, как липидограмма кала), а также определение активности панкреатических ферментов в крови (трипсина, липазы или эластазы-1 в крови). В состав комплексной терапии целиакии должны входить препараты панкреатических ферментов (например, Креон ® ), назначение которых имеет патогенетическое значение. В большинстве случаев целесообразно использование препарата Креон ® 10000.
По данным ретроспективного анализа детей с целиакией в возрасте от 11 месяцев до 6 лет введение этих препаратов в состав терапии сокращает сроки купирования диарейного синдрома, а также интенсифицирует восстановление нутритивного статуса больных. Данные, касающиеся соматометрических показателей, а также динамики показателей белкового обмена, представлены в табл. 2 и 3).
Обращают внимание различия в итоговом значении ПОМТ через 2 месяца. В дальнейшем этот показатель, также как и другие, практически выравнивается. Эти изменения происходят на фоне нормализации стула — как его частоты, так и консистенции. Корреляция между частотой стула и ПОМТ — отрицательная сильная достоверная (r = 0,72; p ® 10 000)
Полученные данные указывают на большое значение состояния экзокринной секреции поджелудочной железы для восстановления трофологического статуса при целиакии, а также на необходимость назначения высокоактивных препаратов панкреатических ферментов с целью сокращения сроков восстановительного процесса.
Таким образом, панкреатические ферменты — важные трофологические факторы, которые обеспечивают восстановление трофологического статуса пациента при самой разнообразной патологии, а препараты панкреатических ферментов должны использоваться в комплексных схемах их коррекции.
Литература
С. В. Бельмер*, доктор медицинских наук, профессор
Е. В. Митина*
Н. А. Анастасевич*
Л. М. Карпина**
Н. С. Сметанина**, доктор медицинских наук, профессор
*ГБОУ ВПО РНИМУ им. Н. И. Пирогова Минздравсоцразвития, **РДКБ, Москва
Парентеральное питание и гидратация в паллиативной помощи
У большинства паллиативных пациентов возникают проблемы с нутритивным статусом, вследствии чего им требуется парентеральное питание. О том, когда его следует назначать, а когда — нет, можно ли совмещать энтеральное и парентеральное питание и многое другое о нутритивной поддержке рассказала Варвара Брусницына, заведующая отделением длительной респираторной поддержки и отделением паллиативной помощи №3, врач анестезиолог-реаниматолог, врач реабилитолог ГБУЗ «Московский многопрофильный центр паллиативной помощи» ДЗМ.
Статья подготовлена по материалам вебинара из цикла «Врачи врачам»
Как оценить нутритивный статус пациента?
Первое, что необходимо сделать — это оценить тяжесть состояния пациента и его жизненный прогноз. Условно (поскольку четких критериев в паллиативе не существует) всех пациентов можно разделить на две группы:
Обе группы пациентов оцениваются субъективно и объективно.
Субъективная оценка — это мнение врача, которое он составляет о пациенте, просто осматривая его.
Если врач видит снижение или отсутствие подкожно-жировой клетчатки, дряблость кожных покровов, то, скорей всего, сделает вывод, что пациент получает плохое питание или\и его болезнь прогрессирует.
Оценить состояние подкожно-жировой клетчатки довольно просто. Для этого существует специальный прибор, но им вряд ли располагает врач патронажной службы, к тому же без него можно легко обойтись. Для измерения нужно зажать кожную складку под углом лопатки или над трицепсом в средней части плеча и примерно оценить расстояние между пальцами. В норме оно должно быть 1-2 сантиметра. Расстояние меньше одного сантиметра означает, что истощаются запасы жировой клетчатки вследствии их большого расхода, либо пациент недоедает, либо из-за заболевания у него слишком высокий катаболизм.
Всегда проверяйте состояние подкожно-жировой клетчатки, даже если человек выглядит нормально.
Критерии субъективной оценки клинических признаков нутритивной недостаточности:
Объективная оценка — это точные показатели, полученные в результате измерений или обследований.
Шаг 1. Измерение индекса массы тела.
Примеры:
| Вес пациента составляет 72 кг. Его рост 1,75 м. 72 : 1,75² = 72 : 3,0625 = 23,5. 53 : 1,75.² = 53 : 3,0625 = 17,3 Для определения нутритивной недостаточности нельзя ориентироваться только на индекс массы тела, поскольку человек может быть астеником от природы. Это — лишь один из объективных показателей. Европейское общество клинического питания и метаболизма (ESPEN) рекомендует проводить 2-ступенчатый скрининг с использованием ШКАЛЫ NRS-20021. Ступень первая. После определения ИМТ попросите пациента ответить на три вопроса: Ответ «нет» на все вопросы означает, что нутритивная недостаточность отсутствует. Тогда следует провести повторный скрининг через неделю. Поскольку у всех паллиативных пациентов ответ на последний вопрос утвердительный, продолжите скрининг по следующему блоку. Ступень вторая. В диагнозе недостаточно написать только про наличие нутритивной недостаточности. Нужно указать ее степень — легкую, умеренную или тяжелую. Пример: Пациент чувствует себя неплохо, потерял в весе несильно. По этим показателям ему можно присвоить легкую степень нутритивной недостаточности. Но при этом уровень альбумина у него составляет менее 25 г/л, а значит, несмотря на отсутствие других симптомов, следует рассматривать нутритивную недостаточность как тяжелую. По результатам всего комплекса проведенных исследований диетолог может составить необходимое для пациента меню. Что делать, если в штате медицинской организации нет диетолога?Необходимо рассчитать потребность пациента в нутриентах по усредненным значениям. Они прописаны Европейским обществом ESPEN в 2016 году для стационарных (находящихся в стационаре) и лежачих пациентов. Важно! Чтобы точно рассчитать потребность в белке, следует опираться на состояние пациента. Например, для пожилой пациентки с последствиями инсульта, без пролежневого процесса, нужно минимальное количество белка (1,2 г на кг массы тела). Для онкологического пациента с высоким катаболизмом — среднее ( 1,6-1,7 г на кг массы тела). А для пациента с тяжелым хроническим заболеванием и с пролежневым процессом — максимальное (2 г на кг массы тела). Как и чем кормить пациентов?Парентеральное питание, то есть способ введения необходимых организму нутриентов непосредственно в кровь, минуя пищеварительную трубку, бывает полное, неполное и частичное. Показания для парентерального питания Противопоказания для парентерального питания: Кабивен — самый распространенный препарат для парентерального питания. Что важно знать о кабивене? Кабивен бывает двух видов: Центральный кабивен имеет высокую осмолярность (1060 мОсм/л), поэтому при введении в периферические вены может дать осложнения в виде тяжелого тромбофлебита. Варианты парентерального питанияСлучай из практики: Пациентка Н. долгое время провела в реанимации, что очень тяжело в том числе и психологически. К нам в отделение поступила с пролежнями и с тяжелой степенью нутритивной недостаточности, хотя питание вводилось в достаточном количестве. Из-за онкологического процесса у Н. была выведена стома из пищевода на шею. То есть к верхней части, которая идет от глотки, был на шее прикреплен мешочек, а нижняя часть пищевода наглухо ушита и погружена в средостение. Кроме того, на переднюю брюшную стенку была выведена еюностома. Кормить пациентку можно было только через нее. Она долго получала капельно энтеральное питание и кабивен внутривенно. Как-то Н. говорит: «Можно я поем? Так хочется ощутить вкус пищи». Мы, конечно, были в замешательстве — что делать? Но все же решили дать ей мороженое. Оно, конечно, целиком вылилось в пакет на шее, но принесло Н. огромную радость. Причины осложнений парентерального питания:ГиподермоклизЭто методика коррекции дефицита жидкости путем подкожной инфузии. В подкожную клетчатку вводятся: Подкожно можно вводить растворы: Как вводить: со скоростью инфузии 1-3 мл/мин (от 120 до 500 мл/ч) от одного до трех раз в сутки с помощью иглы-бабочки размером 25G-27G. Гиподермоклиз используют в том числе и для восполнения дефицита жидкости у тяжелых пациентов в сопоре или коме. Пациент в тяжелом состоянии без сознания: кормить или нет?Большинство врачей сходятся во мнении, что компенсировать нутритивную недостаточность у такого пациента не нужно. Против выступают обычно родственники — им кажется, что человек умирает именно от голода. Почему не надо кормить принудительно: Обезвоживание — крайне мучительный симптом. Если пациент даже в агональном или предагональном состоянии не получает питания, следите за тем, чтобы у него не было дегидратации. Регидратируйте его подкожным введением жидкости. Страхи и вопросы родственников: как реагировать?Ситуация 1Родственник пациента: У моего близкого человека асцит, и я слышал, что весь белок уходит в жидкость в животе, а значит, ему нужно вводить альбумин. Врач : Альбумин не восполнит дефицит белка при онкологии в терминальной стадии или при декомпенсированном циррозе. Эффект будет временным. Родственник пациента: Но ему в реанимации вводили. Врач: Да, это было правильно для реанимации. Но сейчас ваш близкий в паллиативном отделении. Его состояние ухудшается, и чужеродный раствор вряд ли восполнит дефицит белка. К тому же из-за особенностей заболевания альбумин не в силах предотвратить образование жидкости в брюшной полости. Ситуация 2Родственник пациента: В реанимации моему близкому назначали внутривенное питание из-за невозможности принимать пищу естественным путем. Можно ли это сделать у вас? Ведь он в сознании и очень переживает. Врач: Внутривенное питание – это многокомпонентный препарат, который имеет конкретные показания. Это искусственная смесь. Она не столь безопасна, как кажется, на нее бывают разные реакции. Безусловно, мы рассмотрим ее применение. Тем более, если человек тревожится и мучается от голода. Ситуация 3Родственник пациента: Мой близкий умирает. Он уже меня не слышит, а я переживаю, что он умирает именно от голода, потому что ему не хватает питательных веществ. Я слышал, что есть такое питание, которое вводится в вену. Можно ли его назначить? Врач: На процесс усвоения такого питания тратится очень много энергии, а ваш родной человек в крайне тяжелом состоянии. У него энергии и так совсем мало. Кроме того, сейчас в его организме все процессы замедляются, и ему на их поддержание нужно гораздо меньше ресурса. Проведено много научных исследований, которые доказывают, что в таком тяжелом состоянии отсутствие питания не влияет на продолжительность жизни. Материал подготовлен с использованием гранта Президента Российской Федерации, предоставленного Фондом президентских грантов.
|



_550.gif)