какая изомерия характерна для аминов
Амины
Классификация аминов
По числу углеводородных радикалов амины подразделяются на первичные, вторичные и третичные.
Запомните, что основные свойства аминов выражены тем сильнее, чем больше электронной плотности присутствует на атоме азота. Однако, у третичных аминов три углеводородных радикала создают значительные затруднения для химических реакций.
Таким образом, у третичных аминов основные свойства выражены слабее, чем у вторичных аминов. Основные свойства возрастают в ряду: третичные амины (слабые основные свойства) → первичные амины → вторичные амины (основные свойства хорошо выражены).
Номенклатура и изомерия аминов
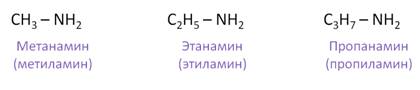
Названия аминов формируются путем добавления суффикса “амин” к названию соответствующего углеводородного радикала: метиламин, этиламин, пропиламин, изопропиламин, бутиламин и т.д. В случае если радикалов несколько, их перечисляют в алфавитном порядке.
Общая формула предельных аминов CnH2n+3N. Атомы углерода находятся в sp3 гибридизации.
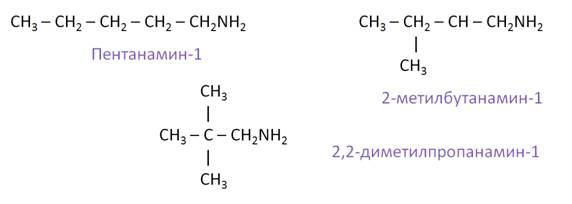
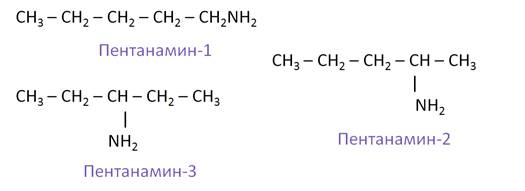
Для аминов характерна структурная изомерия: углеродного скелета, положения функциональной группы и изомерия аминогруппы.
Получение
В основе этой реакции лежит замещение атома галогена в галогеналканах на аминогруппу, при этом образуются амин и соль аммония.
При такой реакции нитрогруппа превращается в аминогруппу, образуется вода.
Знаменитой является предложенная в 1842 году Н.Н. Зининым реакция получения аминов восстановления ароматических нитросоединений (анилина и других). Она возможна в нескольких вариантах, главное, чтобы в начале реакции выделился водород.
Реакция сопровождается разрушением карбонильной группы и отщеплении ее от молекулы амида в виде воды.
В промышленности амины получают реакцией аммиака со спиртами, в ходе которой происходит замещение гидроксогруппы на аминогруппу.
В ходе реакции галогеналканов с аммиаком, аминами, становится возможным получение первичных, вторичных и третичных аминов.
Химические свойства аминов
Как и аммиак, амины обладают основными свойствами, их растворы окрашивают лакмусовую бумажку в синий цвет.
В реакции с водой амины образуют гидроксиды алкиламмония, которые аналогичны гидроксиду аммония. Анилин с водой не реагирует, так как является слабым основанием.
Как основания, амины вступают в реакции с различными кислотами и образуют соли алкиламмония.
Данная реакция помогает различить первичные, вторичные и третичные амины, которые по-разному с ней взаимодействуют.
При конденсации первичных аминов с альдегидами и кетонами получают основания Шиффа, соединения, которые содержат фрагмент “N=C”.
Соли аминов легко разлагаются щелочами (растворимыми основаниями). В результате образуется исходный амин, соль кислоты и вода.
При горении аминов азот чаще всего выделяется в молекулярном виде, так как для реакции азота с кислородом необходима очень высокая температура. Выделение углекислого газа и воды обыкновенно при горении органических веществ.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Амины и аминокислоты. Химические и физические свойства, изомерия строение.
Амины — органические производные аммиака, в молекуле которого один, два или все три атома водорода замещены углеродным остатком.
Классификация аминов:
Можно также считать, что первичные амины являются производными углеводородов, в молекулах которых атом водорода замещен на функциональную группу NH2—, аминогруппу.
Амины, в которых аминогруппа связана непосредственно с ароматическим кольцом, называются ароматическими аминами.
Простейшим представителем этих соединений является аминобензол, или :
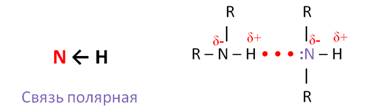
Основной отличительной чертой электронного строения аминов является наличие у атома азота, входящего в функциональную группу, неподеленной электронной пары. Это приводит к тому, что амины проявляют свойства оснований.
Изомерия и номенклатура
Для аминов характерна структурная изомерия:
— изомерия углеродного скелета:
— изомерия положения функциональной группы:
Первичные, вторичные и третичные амины изомерны друг другу (межклассовая изомерия):
CH3−CH2−CH2−NH2 первичный амин (пропиламин)
CH3−CH2−NH−CH3 вторичный амин (метилэтиламин)
Для того, чтобы назвать амин, перечисляют заместители, связанные с атомом азота (по порядку старшинства), и добавляют суффикс -амин.
Физические и химические свойства аминов
Физические свойства.
Простейшие амины (метил амин, диметиламин, триметиламин) — газообразные вещества.
Остальные низшие амины — жидкости, которые хорошо растворяются в воде. Имеют характерный запах, напоминающий запах аммиака.
Первичные и вторичные амины способны образовывать водородные связи. Это приводит к заметному повышению их температур кипения по сравнению с соединениями, имеющими ту же молекулярную массу, но не способными образовывать водородные связи.
Анилин — маслянистая жидкость, ограниченно растворимая в воде, кипящая при температуре 184°С.
Химические свойства аминов.
Химические свойства аминов определяются наличием у атома азота неподеленной электронной пары.
Атом азота аминогруппы, подобно атому азота в молекуле аммиака, за счет неподеленной пары электронов может образовывать ковалентную связь по донорно-акцепторному механизму, выступая в роли донора. В связи с этим амины, как и аммиак, способны присоединять катион водорода, т.е. выступать в роли основания:
NH3+H+→NH4+ (ион аммония)
CH3CH2—NH2+H+→CH3—CH2—NH3+ (ион этиламмония)
Реакция аммиака с водой приводит к образованию гидроксид-ионов:
Раствор амина в воде имеет щелочную реакцию:
Аммиак, реагируя с кислотами, образует соли аммония. Амины также способны вступать в реакцию с кислотами:
2NH3+H2SO4→(NH4)2SO4 (сульфат аммония)
CH3—CH2—NH2+H2SO4→(CH3—CH2—NH3)2SO4 (сульфат этиламмония)
Основные свойства алифатических аминов выражены сильнее, чем у аммиака. Повышение электронной плотности превращает азот в более сильного донора пары электронов, что повышает его основные свойства:
2. Амины горят на воздухе с образованием углекислого газа, воды и азота:
Аминокислоты
Аминокислоты — гетерофункциональные соединения, которые обязательно содержат две функциональные группы: аминогруппу —NH2 и карбоксильную группу —СООН, связанные с углеводородным радикалом.
Общую формулу простейших аминокислот можно записать так:
Так как аминокислоты содержат две различные функциональные группы, которые оказывают влияние друг на друга, характерные реакции отличаются от характерных реакций карбоновых кислот и аминов.
Свойства аминокислот
Аминогруппа —NH2 определяет основные свойства аминокислот, т.к. способна присоединять к себе катион водорода по донорно-акцепторному механизму за счет наличия свободной электронной пары у атома азота.
Группа —СООН (карбоксильная группа) определяет кислотные свойства этих соединений. Следовательно, аминокислоты — это амфотерные органические соединения.
Со щелочами они реагируют как кислоты, а с сильными кислотами — как основания-амины
Кроме того, аминогруппа в аминокислоте вступает во взаимодействие с входящей в ее состав карбоксильной группой, образуя внутреннюю соль:
Так как аминокислоты в водных растворах ведут себя как типичные амфотерные соединения, то в живых организмах они играют роль буферных веществ, поддерживающих определенную концентрацию ионов водорода.
Физические свойства аминокислот
Аминокислоты представляют собой бесцветные кристаллические вещества, плавящиеся с разложением при температуре выше 200°С. Они растворимы в воде и нерастворимы в эфире. В зависимости от радикала R— они могут быть сладкими, горькими или безвкусными.
Классификация аминокислот
Аминокислоты подразделяют на природные (обнаруженные в живых организмах) и синтетические.
Среди природных аминокислот (около 150) выделяют протеиногенные аминокислоты (около 20), которые входят в состав белков. Они представляют собой L-формы. Примерно половина из этих аминокислот относятся к незаменимым, т.к. они не синтезируются в организме человека.
Незаменимыми являются такие кислоты, как валин, лейцин, изолейцин, фенилаланин, лизин, треонин, цистеин, метионин, гистидин, триптофан. В организм человека данные вещества поступают с пищей. Если их количество в пище будет недостаточным, нормальное развитие и функционирование организма человека нарушаются.
Важнейшим свойством аминокислот является способность вступать в молекулярную конденсацию с выделением воды и образованием амидной группировки —NH—CO—, например:
Получаемые в результате такой реакции высокомолекулярные соединения содержат большое число амидных фрагментов и поэтому получили название полиамидов.
Для получения синтетических волокон пригодны аминокислоты с расположением амино- и карбоксильной групп на концах молекул.
Полиамиды α-аминокислот называются пептидами.
В зависимости от числа остатков аминокислот различают дипептиды, пептиды, полипептиды. В таких соединениях группы —NH—CO— называют пептидными.
Амины. Свойства аминов.
Амины – это органические соединения, в которых атом водорода (может и не один) замещен на углеводородный радикал. Все амины делят на:
В зависимости от типа радикала амины могут быть:
Алифатические предельные амины.
Строение аминов.
Элекронодонорные заместители повышают электронную плотность на атоме азота и усиливают основные свойства аминов, по этой причин вторичные амины являются более сильными основаниями, чем первичные, т.к. 2 радикала у атома азота создают большую электронную плотность, чем 1.
В третичных атомах играет важную роль пространственный фактор: т.к. 3 радикала заслоняют неподеленную пару азота, к которой сложно «подступиться» другим реагентам, основность таких аминов меньше, чем первичных или вторичных.
Изомерия аминов.
Для аминов свойственна изомерия углеродного скелета, изомерия положения аминогруппы:
Как называть амины?
В названии обычно перечисляют углеводородные радикалы (в алфавитном порядке) и добавляют окончание –амин:
Физические свойства аминов.
Первые 3 амина – газы, средние члены алифатического ряда – жидкости, а высшие – твердые вещества. Температура кипения у аминов выше, чем у соответствующих углеводородов, т.к. в жидкой фазе в молекуле образуются водородные связи.
Амины хорошо растворимы в воде, по мере роста углеводородного радикала растворимость падает.
Получение аминов.
1. Алкилирование аммиака (основной способ), который происходит при нагревании алкилгалогенида с аммиаком:
Если алкилгалогенид в избытке, то первичный амин может вступать в реакцию алкилирования, превращаясь во вторичный или третичный амин:
2. Восстановление нитросоединений:
Используют сульфид аммония (реакция Зинина), цинк или железо в кислой среде, алюминий в щелочной среде или водород в газовой фазе.
3. Восстановление нитрилов. Используют LiAlH4:
4. Ферментатичное декарбоксилирование аминокислот:
Химические свойства аминов.
Все амины – сильные основания, причем алифатические более сильные, чем аммиак.
Водные растворы имеют щелочной характер:
Амины реагируют с кислотами, образуя соли:
Соли – твердые вещества, хорошо растворимы в воде и плохо растворимы в неполярных жидкостях. При реакции с щелочами выделяются свободные амины:
2. Образование комплексных соединений с переходными металлами:
3. Реакция с азотистой кислотой, которая образуется по следующей схеме:
4. Сгорание аминов. В результате образуется углекислый газ, азот и вода:
Применение аминов.
Низшие алифатические амины используют для синтеза лекарственных средств, пластмасс и пестицидов.
Амины
Урок 34. Химия 10 класс (ФГОС)
В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Чтобы получить доступ к этому и другим видеоурокам комплекта, вам нужно добавить его в личный кабинет, приобрев в каталоге.
Получите невероятные возможности
Конспект урока “Амины”
В органической химии есть вещества, содержащие не только атомы кислорода, как спирты, альдегиды и карбоновые кислоты, но и соединения, в состав которых входят атомы азота. Их так и называют азотсодержащие органические соединения.
К азотсодержащим органическим соединениям относятся: нитросоединения, содержащие нитрогруппу, связанную с углеводородным радикалом. К азотсодержащим органическим соединениям относятся также амины, аминокислоты и белки.
Большой вклад в изучение и получение азотосодержащих органических соединений внесли русские учёные А. Я. Данилевский и Н. Н. Зинин.
Амины можно представить как производные аммиака, в молекулах которого один или несколько атомов водорода заменены на углеводородные радикалы.
В зависимости от числа углеводородных групп, замещающих атомы водорода в молекуле аммиака, различают первичные, вторичные и третичные амины.
В зависимости от природы углеводородных заместителей амины делятся на: алифатические, например метиламин, алициклические, как циклогексиламин и ароматические, как фениламин, или анилин.
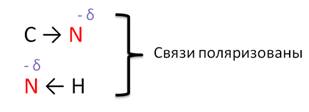
В молекулах аминов связи C – N и N – H поляризованы, потому что атом азота является более электроотрицательным, чем атомы углерода и водорода, но полярность связи в аминах выражена меньше, чем в спиртах, поэтому и реакции замещения менее характерны.
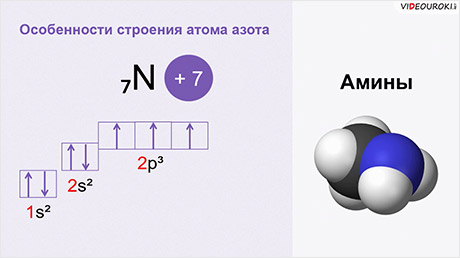
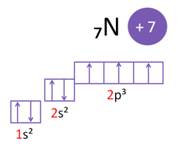
Свойства аминов также обусловлены особенностями строения атома азота. Так, в атоме азота на внешнем энергетическом уровне три неспаренных электрона, которые могут образовывать связи с другими атомами. А одна пара электронов у атома азота остаётся неподелённой.
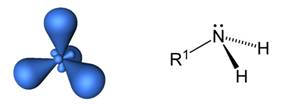
Атом азота в аминах имеет тетраэдрическую ориентацию орбиталей, а сама молекула – тригонально-пирамидальную структуру.
Названия первичных аминов по заместительной номенклатуре состоит из названия исходных углеводородов с добавлением слова «амин». Назовём первичные амины. Первый амин называется метанамин, или метиламин, второй – этанамин, или этиламин, третий амин называется пропанамин, или пропиламин.
Вторичные амины по номенклатуре ИЮПАК называют следующим образом: указывают наличие атома азота символом N и после дефиса перечисляют младшую, потом старшую углеводородные группы, добавляя в конце слово «амин». Назовём вторичные амины.
Для аминов характерна структурная изомерия, которая обусловлена изомерией углеродного скелета (изомерия цепи) и изомерия положения аминогруппы.
Составим всевозможные изомеры к амину состава C5H11NH2. Изомерия углеродной цепи будет представлена изомерами: пентанамином-1, 2-метилбутанамином-1 и 2, 2-диметилпропанамином-1.
Изомерия положения аминогруппы представлена такими изомерами, как: пентанамин-1, пентанамин-2, пентанамин-3.
Первичные, вторичные и третичные амины, у которых одинаковое число атомов углерода, изомерны между собой. Так, изомерами между собой являются этиламин и диметиламин.
Метиламин, диметиламин и триметиламин – газообразные вещества, с запахом аммиака, хорошо растворяются в воде, так как их молекулы образуют водородные связи с молекулами воды. Средние члены алифатического ряда – жидкости со слабым запахом тухлой рыбы, с постепенно повышающейся температурой кипения. Высшие амины – твёрдые нерастворимые вещества, не имеющие запаха.
Связь N – H является полярной, поэтому первичные и вторичные амины образуют межмолекулярные водородные связи (несколько более слабые, чем Н-связи с участием группы О – Н).
Это объясняет относительно высокую температуру кипения аминов по сравнению с алканами со схожей молекулярной массой. Амины кипят при более низкой температуре, чем спирты со схожей молекулярной массой, так как межмолекулярные водородные связи в них менее прочные из-за меньшей электроотрицательности азота.
Амины широко распространены в природе. Например, многие биологически активные вещества относятся к аминам.
Триметиламин впервые был выделен в середине 19 века из продуктов перегонки селёдочного рассола, поэтому он и получил название «рыбный газ» и имел специфический запах рыбы. Триметиламин получилось выделить и из слёз человека, желудочного сока, поджелудочной железы.
Химические свойства аминов обусловлены наличием аминогруппы, а в частности наличием неподелённой пары электронов у атома азота. Эта непроделённая пара электронов может образовывать химическую связь по донорно-акцепторному механизму. Поэтому амины – это органические основания.
Например, при растворении метиламина в воде образуется щелочной раствор и ион метиламмония.
Амины реагируют с неорганическими кислотами с образованием аммониевых солей. Так, в реакции метиламина с соляной кислотой образуется соль – хлорид метиламмония, в реакции этиламина с серной кислотой образуется соль – гидросульфат этиламмония.
Если на полученную соль подействовать более сильным основанием, то образуется исходный амин. Так, при действии на соль – гидросульфат этиламмония гидроксидом натрия образуется этиламин.
Для аминов, как и других органических соединений, характерны реакции горения. Так, при горении метиламина образуется оксид углерода (IV), вода и азот.
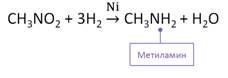
В лаборатории первичные амины получают восстановлением нитросоединений. Так, при восстановлении нитрометана водородом в присутствии никелевого катализатора образуется метиламин и вода.
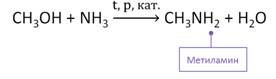
В промышленности амины получают в реакции спирта и аммиака под давлением. Так, в реакции метанола с аммиаком в присутствии катализатора – оксида алюминия, образуется метиламин.
Амины используют при получении лекарственных веществ, красителей и исходных продуктов для органического синтеза, для получения взрывчатых веществ. Гексаметилендиамин при поликонденсации с адипиновой кислотой даёт полиамидные волокна. Многие амины и их производные применяют в косметической, пищевой, нефтехимической промышленности.
Таким образом, аминами называются производные аммиака, в которых атомы водорода замещены на углеводородные радикалы. Функциональной группой аминов является NH2 – группа – аминогруппа. Для аминов характерна структурная изомерия: изомерия углеродной цепи и положения аминогруппы. Амины проявляют основные свойства в реакциях с неорганическими и органическими кислотами. Получают амины из нитросоединений и спиртов. Амины находят широкое применение в производстве красителей, лекарственных и взрывчатых веществ.