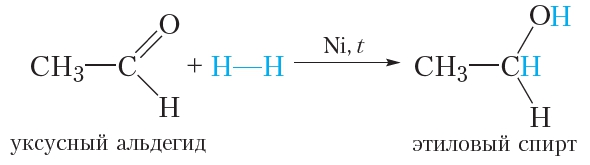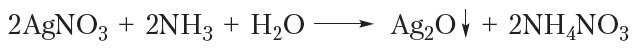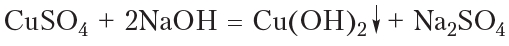какая реакция является качественной на альдегиды
Альдегиды
Не часто встречаются в природе в отдельном виде, но, несомненно, играют важную роль в физиологических процессах растений и животных. Общая формула альдегидов CnH2nO.
Многие альдегиды имеют специфический запах. Высшие альдегиды, в особенности непредельные, используются в пищевой промышленности и парфюмерии.
Номенклатура и изомерия альдегидов
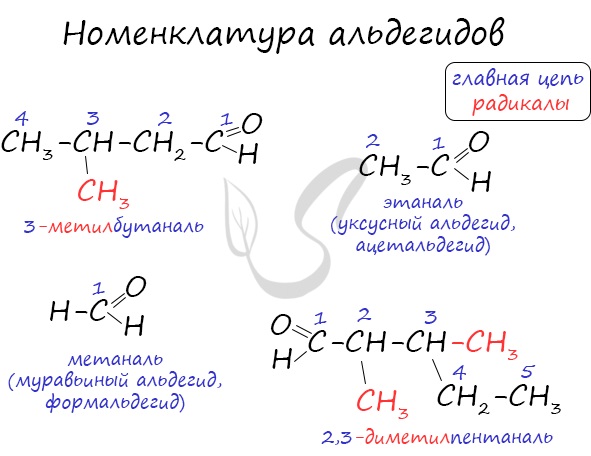
Названия альдегидов формируются путем добавления суффикса “аль” к названию алкана с соответствующим числом атомов углерода: метаналь, этаналь, пропаналь, бутаналь, пентаналь и т.д.
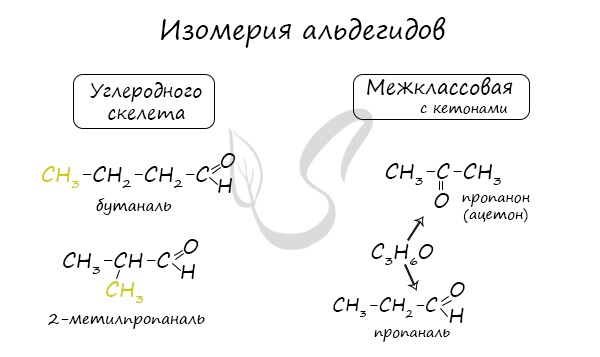
Для альдегидов характерна структурная изомерия: углеродного скелета, межклассовая изомерия с кетонами.
Получение альдегидов и кетонов
Этот способ также просто осуществить в лабораторных условиях. При пиролизе (нагревании без доступа кислорода) кальциевых или бариевых солей карбоновых кислот возможно получение кетонов.
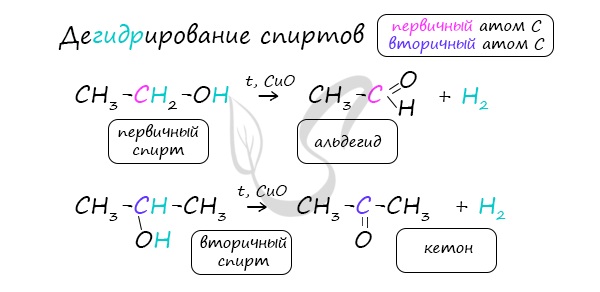
В присутствии катализатора и при нагревании спиртов от гидроксогруппы и прилежащего к ней атома углерода отщепляется по атому водорода. В результате образуется карбонильная группа.
Реакцией Кучерова называют гидратацию алкинов в присутствии солей двухвалентной ртути.
В результате такой реакции ацетилен превращается в уксусный альдегид. Все остальные его гомологи: пропин, бутин, пентин и т.д. превращаются в соответствующие кетоны.
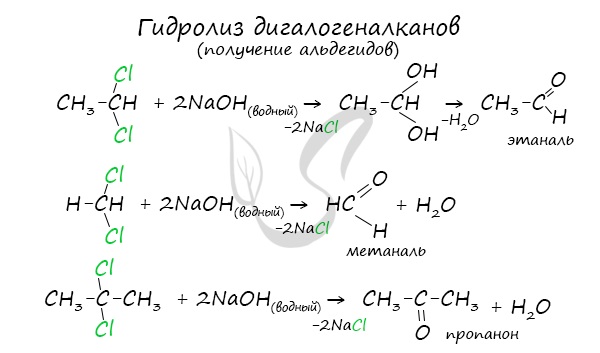
В результате такого гидролиза образуются двухатомные спирты, в которых две OH-группы прилежат к одному атому углерода. Такие соединения неустойчивы и распадаются на карбонильное соединение (альдегид или кетон) и воду.
В промышленности окислением метана при температуре 500 °C и в присутствии катализатора получают формальдегид.
В прошлой теме, посвященной фенолам, мы касались данного способа. В результате такой реакции образуется не только фенол, но и ацетон.
Химические свойства альдегидов и кетонов
Запомните, что для альдегидов и кетонов характерны реакции присоединения по карбонильной группе. Это является важным отличием альдегидов от карбоновых кислот, для которых реакции присоединения не характерны.
Для понимания механизма реакции важно вспомнить об электроотрицательности. В карбонильной группе кислорд, как более электроотрицательный элемент, тянет электронную плотность на себя от углерода. На атоме кислорода возникает частичный отрицательный заряд (δ-), а на атоме углерода частичный положительный (δ+).
Основы школьного курса физики подсказывают, что отрицательный заряд притягивает положительный: именно так и будет происходить при присоединении различных молекул к карбонильной группе альдегидов и кетонов.
В результате полного окисления, горения, образуется углекислый газ и вода.
Альдегиды легко окисляются до карбоновых кислот в лабораторных условиях. Это осуществляется с помощью известной реакции серебряного зеркала. Данная реакция является качественной для альдегидов.
Кетоны, в отличие от альдегидов, в реакции окисления не вступают.
Обратите особое внимание, что при написании реакции с аммиачным раствором серебра в полном виде, правильнее будет указать не кислоту, а ее аммиачную соль. Это связано с тем, что выделяющийся аммиак, который обладает основными свойствами, реагирует с кислотой с образованием соли
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Альдегиды
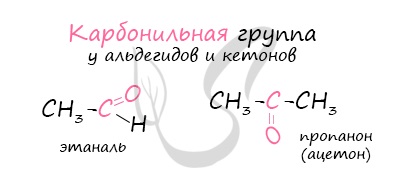
Альдегиды являются представителями карбонильных соединений.
Карбонильные соединения (оксосоединения) – это производные УВ, содержащие в молекуле карбонильную группу С = О.
Альдегиды – это органические соединения, молекулы которых содержат альдегидную группу, связанную с углеводородным радикалом.
В зависимости от характера углеводородного радикала, связанного с альдегидной группой, альдегиды разделяются на предельные, непредельные и ароматические.
Предельные (насыщенные) альдегиды
Гомологический ряд
Номенклатура и изомерия
Название альдегида по международной номенклатуре образуется от названия соответствующего алкана с таким же числом атомов углерода с добавлением окончания –аль. Нумерацию углеродной цепи начинают от атома углерода альдегидной группы.
В пределах класса альдегидов возможен только один вид изомерии – изомерия углеродной цепи.
Физические свойства
Низшие альдегиды имеют резкий запах, высшие альдегиды, содержащие 8—12 атомов «С», — душистые вещества. Альдегиды с 1—3 атомами «С» хорошо растворяются в воде; с увеличением числа атомов «С» растворимость уменьшается. Все альдегиды растворяются в органических растворителях.
Альдегиды раздражают слизистые оболочки глаз и верхних дыхательных путей, вредно влияют на нервную систему.
Химические свойства
Альдегиды — один из наиболее реакционноспособных классов органических соединений, что связано с наличием в их молекулах высокополяризованной карбонильной группы >С=О.
Для альдегидов характерны реакции присоединения, окисления, полимеризации и поликонденсации.
I. Реакции присоединения
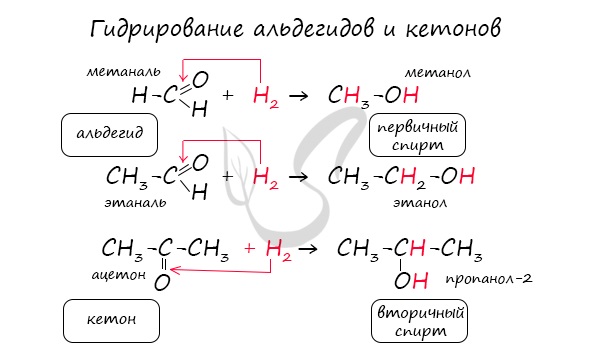
1.Гидрирование (восстановление) с образованием первичных спиртов RCH2ОH:
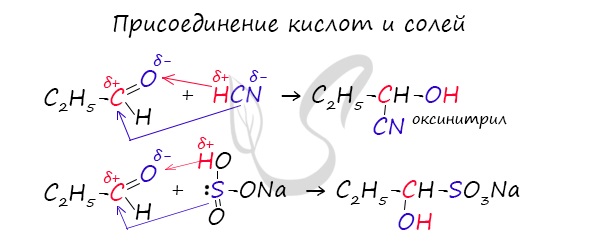
2.Присоединение спиртов с образованием полуацеталей:
Гидроксильная группа полуацеталей очень реакционноспособна.
В присутствии катализатора – хлороводорода и при избытке спирта образуются ацетали RCH(OR)2:
3.Присоединение гидросульфита натрия NaHSO3 с образованием гидросульфитных производных альдегидов:
Этой реакцией часто пользуются для выделения альдегидов из смесей или с целью их очистки.
II. Реакции окисления
В молекулах альдегидов атом углерода карбонильной группы, имеющий избыточный положительный заряд, притягивает к себе электроны связи С—Н. Вследствие этого атом водорода приобретает большую реакционную активность, что проявляется в способности альдегидов к окислению. Альдегиды легко окисляются до карбоновых кислот с тем же числом углеродных атомов различными окислителями (сильные окислители: О2 воздуха, подкисленный раствор K2Cr2O7 или КМnО4, слабые окислители: аммиачный раствор оксида серебра (I), щелочной раствор сульфата меди (II) и др.):
Реакции с аммиачным раствором оксида серебра (I) и щелочным раствором сульфата меди (II) являются качественными реакциями на альдегиды.
1.Взаимодействие с аммиачным раствором оксида серебра (I) — «реакция серебряного зеркала».
Оксид серебра (I) образуется в результате взаимодействия нитрата серебра(I) с NH4ОH:
Металлическое серебро осаждается на стенках пробирки в виде тонкого слоя, образуя зеркальную поверхность.
2.Взаимодействие с гидроксидом меди (II)
Для реакции используют свежеприготовленный Cu(OH)2 образующийся при взаимодействии растворимой соли меди (II) со щелочью:
III. Реакции полимеризации (характерны для низших альдегидов)
1.Линейная полимеризация
При испарении или длительном стоянии раствора формальдегида происходит образование полимера— параформальдегида:
Полимеризация безводного формальдегида в присутствии катализатора — пентакарбонила железа Fe(CO)5 — приводит к образованию высокомолекулярного соединения— полиформальдегида (полиоксиметилен, полиметиленоксид):
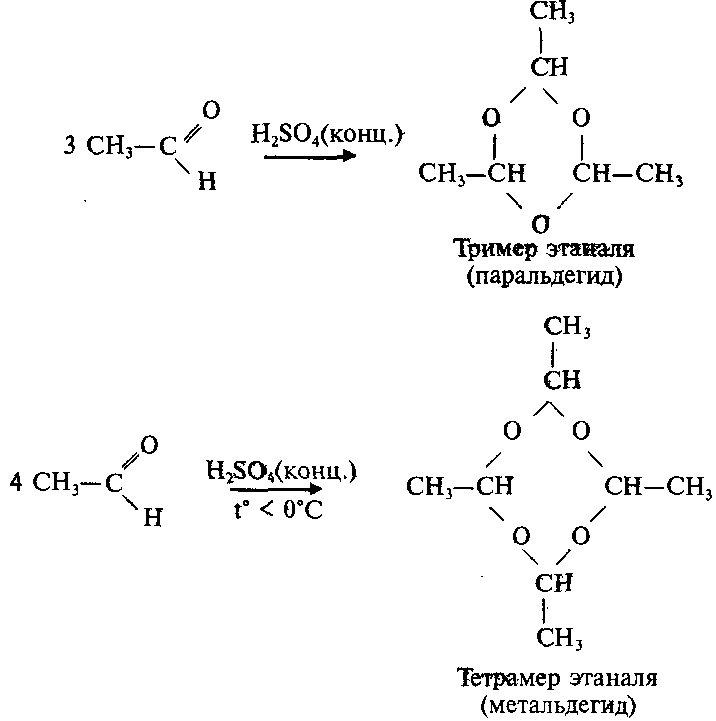
2.Циклическая полимеризация (тримеризация, тетрамеризация)
Тример метаналя получается при перегонке подкисленного раствора формальдегида:
Уксусный альдегид образует циклические триммер и тетрамер:
IV. Реакции поликонденсации
Реакции поликонденсации — это процессы образования высокомолекулярных веществ, в ходе которых соединение исходных мономерных молекул сопровождается выделением таких низкомолекулярных продуктов, как Н2О, НCl, NH3 и др.
В кислой или щелочной среде при нагревании формальдегид (образует с фенолом высокомолекулярные продукты — фенолформальдегидные смолы различного строения:
Вначале в присутствии катализатора происходит взаимодействие между молекулой формальдегида и молекулой фенола с образованием фенолоспирта:
При нагревании фенолоспирты конденсируются с образованием фенолформальдегидных полимеров:
Фенолформальдегидные смолы используются для получения пластических масс (фенопластов).
Способы получения
I. Общие методы получения
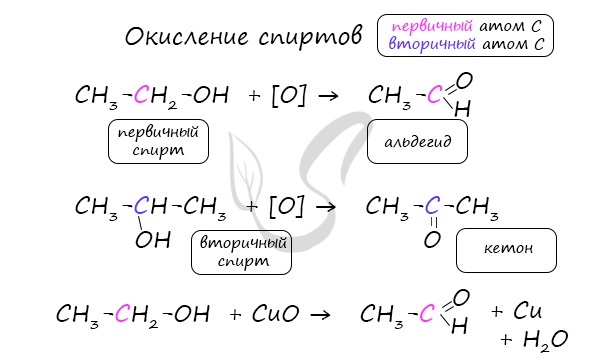
1.Окисление первичных спиртов:
б) под действием окислителей (K2Cr2O7 или KMnO4 в кислой среде)
2.Каталитическое дегидрирование первичных спиртов:
3.Гидролиз дигалогеналканов, содержащих 2 атома галогена у первого атома углеродного атома:
II. Специфические способы получения
Формальдегид можно получить при каталитическом окислении метана:
Ацетальдегид получают реакцией Кучерова:
или при каталитическом окислении этилена:
Данный способ в последнее время широко используется для промышленного получения ацетальдегида. Однако аналогично могут быть получены и другие альдегиды при окислении гомологов этилена, например:
Скачать бесплатно реферат на тему: «Альдегиды» Альдегиды.docx (Одна Загрузка)
Скачать бесплатно реферат на тему: «Альдегиды и кетоны» Альдегиды-и-кетоны.docx (Одна Загрузка)
Скачать рефераты по другим темам можно здесь
Химия. 10 класс
§ 30. Химические свойства, получение и применение альдегидов
Химические свойства альдегидов
Химические свойства альдегидов прежде всего обусловлены наличием в их молекулах альдегидной группы. По месту двойной связи альдегидной группы могут протекать реакции присоединения.
1. Гидрирование. Присоединение водорода
Молекула альдегида может присоединить по двойной связи молекулу водорода. Такая реакция сопровождаются разрывом π-связи в молекуле альдегида, так как она менее прочная, чем σ-связь:
Условия протекания данной реакции схожи с реакцией гидрирования алкенов: смесь водорода с парами альдегида пропускают над нагретым никелевым катализатором.
Продуктом присоединения водорода к альдегиду является первичный спирт.
В результате присоединения водорода молекула альдегида восстанавливается, поэтому реакцию с водородом также называют реакцией восстановления альдегидов.
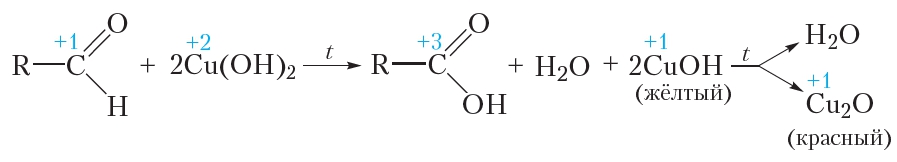
2. Окисление
Альдегидная группа легко окисляется. В качестве окислителей могут выступать ионы металлов, расположенных в ряду активности правее водорода — ионы серебра (Ag + ) и меди (Cu 2+ ).
Окисление альдегидов аммиачным раствором оксида серебра
Если к разбавленному раствору нитрата серебра приливать раствор аммиака, то выпадает белый осадок оксида серебра:
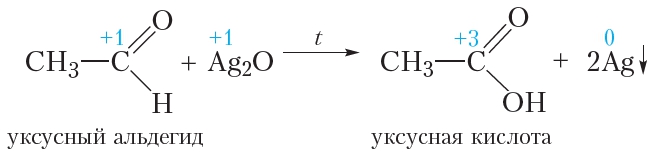
Этот осадок сразу же растворяется в избытке аммиака. Образующийся прозрачный раствор называется аммиачным раствором оксида серебра. Если к этому раствору прибавить раствор уксусного альдегида и смесь осторожно нагреть, то вскоре на стенках пробирки образуется блестящий зеркальный налёт серебра, благодаря чему эта реакция называется реакцией «серебряного зеркала».
В протекающей реакции уксусный альдегид окисляется до уксусной кислоты, а оксид серебра восстанавливается с образованием металлического серебра:
Реакция «серебряного зеркала» является качественной реакцией на альдегиды.
Окисление альдегидов гидроксидом меди(II)
В качестве окислителя альдегидов до соответствующих кислот может быть использован также гидроксид меди(II). Для проведения такой реакции в пробирку помещают раствор сульфата меди(II), затем прибавляют раствор щёлочи. При этом выпадает голубой осадок гидроксида меди(II):
Затем в пробирку с осадком добавляют водный раствор альдегида и смесь нагревают. В процессе нагревания изначально голубой осадок становится жёлтым, а при дальнейшем нагревании — красным. Уравнение протекающей реакции:
Как видно из приведённого уравнения реакции, в результате восстановления гидроксида меди(II) образуется жёлтый осадок гидроксида меди(I), который при нагревании разлагается с образованием красного оксида меди(I).
Как и в случае реакции «серебряного зеркала», продуктом окисления альдегида является карбоновая кислота.
Реакция окисления альдегидов гидроксидом меди(II) так же, как и реакция «серебряного зеркала», является качественной реакцией на альдегиды.
Способность альдегидов окисляться до карбоновых кислот и восстанавливаться до спиртов особенно наглядно демонстрирует взаимосвязь между классами органических соединений, благодаря которой вещества одного класса могут быть получены из представителей других классов.
Качественные реакции органических соединений
Содержание:
Реакции называют качественными, если в результате взаимодействия между веществами происходят характерные видимые изменения (выпадет осадок, меняется или появляется окрашивание, выделяется газ). Благодаря таким реакциям можно определить природу соединения и отнести его к соответствующему классу. Органические соединения, содержащие одинаковые функциональные группы будут вступать в одни и те же взаимодействия, и давать схожий результат. Качественные реакции позволяют проводить идентификацию соединений.
Качественное определение углеводородов
Наименование, общая формула ряда, особенности
Качественные реакции
Предельные (насыщенные) углеводородные соединения – алканы
Это соединения углерода и водорода, в молекулах которых на каждый атом углерода приходится по четыре одинарные связи.
Определить алканы в смеси можно следующими способами:
Непредельные углеводородные соединения алкены
Ненасыщенные углеводороды алкены содержат в молекуле одну двойную связь типа С=С.
Наличие двойной связи обуславливает протекание таких характерных реакций, как:
Непредельные углеводороды алкины
Молекулы алкинов отличаются наличием одной тройной связи.
Непредельный характер связи обуславливает взаимодействие с водным калия перманганатом. Розовая окраска исчезает:
При взаимодействии алкинов с водным бромом, желтая окраска исчезает:
Алкины с крайним расположением ненасыщенной связи вступают в реакцию с аммиачными комплексами серебра. Выпадет осадок соединений серебра желтого цвета:
Расположение тройной связи у крайнего атома углерода обуславливает и образование красного осадка с аммиачным комплексом меди хлорида (I):
Непредельные углеводородные соединения алкадиены
Молекула алкадиенов содержит две двойные связи типа С=С.
Алкадиены вступают в отличительные реакции на непредельные связи. Обесцвечивание раствора марганцовки и желтого водного раствора брома идут по схемам:
Идентификация спиртов
Спирты содержат гидроксильные группы – ОН. В молекуле их может быть одна (одноатомные) или несколько (многоатомные).
Качественные реакции на гидроксильную группу:
Определение бензойного кольца
Бензойное кольцо образуют шесть углеродных атомов, соединенных между собой в замкнутое кольцо. Одинарные связи С – С чередуются с двойными связями С = С. Соединения такой структуры называют аренами. Простейший представитель ряда – бензол. Структурная формула бензола выглядит так:
Качественные реакции на бензойное кольцо обусловлены особенностями строения.
Определение бензойного кольца
При взаимодействии аренов со смесью серной и азотной кислот в условиях повышенной температуры, на дне пробирки образуется маслянистая жидкость с миндальным запахом:
Если один атом водорода бензойного кольца заместить углеводородным радикалом, образуются соединения, называемые гомологами бензола. Простейшее из них – толуол. В его молекуле атом водорода заменен на метиловый радикал.
Определение толуола
Обесцвечивание нейтрального раствора марганцовки с выпадением осадка бурого цвета окиси марганца:
Определение фенолов
Простейшим представителем ряда является фенол, который имеет следующее строение:
Способы обнаружения фенолов:
Качественное определение альдегидной группы
Наличие альдегидной группы отличает органические соединения классов альдегидов и кетонов. Помимо атомов углерода и водорода, в молекуле присутствует кислород. Общая формула альдегидов выглядит так:
Соединения подобного строения, где атом водорода замещен на углеводородный радикал, называются кетонами.
Для альдегидной группы характерны следующие качественные реакции:
Обнаружение карбоновых кислот
Карбоновые кислоты содержат карбоксильную группу, определяющую их свойства. Общая формула соединений:
Благодаря кислотным свойствам соединения этого класса окрашивают лакмусовую бумагу в розовый цвет.
Карбонильную группу идентифицируют следующими способами:
Ощущается характерный запах образующегося эфира.
Обнаружение анилина
Анилин – это ароматический амин, производное бензола и аммиака. Структурная формула имеет вид:
Анилин обнаруживают двумя способами:
Идентификация сложных эфиров
Сложные эфиры являются продуктом реакций этерификации. Образуются из спиртов и кислот. Общая формула сложных эфиров выглядит так:
Качественное определение белков
Качественные реакции на углеводы
Углеводы имеют сложное строение. Химические свойства ряда обусловлены природой веществ и наличием карбонильной группы и спиртовых гидроксилов. Самыми известными углеводами являются глюкоза и крахмал.
Крахмал при добавлении раствора йода дает синее окрашивание.