какая связь между натрием и хлором
Хлорид натрия: способы получения и химические свойства
Хлорид натрия NaCl — соль щелочного металла натрия и хлороводородной кислоты. Белое кристаллические вещество. Плавится и кипит без разложения. Умеренно растворяется в воде (гидролиза нет);
Относительная молекулярная масса Mr = 58,44; относительная плотность для ж. и тв. состояния d = 2,165; tпл = 800,8º C; tкип = 1465º C;
Способ получения
1. Хлорид натрия можно получить путем взаимодействия натрия и разбавленной хлороводородной кислоты, образуются хлорид натрия и газ водород:
2Na + 2HCl = 2NaCl + H2↑.
2. При комнатной температуре, в результате взаимодействия натрия и хлора, образуется хлорид натрия:
2Na + Cl2 = 2NaCl
3. Концентрированный раствор гидроксида натрия реагирует с концентрированным раствором хлорида аммония при кипении. При этом образуются хлорид натрия, газ аммиак и вода:
NaOH + NH4Cl = NaCl + NH3↑ + H2O
4. При взаимодействии с разбавленной и холодной хлороводородной кислотой пер окси д натрия образует хлорид натрия и пероксид водорода:
NaOH + HCl = NaCl + H2O
6. В результате взаимодействия сульфата натрия и хлорида бария образуется сульфат бария и хлорид натрия:
Качественная реакция
Качественная реакция на хлорид натрия — взаимодействие его с нитратом серебра, в результате реакции происходит образование белого творожного осадка:
NaCl + AgNO3 = NaNO3 + AgCl↓
Химические свойства
1. Хлорид натрия вступает в реакцию со многими сложными веществами :
2.1. Хлорид натрия взаимодействует с кислотами :
2.1.1. Хлорид натрия в твердом состоянии при кипении реагирует с концентрированной серной кислотой с образованием сульфата натрия и газа хлороводорода:
а если температуру опустить до 50º С, то твердый хлорид натрия и концентрированная серная кислота образуют гидросульфат натрия и газ хлороводород:
2.2. Хлорид натрия способен вступать в реакцию обмена со многими солями :
2.2.3. При взаимодействии холодного хлорида натрия с насыщенным нитритом серебра выделяются нитрат натрия и осадок хлорид серебра:
NaCl + AgNO2 = NaNO2 + AgCl↓
Ионная связь
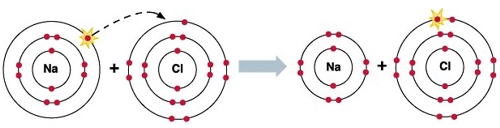
Как видим, натрий имеет один валентный электрон, который он “согласен” отдать, чтобы его энергетические уровни стали завершенными.
Как видим, хлор имеет 7 валентных электронов и ему “не хватает” одного электрона, чтобы его энергетические уровни стали завершенными.
Теперь догадываетесь, почему так “дружны” атомы хлора и натрия?
| Главный закон химической реакции – заполнение валентного энергетического уровня |
Натрий: Na
Электронная конфигурация катиона натрия: Na + 1s 2 2s 2 2p 6
Хлор: Cl
Поваренная соль (хлорид натрия): NaCl
Исходя из вышесказанного, видно, что электрон, который отдает натрий, становится электроном, который получает хлор.
В кристаллической решетке хлорида натрия каждый катион натрия окружен шестью анионами хлора. И наоборот, каждый анион хлора окружен шестью катионами натрия.
Соединения с ионными связями называют солями. В твердом состоянии все ионные соединения являются кристаллическими веществами.
| Ионная связь – химическая связь между катионами и анионами (заряженными частицами, в которые превращаются атомы после отдачи или присоединения электронов). |
Чтобы не “обижать” ионные соединения, химики договорились считать, что химическая связь является ионной, если разность электроотрицательностей атомов, образующих молекулу вещества равна или более 2. (см. понятие электроотрицательности).
Катионы и анионы
Другие соли образуются по аналогичному принципу, что и хлорид натрия. Металл отдает электроны, а неметалл их получает. Из периодической таблицы видно, что:
Распространенные одноатомные катионы
| Группа | Элемент | Ион | Обозначение |
| IA | Литий Натрий Калий | Катион лития Катион натрия Катион калия | Li + Na + K + |
| IIA | Бериллий Магний Кальций Стронций Барий | Катион бериллия Катион магния Катион кальция Катион стронция Катион бария | Be 2+ Mg 2+ Ca 2+ Sr 2+ Ba 2+ |
| IB | Серебро | Катион серебра | Ag + |
| IIB | Цинк | Катион цинка | Zn 2+ |
| IIIB | Алюминий | Катион алюминия | Al 3+ |
Распространенные одноатомные анионы
Не все так просто с переходными металлами (группа В), которые могут отдавать разное количество электронов, образуя при этом по два (и более) катиона, имеющих разные заряды. Например:
| Электрический заряд, который получает атом, называется степенью окисления |
Многие ионы переходных металлов могут иметь разную степень окисления.
Примеры многоатомных ионов:
Если вам понравился сайт, будем благодарны за его популяризацию 🙂 Расскажите о нас друзьям на форуме, в блоге, сообществе. Это наша кнопочка:
Код кнопки: 
Политика конфиденциальности Об авторе
Какая связь между натрием и хлором
§3.2 Ковалентная связь. Понятие о полярной ковалентной и ионной связи.
В слове “ковалентная” приставка “ко-” означает “совместное участие”. А “валента” в переводе на русский – сила, способность. В данном случае имеется в виду способность атомов связываться с другими атомами.
Рис 3-1. Возникновение ковалентной связи при образовании молекулы водорода из двух атомов водорода. Электронные оболочки атомов водорода (с одним s-электроном у каждого атома) сливаются в общее электронное облако (молекулярную орбиталь), где оба электрона “обслуживают” ядра независимо от того, “свое” это ядро или “чужое”.
Когда электронные оболочки двух атомов водорода сближаются и образуют новую, теперь уже молекулярную электронную оболочку (рис. 3-1), эта новая оболочка подобна завершенной электронной оболочке атома благородного газа гелия (1s 2 ).
Завершенные оболочки, как мы помним, устойчивее незавершенных. Таким образом, суммарная энергия новой системы – молекулы водорода – оказывается гораздо ниже суммарной энергии двух несвязанных атомов водорода. Избыток энергии при этом выделяется в виде теплоты.
Минимум энергии молекулы отвечает определенному расстоянию между ядрами атомов водорода (рис. 3-2). Если атомы в молекуле с помощью внешней силы сдвинуть еще ближе, то в действие вступает мощное отталкивание между одноименно заряженными ядрами атомов и общая энергия системы начинает возрастать. Это невыгодно системе, поэтому длина связи представляет собой строго определенное, равновесное значение. Для молекулы водорода равновесная длина химической связи составляет 0,74 ангстрема (1 А = 10 –8 см), как это видно на рис. 3-2.
Рис. 3-2. Кривая изменения потенциальной энергии при взаимодействии двух атомов водорода с образованием молекулы водорода.
Рис. 3-3. Другой способ изображения атомных и молекулярной орбиталей: густота точек отражает “электронную плотность”, то есть вероятность нахождения электрона в какой-либо точке пространства около ядер атомов водорода. Видно, что значительная электронная плотность сосредоточена в пространстве между двумя ядрами в молекуле водорода.
На рисунках 3-1 и 3-3 вы видите очень детальное изображение ковалентной связи. На практике используют более простые способы. Например, американский химик Дж. Льюис в 1916 году предложил обозначать электроны точками рядом с символами элементов. Одна точка обозначает один электрон. В этом случае образование молекулы водорода из атомов записывается так:
Оказалось, что формулы Льюиса имеют глубокий химический смысл. Мы видим, что связь между атомами водорода обозначается парой электронов. Как предположил Льюис, именно пара электронов позволяет образовать ковалентную связь. Впоследствии это предположение подтвердилось квантовой теорией.
Ковалентной связью называется связывание атомов с помощью общих (поделенных между ними) электронных пар.
Рассмотрим связывание двух атомов хлора 17 Cl (заряд ядра Z = 17) в двухатомную молекулу с позиций строения электронных оболочек хлора. Для этого запишем формулу Льюиса для атома хлора и конфигурацию его внешней электронной оболочки:
После объединения атомов в молекулу из двух неспаренных электронов атомов получается новая электронная пара:
При этом каждый из атомов хлора оказывается в окружении ОКТЕТА электронов. В этом легко убедиться, если обвести кружком любой из атомов хлора.
Льюис не только предложил теорию ковалентной связи, но и первым сформулировал правило октета-дублета, которым мы уже пользовались в прошлой главе для объяснения устойчивости атомов. Это правило применительно к химическим связям можно сформулировать так:
атомы образуют химические связи в результате обобществления такого количества электронов, чтобы приобрести электронную конфигурацию, подобную завершенной электронной конфигурации атомов благородных элементов.
Два атома водорода, объединившись в молекулу, приобрели “завершенную” молекулярную оболочку, подобную завершенной электронной оболочке атома благородного газа гелия (1s 2 ). Атомы хлора в молекуле приобрели молекулярную оболочку, похожую на завершенную оболочку атома аргона (. 3s 2 3p 6 ).
Познакомимся теперь с ионной связью. Как ни удивительно, она ничем принципиально не отличается от ковалентной связи. Движущей силой ее образования является все то же стремление атомов к октетной оболочке. Но в ряде случаев такая “октетная” оболочка может возникнуть только при передаче электронов от одного атома к другому. Поэтому ионная связь, в отличие от ковалентной, возникает только между атомами разного вида.
Рассмотрим конкретный пример: реакцию между атомами натрия (Z = 11) и фтора (Z = 9). При образовании связи между ними оба элемента приобретают внешнюю электронную оболочку благородного газа неона (Z = 10). Для того, чтобы убедиться в этом, надо записать электронные формулы всех трех элементов:
Na: 1s 2 2s 2 2p 6 3s 1
В электронных формулах нам важны только электронные конфигурации внешних уровней (они подчеркнуты). Запишем реакцию с помощью формул Льюиса:
Теперь в дополнение к ковалентной составляющей химической связи в молекуле Na + : F – добавляется еще и электростатическое притяжение между ионами натрия и фтора. Это увеличивает прочность химической связи. Однако ковалентная составляющая (стремление к октету) продолжает играть большую роль и в ионных соединениях.
Полярная ковалентная связь занимает промежуточное положение между чисто ковалентной связью и ионной связью. Так же, как и ионная, она может возникнуть между двумя атомами разных видов. В полярной ковалентной связи электроны смещаются от атома к атому не так сильно, как в ионной. Это происходит тогда, когда атомам энергетически невыгодно далеко “отпускать” свои собственные электроны, отданные в общую “копилку” – молекулярную орбиталь. Если электроны слишком далеко сдвинутся к одному из атомов, молекулярная орбиталь перестанет быть похожей на “октетную”. В то же время у разных атомов разные донорные и акцепторные свойства, поэтому связывающая электронная пара не располагается точно посередине между ядрами, как в ковалентной связи.
В качестве примера рассмотрим образование воды в реакции между атомами водорода (Z = 1) и кислорода (Z = 8). Для этого удобно сначала записать электронные формулы для внешних оболочек водорода (1s 1 ) и кислорода (. 2s 2 2p 4 ). Затем на помощь приходят формулы Льюиса, которые наглядно показывают, как образуются “завершенные” электронные оболочки рядом с атомами водорода и кислорода в молекуле воды:
Оказывается, для этого необходимо взять именно два атома водорода на один атом кислорода. Однако природа такова, что акцепторные свойства атома кислорода выше, чем у атома водорода (о причинах этого чуть позже). Поэтому связывающие электронные пары в формуле Льюиса для воды слегка смещены к ядру атома кислорода. Связь в молекуле воды – полярная ковалентная, а на атомах появляются частичные положительные и отрицательные заряды.
О том, как предсказать акцепторные свойства атомов и где проходит “граница” между полярной ковалентной и ионной связями мы поговорим в параграфе 3.4.
** В специальной главе, посвященной элементу кислороду, мы еще раз вернемся к вопросу о том, как правильно изображать связь в его молекуле. А пока (в первом приближении) можно остановиться на приведенной выше формуле с двойной связью.
Атомы азота (. 2s 2 2p 3 на последней оболочке) также связываются в двухатомную молекулу, но для организации октета электронов им требуется расположить между собой уже три поделенные пары:
Структурные формулы очень хороши для изображения молекул: они четко показывают – как атомы связаны между собой, в каком порядке, какими связями.
Связывающая пара электронов в формулах Льюиса – то же самое, что одна черточка в структурных формулах.
Порядок связи – это число обобществленных поделенных пар между двумя связанными атомами. Порядок связи выше трех не встречается.
Таблица 3-1. Длины и прочности связей между атомами азота в различных соединениях.
Длина связи в ангстремах 1А = 10 –8 см
Прочность связи в кДж на одинаковое число молекул
** Рассмотрим данные по длинам и прочностям связей между атомами азота в различных его соединениях. В таблице 3-1 длины связей приведены в специальных единицах – ангстремах (1А = 10 –8 см). Относительную прочность связей можно оценить по энергии, которая необходима для разрыва связей между атомами азота в разных соединениях. Эта энергия дается для одинакового числа молекул таких соединений. Чем выше кратность связи, тем она короче и прочнее.
Чем выше порядок связи, тем прочнее связаны между собой атомы и тем короче сама связь.
3.1. Исходя из строения атомов 6 C, 1 H и правила октета, составьте формулу Льюиса для соединения этих двух элементов, в составе которого 1 атом углерода. Нарисуйте для него структурную формулу.
3.2. Напишите (с указанием величины и знака заряда) символы ионов натрия, кислорода, фтора, магния, алюминия, электронные оболочки которых такие же, как у благородного газа неона.
3.3. Напишите электронные формулы внешних электронных уровней атомов 13 Al и 17 Cl. Один атом алюминия и три атома хлора дают соединение, в котором атомы этих элементов приобретают завершенные оболочки инертных газов. Какие это инертные газы? Напишите формулу Льюиса соединения между алюминием и хлором. Нарисуйте для него структурную формулу.
3.4.Составьте формулу Льюиса для соединения, включающего один атом 20 Ca и два атома 9 F. Сколько связывающих (поделенных) и несвязывающих (неподеленных) электронных пар в этом соединении? Какова его структурная формула?
3.5. Исходя из электронного строения атомов и правила октета, составьте формулы Льюиса для соединений, состоящих: а) из двух атомов 6 C и четырех атомов 1 H; б) из двух атомов 6 C и двух атомов 1 H. Каковы кратности связей между атомами углерода в этих двух соединениях? Нарисуйте их структурные формулы (первое из них называется этилен, второе – ацетилен).
3.6. По структурным формулам составьте формулы Льюиса с указанием всех неподеленных электронных пар:
Загадочный натрий хлор
Соль – это один из важнейших компонентов нашего пищевого рациона, основной поставщик ионов натрия и хлора, без которых невозможно образование главных составляющих желудочного сока – щелочи и соляной кислоты. Соль нужна для нормальной работы клеток, для распределения воды в тканях.
В организме отложено про запас не меньше 120 г хлорида натрия. Но и расход соли на ежедневные нужды немалый. Только с потом мы теряем примерно 2 г соли, а со слезами выплакиваем до 1 г. Поэтому в сутки нам требуется около 5–6 г новых солевых поступлений. Но в большинстве своем мы пересаливаем пищу и съедаем по 10–15 г, то есть в два-три раза больше нормы.
В жарком климате потоотделение идет гораздо интенсивнее, чем в странах с умеренным климатом. Поэтому и соли для нормальной работы организма жителям южных районов требуется в среднем на 2 г больше.
Только 15 % потребляемой человеком соли родом из солонки. Большую часть нужной нам соли мы получаем из продуктов. Мясо, рыба, хлеб, овощи, колбаса, чипсы, замороженные обеды, пиццы, пакетные супы, консервированные овощи и фастфуды – настоящие рекордсмены по содержанию соли!
В 60-е годы прошлого века, когда в моду вошли продукты быстрого приготовления, соль окрестили «белой смертью», и это пугающее прозвище пристало к ней на долгие десятилетия. Главное обвинение соли – она приводит к повышению артериального давления, а это основной фактор риска развития таких страшных болезней, как инфаркт и инсульт. Перенасыщение солью причиняет колоссальный вред почкам, сердцу, артериям. При нарушении обменных процессов в организме задерживается жидкость, развиваются отеки, появляется избыточный вес. Кроме того, высокий уровень потребления соли может спровоцировать мигрени, ухудшить состояние больного при астме.
Виновата во всех этих недугах, разумеется, не соль, а неумеренное ее употребление. Известно, что снижение употребления соли всего на 3 грамма в день уменьшает риск инсульта на 22%, инфаркта на 34%, а давление приближается к нормальному – «выигрыш» в среднем равняется 11,5 мм рт. столба.
Однако полностью отказываться от подсаливания пищи не нужно. Современные исследования доказывают – жить без соли невозможно. Дефицит NaCl опасен для здоровья ничуть не меньше, чем избыток. Установлено, что дневная норма потребления соли составляет 5 – 6 г. Ее составляющие – натрий (до 40%) и хлор (до 60%) поддерживают и регулируют водно-солевой баланс. Поваренная соль связывает воду (всего 1 г справляется со 100 мл – а это полстакана). И это важнейшая с точки зрения физиологии способность соли. Солевая нехватка грозит обезвоживанием. Кроме того, ионы хлора служат исходным материалом для образования соляной кислоты, благодаря которой пища переваривается. Ионы натрия также участвуют в процессе пищеварения, стимулируя активность различных энзимов. А еще соль обеспечивают своевременную доставку клеткам глюкозы – универсального топлива.
При физических нагрузках потребность в соли возрастает. Поэтому врачи-физиологи рекомендуют спортсменам для утоления жажды пить не кипяченую, не дистиллированную, а минеральную воду, в которую входит хлорид натрия. А после интенсивных нагрузок (например, после длинных пеших прогулок) рекомендуют пить слегка подсоленную воду и не пытаться утолять жажду чистой водой из горных ручьев, где очень низкое содержание соли.
На Руси о целебных свойствах соли знали давно. Однако из-за того, что она была в дефиците и стоила слишком дорого, в лечебных целях соль применялась крайне редко. Большинство дошедших до нас рецептов лечения солью связано с более поздними временами, когда наладилась регулярная поставка соли в Россию.
При сильном насморке рекомендуется как можно чаще промывать полость носоглотки соленой водой (0,5 чайной ложки на стакан теплой воды). Это как раз та концентрация соли, которую имеет сыворотка крови, поэтому раствор не разрушает слизистую оболочку. Такой раствор соли помогает очистить горло и голосовые связки, устранить проблемы, обусловленные излишками жидкости в гайморовых пазухах, препятствует распространению инфекции. Если болит горло, донимают кашель и насморк – промойте нос и прополощите горло солевым раствором (половину чайной ложки соли и 5–6 капель сока лимона или клюквы на стакан теплой воды). Если ноет зуб, а на прием к зубному записан только на завтра – растворите чайную ложку соли в стакане чуть теплой воды. Прополощите рот после еды и перед сном. Если болит голова – приложите компресс, смоченный в крепком солевом растворе с несколькими каплями уксуса. Если устали и отекли ноги – сделайте 15-минутную теплую ножную ванночку с солью. Это любимый рецепт Марлен Дитрих, которая всегда носила платья со сногсшибательными разрезами.
Чем же объясняется лечебное действие соли? Раствор поваренной соли обладает активными абсорбирующими свойствами. Таким образом, происходит обновление жидкости в тканях больного органа и их дезинфекция.
Наиболее широко соль как подручное средство использовалась во время Великой Отечественной войны. В частности, опытные хирурги накладывали повязки с раствором соли на раны, особенно гнойные. После таких повязок рана быстро очищалась, спадала температура. Если при этом у раненого бойца был и перелом, то сразу после соленой повязки на поврежденное место накладывался гипс, и раненые быстро поправлялись.
В китайском трактате по фармакологии «Пень Цао Кань Му», написанном в 2700 году до нашей эры, описано 40 видов соли. Сегодняшний выбор не так богат: основные виды – это йодированная, диетическая, фторированная и столовая.
Йодированная соль – наиболее простой, дешевый, универсальный и эффективный способ профилактики заболеваний щитовидной железы. Ежедневное подсаливание пищи йодированной солью обеспечит нас половиной дневной нормы йода.
Диетическая соль – это соль с пониженным содержанием натрия. Около одной трети этого элемента, с которым многие специалисты связывают повышение артериального давления, в ней заменено на калий или магний, необходимые для нормальной работы сердца. Кстати, в отличие от натрия, задерживающего жидкость в тканях, калий избавляет нас от излишков воды, не допуская образования отеков. Эта соль – настоящее спасение для тех, кто страдает атеросклерозом и избыточным весом.
Фторированная соль обеспечивает дополнительную профилактику кариеса, поскольку фтор отвечает за крепость зубной эмали.
Столовая – это соль с пряностями и травами. Одной щепотки такой приправы достаточно, чтобы сразу посолить, поперчить блюдо, придать ему аромат чеснока или сельдерея.
Какая связь между натрием и хлором
Как видим, натрий имеет один валентный электрон, который он “согласен” отдать, чтобы его энергетические уровни стали завершенными.
Как видим, хлор имеет 7 валентных электронов и ему “не хватает” одного электрона, чтобы его энергетические уровни стали завершенными.
Теперь догадываетесь, почему так “дружны” атомы хлора и натрия?
| Главный закон химической реакции – заполнение валентного энергетического уровня |
| Любой атом может получить или отдать не более трех электронов |
Натрий: Na
Электронная конфигурация катиона натрия: Na + 1s 2 2s 2 2p 6
Хлор: Cl
Поваренная соль (хлорид натрия): NaCl
Исходя из вышесказанного, видно, что электрон, который отдает натрий, становится электроном, который получает хлор.
В кристаллической решетке хлорида натрия каждый катион натрия окружен шестью анионами хлора. И наоборот, каждый анион хлора окружен шестью катионами натрия.
Соединения с ионными связями называют солями. В твердом состоянии все ионные соединения являются кристаллическими веществами.
| Ионная связь – химическая связь между катионами и анионами (заряженными частицами, в которые превращаются атомы после отдачи или присоединения электронов). |
Чтобы не “обижать” ионные соединения, химики договорились считать, что химическая связь является ионной, если разность электроотрицательностей атомов, образующих молекулу вещества равна или более 2. (см. понятие электроотрицательности).
Катионы и анионы
Другие соли образуются по аналогичному принципу, что и хлорид натрия. Металл отдает электроны, а неметалл их получает. Из периодической таблицы видно, что:
Распространенные одноатомные катионы
| Группа | Элемент | Ион | Обозначение |
| IA | Литий Натрий Калий | Катион лития Катион натрия Катион калия | Li + Na + K + |
| IIA | Бериллий Магний Кальций Стронций Барий | Катион бериллия Катион магния Катион кальция Катион стронция Катион бария | Be 2+ Mg 2+ Ca 2+ Sr 2+ Ba 2+ |
| IB | Серебро | Катион серебра | Ag + |
| IIB | Цинк | Катион цинка | Zn 2+ |
| IIIB | Алюминий | Катион алюминия | Al 3+ |
Распространенные одноатомные анионы
Не все так просто с переходными металлами (группа В), которые могут отдавать разное количество электронов, образуя при этом по два (и более) катиона, имеющих разные заряды. Например:
| Электрический заряд, который получает атом, называется степенью окисления |
Многие ионы переходных металлов могут иметь разную степень окисления.
Примеры многоатомных ионов:
Если вам понравился сайт, будем благодарны за его популяризацию 🙂 Расскажите о нас друзьям на форуме, в блоге, сообществе. Это наша кнопочка:
Как семейные узы успокоили две буйные натуры
Несмотря на первую часть названия, повествование наше будет не о скучных химических веществах и их взаимодействиях. Наш рассказ — о страстной любви. У истории будет счастливый финал — образование крепкой семьи.
В рамках этого повествования мы побываем на свадьбе, будем наблюдать встречу и развитие отношений между натрием и хлором — двумя влюбленными с очень непростыми характерами. Еще мы увидим пиротехническое действо, побываем на берегу Мертвого моря, выучим стихотворение всего из двух слов, откроем тайну раствора, спасающего жизнь людей, и многое другое.
В химии всё, как в жизни людей: встречи, расставания, воссоединения. Представьте себе: вокруг цветы, музыка. Мы присутствуем на брачной церемонии: соединить свои судьбы решили натрий и хлор. Говоря химическим языком, два вещества вступают в реакцию соединения.
Для начала давайте познакомимся поближе с брачующимися.
Натрий: физические и химические свойства
Итак, познакомимся поближе с женихом — натрием. Обычно родственники невесты интересуются, откуда жених родом. А он имеет вполне определенное место проживание в периодической таблице Менделеева: I группа, порядковый номер 11, группа щелочных металлов.
Натрий — простое вещество. Это серебристо-белый металл. Он легкий, мягкий, на воздухе быстро окисляется, с водой реагирует бурно, со взрывом. Как видим, характер у жениха непростой, взрывной.
Кроме того, натрий взаимодействует:
Хлор: физические и физические и химические свойства
А кто же у нас невеста?
Хлор — элемент 3-го периода, VII А-группы, порядковый номер 17. Это простое вещество, неметалл, входит в группу галогенов. Желто-зеленый ядовитый газ с резким удушливым запахом, термически устойчив, не горит на воздухе, смесь с водородом взрывается на свету.
Кроме водорода, хлор взаимодействует:
Как видим, у жениха и невесты те еще характеры. Как натрий, так и хлор, вступают в реакцию с различными веществами и соединениями.
Натрий хоть и металл, но мягкий и податливый: его можно резать ножом, как масло. Хлор тоже совсем непрост: ядовитый удушливый газ, он был первым отравляющим веществом, примененным на войне.
Исходя из таких данных, кажется, что альянс этих двоих будет просто чудовищным. Однако давайте не будем спешить с выводами. Рассмотрим, какова же реакция натрия и хлора, как они взаимодействуют.
Визуально реакция натрия и хлора между собой напоминает пиротехническое действо. В колбу, наполненную хлором, опускают небольшие кусочки натрия. Появляются вспышки, огонь, а затем густой белый дым! Очень зрелищно! А ведь этот белый дым и есть мельчайшие кристаллики поваренной соли. Вот какие страсти горят между нашими влюбленными! Куда там мексиканским сериалам!
А теперь охарактеризуем реакцию взаимодействия натрия и хлора с разных позиций.
Рассмотрим подробнее последний пункт, поскольку он объясняет побудительные мотивы соединения (почему именно реагирует натрий с хлором.
Дадим определение, что такое окислительно-восстановительная реакция. Реакции, сопровождающиеся передачей электронов от одного атома к другому, называются окислительно-восстановительными. Окислителем называется тот атом, который в ходе реакции принял электроны. А восстановителем — тот, который их отдал. Чтобы запомнить, кто окислитель, а кто — восстановитель, и не путаться в терминологии, есть очень простое стихотворение. Оно состоит всего из двух слов, но выучив его, вы никогда не будете путать, кто отдает, а кто принимает электроны:
Электронное строение атомов натрия и хлора
Порядковый номер элемента в периодической таблице Менделеева определяет заряд ядра, а следовательно, и количество электронов.
Рассмотрим электронное строение натрия и хлора, или образно говоря, имущество жениха и невесты.
Из электронной формулы натрия видно, что на внешнем электронном подуровне у него 1 электрон, который он легко может отдать. С другой стороны, хлору, чтобы достроить р-подуровень, не хватает одного электрона, который он и забирает у натрия. А если следовать нашей сюжетной линии, невеста присваивает часть имущества жениха, который охотно им делится, лишь бы она была рядом.
Надо отметить, что хлор — один из наиболее сильных окислителей. Натрий с хлором легко вступают в реакцию, так как один легко отдает электроны, а другой легко их принимает. Семья при этом получилась крепкая, в виде прекрасного соединения — хлорида натрия. Без поваренной соли ведь никуда: в кулинарии ее применяют сплошь и рядом как вкусовую добавку; в медицине — для лечебных растворов, снимающих отеки; в коммунальной службе — против гололеда; в водоподготовке — для смягчения воды; используется хлорид натрия и в химической промышленности. Кстати, всем известный физраствор, который спас жизнь многим людям, представляет собой 0,9%-ный водный раствор хлорида натрия.
Добывают поваренную соль путем выпаривания соляных растворов. Мировой лидер по производству поваренной соли — Китай. В природе она встречается в виде залежей галита и сильвинита, рапы соляных озер, минеральных примесей морей. Чаще всего это кристаллы белого цвета, но в природе встречаются месторождения соли, окрашенной в голубой, желтый, серый цвет и даже с красным оттенком.
Давайте мысленно перенесемся на Мертвое море.
Не тонуть в нем позволяет высокая концентрация растворенных в нем солей (35 г на 1 литр воды), в том числе и хлорида натрия.
Итак, подытожим: воссоединились такие бурные, непредсказуемые и местами ядовитые натрий и хлор; реакция же дала в результате безобидное и даже полезное соединение — поваренную соль. Как мы говорили вначале, семейные узы обуздали две бурные натуры и сделали их счастливыми и безопасными для окружающих. Такой вот счастливый финал у нашей истории.
Реакцией натрия с соляной кислотой :
2Na + 2HCl = 2NaCl + H2↑
Реакцией гидроксида натрия с соляной кислотой :
NaOH + HCl = NaCl + H2O
Реакцией на соли более слабых кислот :
Na2CO3 + 2HCl = 2NaCl + CO2 + H2O
NaOH + NH4Cl = NaCl + NH3↑ + H2O
Обменная реакция между солью щелочью с образованием новой соли и нерастворимого гидроксида :
FeCl3 + 3NaOH = Fe( OH )3↓ + 3NaCl
Применение хлорида натрия
NaCl + H2SO4 =NaHSO4 + HCl↑
Кипячение приводит к полному образованию сульфата натрия и соляной кислоты :
2NaCl + H2SO4 = Na2SO4 + 2HCl↑
2NaCl + 4H2SO4 + PbO2 = Cl2↑ + Pb( HSO4 )2 + 2NaHSO4 + 2H2O
Аналогично ведёт себя оксид марганца :
2NaCl + 2H2SO4 + MnO2 = Cl2↑ + MnSO4 + Na2SO4 + 2H2O
10NaCl + 8H2SO4 + 2KMnO4 = 5Cl2↑ + 2MnSO4 + 5Na2SO4 + K2SO4 + 8H2O
Реакция хлорида натрия с солями серебра приводит к осаждению солей серебра из их растворов в качестве белого творожистого осадка ( качественная реакция на ионы серебра ) :
NaCl + AgNO3 = NaNO3 + AgCl↓
NaCl + AgNO2 =NaNO3 + AgCl↓
В водных растворах при пропускании газообразного аммиака и оксида углерода образуются две новых соли хлорид аммония и гидрокарбонат натрия :
NaCl + H2O + NH3 + CO2 = NaHCO3 + NH4Cl
При нагревании до температуры ( 300°С ) хлорида натрия и хлорида алюминия образуется соединение тетрахлоралюминат натрия :
NaCl + AlCl3 = NaAlCl4
Статья на тему хлорид натрия
Кемеровский государственый университет
Материалы
Тема 3. Химическая связь. Задания
1.Валентность хрома в соединениях CrO, Cr2O3, CrO3 равна соответственно:
3. В соединении HClO3 степень окисления хлора равна:
4. Свою максимальную степень окисления бром проявляет в соединении:
5. В каком соединении углерод проявляет низшую степень окисления:
6. Высшая положительная степень окисления марганца равна:
7. Вещество с ионной связью имеет формулу:
8. Только ковалентная связь имеет место в соединении с формулой:
9. Ковалентная неполярная связь наблюдается в следующем веществе:
10. Ковалентная связь отличается от ионной:
11. Только ионные связи имеют место в веществе:
12. Химическая связь наиболее прочна в молекуле:
13. Наиболее выражен характер ионной связи в соединении:
14. Длина связи увеличивается в ряду веществ, имеющих формулы:
15. Длина связи увеличивается в ряду:
17. Число π – связей в молекуле пропеновой кислоты равно:
18. Образование водородной связи между молекулами веществ не оказывает влияния на физическое свойство:
19. Наиболее прочные водородные связи образуются между атомом водорода и атомом:
20. Прочность водородной связи зависит:
21. В молекуле этилена атомы углерода находится в состоянии:
23. Неполярная молекула с ковалентной полярной связью – это молекула:
25. Линейное строение имеет молекула:
26. В ряду NH3 → PH3 происходит увеличение:
27. Установите соответствие между формулой вещества и степенью окисления хрома в нем.
| Формула вещества: | Степень окисления Cr: |
| 1) CrO3 | A) +2 |
| 2) KCrO2 | Б) +3 |
| 3) K2Cr2O7 | В) +4 |
| 4) K3[Cr(OH)6] | Г) +5 |
| Д) +6 | |
| Е) +7; |
28. Установите соответствие между формулой вещества и степенью окисления марганца в нем.
| Формула вещества: | Степень окисления Mn: |
| 1)K2MnO4 | A) +1 |
| 2) Mn(OH)4 | Б) +2 |
| 3) MnO2 | В) +4 |
| 4) MnS | Г) +5 |
| Д) +6 | |
| Е) +7 | |
| Ж) +8; |
29. Установите соответствие между названием химического элемента и возможными значениями его степеней окисления.
Реакция взаимодействия натрия и хлора.
Уравнение реакции взаимодействия натрия и хлора:
Реакция натрия и хлора протекает при обычных условиях.
Термохимическое уравнение этой реакции имеет следующий вид:
Таким образом, реакция натрия и хлора носит экзотермический характер.
Настоящий сайт посвящен авторским научным разработкам в области экономики и научной идее осуществления Второй индустриализации России.
Он включает в себя:
– экономику Второй индустриализации России,
– теорию, методологию и инструментарий инновационного развития – осуществления Второй индустриализации России,
– организационный механизм осуществления Второй индустриализации России,
– справочник прорывных технологий.
Мы не продаем товары, технологии и пр. производителей и изобретателей! Необходимо обращаться к ним напрямую!
Мы проводим переговоры с производителями и изобретателями отечественных прорывных технологий и даем рекомендации по их использованию.
Осуществление Второй индустриализации России базируется на качественно новой научной основе (теории, методологии и инструментарии), разработанной авторами сайта.
Конечным результатом Второй индустриализации России является повышение благосостояния каждого члена общества: рядового человека, предприятия и государства.
Вторая индустриализация России есть совокупность научно-технических и иных инновационных идей, проектов и разработок, имеющих возможность быть широко реализованными в практике хозяйственной деятельности в короткие сроки (3-5 лет), которые обеспечат качественно новое прогрессивное развитие общества в предстоящие 50-75 лет.
Та из стран, которая первой осуществит этот комплексный прорыв – Россия, станет лидером в мировом сообществе и останется недосягаемой для других стран на века.