Неоплазия высокой степени что это
Простатическая интраэпителиальная неоплазия
Простатическая интраэпителиальная неоплазия – патологическое состояние, сопровождающееся образованием очагов роста клеток предстательной железы с признаками их атипичного перерождения. Протекает бессимптомно. Рассматривается специалистами в качестве морфологического предшественника рака предстательной железы с высокой вероятностью злокачественной трансформации. Диагноз выставляется с учетом данных пальцевого ректального исследования, УЗИ, определения уровня простат-специфичного антигена и результатов гистологического исследования. Показано динамическое наблюдение. Может применяться диетотерапия, гормональная терапия и лучевая терапия.
Общие сведения
Простатическая интраэпителиальная неоплазия (ПИН) – облигатный предрак предстательной железы, сопровождающийся очаговой пролиферацией эпителия протоков и ацинусов простаты с образованием клеток с признаками атипии. По различным данным, выявляется у 8-50% больных, направленных на пункционную биопсию предстательной железы в связи с подозрением на рак простаты. Вероятность возникновения увеличивается с возрастом. При проведении обследования пациентов в возрасте 40-50 лет признаки простатической интраэпителиальной неоплазии выявляются в 14-18% случаев, в возрасте 80 и более лет – в 63-86% случаев. Пик заболеваемости приходится на возраст 65 лет. Аденокарцинома предстательной железы развивается в среднем через 5 лет после выявления ПИН. Вместе с тем, возможна как быстрая малигнизация, так и многолетнее стабильное течение без признаков дальнейшего озлокачествления. Вероятность злокачественного перерождения, по данным различных авторов, наблюдается в 35-100% случаев. Лечение осуществляют специалисты в области онкологии, урологии и андрологии.
Причины ПИН
Причины развития точно не выяснены. Специалисты указывают, что определенную роль играет неблагоприятная наследственность. У пациентов нередко выявляются гены BRCA1 и BRCA2, при которых наблюдается повышение вероятности развития аденокарциномы предстательной железы. Риск возникновения ПИН также повышается при хроническом простатите и наличии в анамнезе инфекций, передающихся половым путем.
В качестве факторов риска простатической интраэпителиальной неоплазии указывают ионизирующее излучение, длительный контакт с кадмием при выполнении профессиональных обязанностей, употребление большого количества животных жиров, недостаток ультрафиолетовых лучей, обусловленный продолжительным пребыванием в северных регионах, пожилой возраст, иммунные нарушения, нехватку некоторых витаминов и микроэлементов.
Классификация ПИН
Классификация данного патологического состояния претерпевала неоднократные изменения. Вначале специалисты выделяли три степени ПИН: легкую умеренную и выраженную. Затем из-за затруднений при определении степеней поражения в 1989 году приняли упрощенную классификацию с двумя группами ПИН: низкой и высокой степени. Низкая (первая) степень характеризовалась незначительными изменениями клеток, могла свидетельствовать о низком риске злокачественной трансформации, наблюдаться при доброкачественной гиперплазии (аденоме) или хроническом воспалении предстательной железы. При высокой (второй) степени простатической интраэпителиальной неоплазии в ткани простаты выявлялись клетки с выраженными признаками атипии.
В последующем эта классификация перестала быть общепринятой, хотя некоторые специалисты продолжают применять данное разделение на группы в клинической практике. В наши дни большинство онкологов и урологов пользуются следующей классификацией неопластических изменений тканей предстательной железы:
Основными признаками простатической интраэпителиальной неоплазии являются: нарушение структуры эпителиальной выстилки протоков с утратой четкого разделения на клеточные слои, а также характерные изменения клеток эпителия с увеличением ядер и появлением крупных везикулярных включений. Реже выявляются клетки с мелкими гиперхроматичными ядрами. В центральной или периферической части ядер может обнаруживаться несколько ядрышек однородной либо неоднородной структуры. С учетом особенностей гистологического строения различают 4 формы простатической интраэпителиальной неоплазии: пучковую, плоскую, крибриформную и микропапиллярную. Пучковая форма наблюдается в 97% случаев. Обычно при изучении препарата обнаруживается сочетание нескольких форм.
Диагностика и лечение ПИН
Диагноз ПИН выставляют после проведения пункционной биопсии и последующего гистологического исследования в связи с подозрением на аденокарциному предстательной железы. Наряду с биопсией в процессе обследования осуществляют пальцевое ректальное исследование простаты, трансректальное УЗИ предстательной железы и определение уровня простат-специфичного антигена (ПСА) в плазме крови. При выявлении атипической гиперплазии (ПИН первой степени) решение о проведении последующих диагностических мероприятий принимается индивидуально. В зависимости от возраста больного и результатов других исследований возможны как динамическое наблюдение, так и повторная биопсия. При обнаружении простатической интраэпителиальной неоплазии (ПИН второй степени) через 1-3 месяца показана расширенная биопсия с забором материала из 12 или более участков предстательной железы.
Тактику ведения больных также определяют индивидуально. Всем пациентам с гистологически подтвержденной ПИН показано диспансерное наблюдение у уролога. Анализы на определение ПСА назначают ежемесячно. Трансректальное УЗИ предстательной железы осуществляют раз в полгода. Повторную биопсию выполняют не реже, чем раз в год, при настораживающих результатах других диагностических процедур необходимо внеплановое исследование. Показанием к лучевой терапии является наличие ПИН высокой степени в сочетании с прогрессирующим увеличением уровня ПСА в крови.
Кроме того, пациентам с простатической интраэпителиальной неоплазией назначают гормональную терапию для нейтрализации влияния тестостерона на измененные эпителиальные клетки. Используют бусерелин, лейпрорелин, нилутамид, флутамид, финастерид и другие препараты. Больным рекомендуют отказаться от вредных привычек, соблюдать диету с пониженным содержанием животных жиров, большим количеством витаминов и микроэлементов. Специалисты отмечают, что тактика лечения простатической интраэпителиальной неоплазии в данное время находится на стадии разработки, в последующем возможно изменение подходов к терапии данного состояния.
Что такое дисплазия шейки матки? Причины возникновения, диагностику и методы лечения разберем в статье доктора Игнатенко Т. А., гинеколога со стажем в 13 лет.
Определение болезни. Причины заболевания
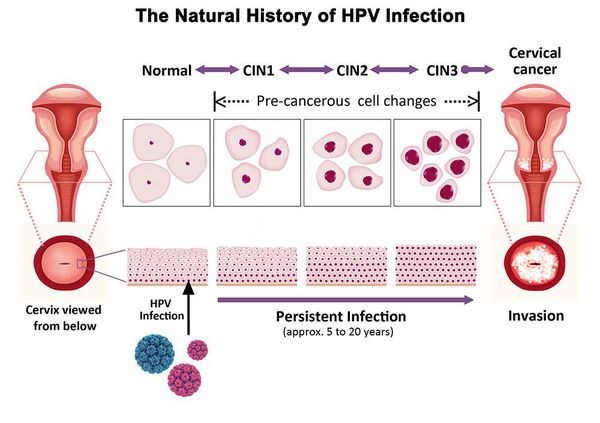
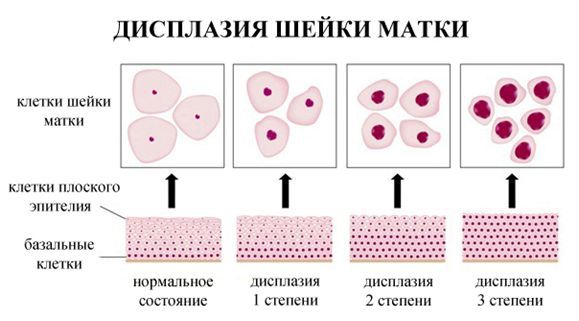
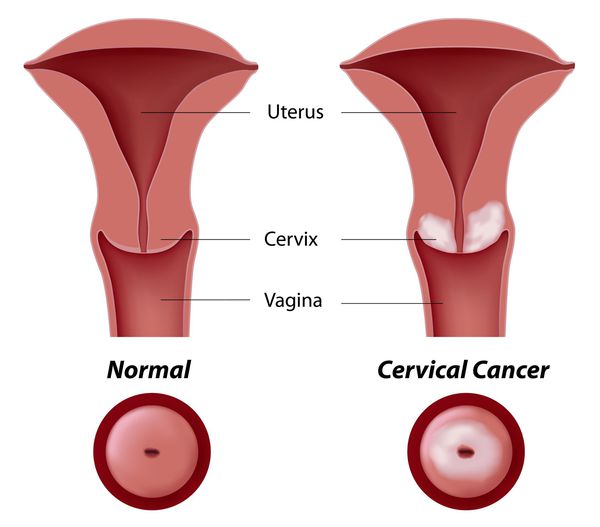
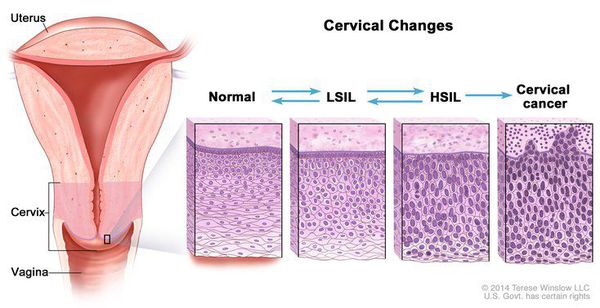
Дисплазия шейки матки, или цервикальная интраэпителиальная неоплазия (ЦИН), или Cervical Intraepithelial neoplasia (CIN) — это патологический процесс, при котором в толще клеток, покрывающих шейку матки, появляются клетки с различной степенью атипии (неправильного строения, размера, формы).
Основной фактор развития дисплазии и рака шейки матки — папилломавирусная инфекция (ПВИ), причем длительное персистирование именно ВПЧ высокого канцерогенного риска. У женщин с риском развития цервикальной неоплазии распространенность онкогенных типов ВПЧ чрезвычайно велика. ВПЧ становится причиной CIN 2-3 и рака шейки матки в 91,8% и 94,5% случаев соответственно. [1]
Риск цервикальной CIN 2 особенно высок у женщин, которые до этого имели опыт пересадки органов, у них выявлена ВИЧ-инфекция или они принимают иммунодепрессанты. [2]
Кроме того, была выявлена связь между пассивным курением среди некурящих и повышенным риском возникновения CIN 1. [3]
Симптомы дисплазии шейки матки
Дисплазия шейки матки, как правило, имеет бессимптомное течение, поэтому пациентки не предъявляют никаких специфических жалоб.
Патогенез дисплазии шейки матки
Критический фактор развития цервикальной интраэпителиальной неоплазии — инфицирование вирусом папилломы человека. Во многих случаях цервикальная интраэпителиальная неоплазия легкой степени отражает временную реакцию организма на папиломавирусную инфекцию и без лечения исчезает в течение полугода-года наблюдения. При цервикальной интраэпителиальной неоплазии умеренной и тяжелой степени высока вероятность встраивания вируса папилломы человека в клеточный геном. Инфицированные клетки начинают продуцировать вирусные белки E6 и Е7, которые продлевают жизнь клетки, сохраняя ее способность к неограниченному делению. Неизбежно формирующиеся на этом фоне мутации клеток ведут к формированию предрака (дисплазии) и рака шейки матки, влагалища и вульвы.
Онкогенные белки ВПЧ (Е6, Е7) взаимодействуют с регуляторными белками клеток шейки матки, приводя к повышению активности онкомаркера p16INK4A, что свидетельствует о неконтролируемом размножении клеток шейки матки. Таким образом, сверхэкспрессия p16INK4A, определяемая в материале шейки матки, который получают при биопсии, является биомаркером интеграции вируса папилломы человека высокого риска в геном и трансформации эпителиальных клеток под действием вируса, что делает эту информацию полезной при оценке прогноза развития предраковых и злокачественных поражений, связанных с инфицированием генитального тракта вирусом папилломы человека. [5]
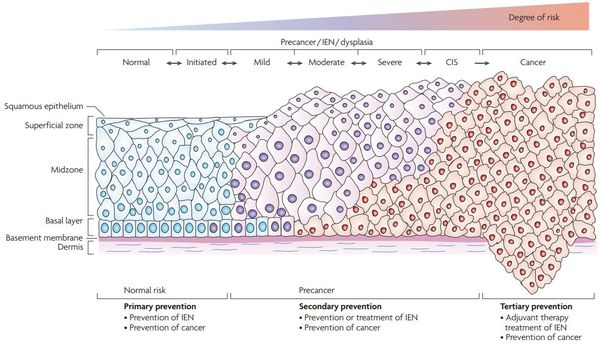
Классификация и стадии развития дисплазии шейки матки
Для постановки цитологического диагноза (по результатам цитологического исследования соскобов шейки матки и цервикального канала с окрашиванием по Папаниколау (Рар-тест) или жидкостной цитологии) используется классификация Бетесда (The Bethesda System, 2014), основанная на термине SIL (Squamous Intraepithelial Lesion) – плоскоклеточное интраэпителиальное поражение. [10]
Выделяют три вида результатов соскобов с поверхности шейки матки (экзоцервикса):
Классификация Папаниколау
Существуют также гистологические классификации для оценки материала, полученного при биопсии.
По классификации R. M. Richart (1968) в зависимости от глубины поражения поверхностного клеточного слоя шейки матки выделяют:
В приведенной ниже таблице даны соотношения классификаций предраковых поражений шейки матки. [9]
Осложнения дисплазии шейки матки
Основное и самое опасное осложнение цервикальной интраэпителиальной неоплазии заключается в развитии рака шейки матки, любой случай развития которого — результат упущенных возможностей диагностики и лечения дисплазии шейки матки. [7]
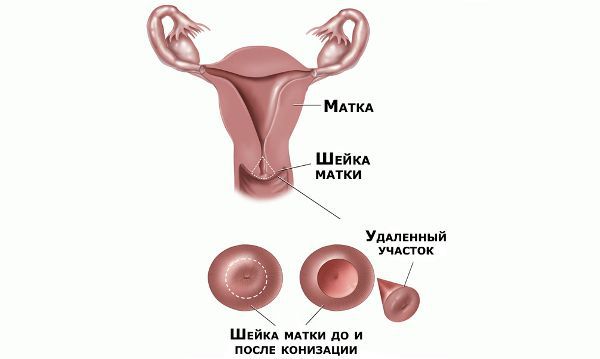
Проводились длительные, систематические исследования риска рака шейки матки у женщин с диагнозом цервикальной интраэпителиальной неоплазии 3 степени (CIN3) по сравнению с женщинами, у которых были нормальные цитологические результаты. Согласно полученным данным, долгосрочный относительный риск развития рака шейки матки зависит от различных гистологических типов CIN3 и выше всего он для аденокарциномы in situ. Даже через 25 и более лет после конизации (хирургического иссечения патологических тканей шейки матки) риск злокачественного перерождения клеток был значительным. [4]
Диагностика дисплазии шейки матки
Для ранней диагностики предраковых поражений шейки матки во многих странах мира существует система цервикального скрининга.
В России данная система включает последовательность действий:
При кольпоскопии должна быть тщательно оценена зона трансформации (переходная зона стыка двух видов покровного эпителия шейки матки).
Влагалищная часть шейки матки (экзоцервикс) покрыта многослойным плоским эпителием. В канале шейки матки (цервикальном канале, эндоцервиксе) — цилиндрический эпителий. Место перехода цилиндрического эпителия цервикального канала в многослойный плоский эпителий поверхности шейки матки носит название зоны трансформации. Эта область имеет большое клиническое значение, поскольку именно в ней возникает более 80% случаев дисплазии и рака шейки матки.
Лечение дисплазии шейки матки
Динамическому наблюдению подлежат молодые пациентки (до 35 лет) с LSIL (ВПЧ, ЦИН 1, ЦИН 2, если при биопсии не обнаружен белок р16, являющийся признаком проникновения ВПЧ высокого риска в геном и трансформации опухолевых клеток под действием вируса). Наблюдать возможно пациенток только с 1 и 2 кольпоскопическим типом зоны трансформации.
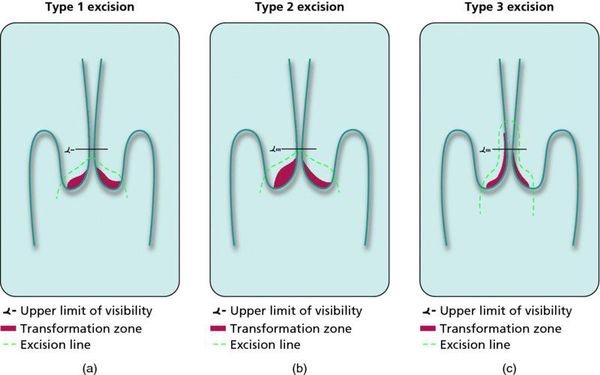
Контрольные осмотры, цитологическое и ВПЧ-тестирование показаны через 6 и 12 месяцев после первичного обнаружения патологии. При выявлении HSIL (ЦИН 2 c обнаружением белка р16 при биопсии, ЦИН 3) неизбежно хирургическое лечение в виде абляции («прижигания») или эксцизии (удаления) поврежденной ткани. Для абляции используют электро-/радио-, крио- и лазерные воздействия. Эксцизия возможна электро-/радиоволновая или ножевая.
Немаловажно, что при выявлении по кольпоскопии 3 типа зоны трансформации на фоне положительного РАР-теста гинеколог обязан провести выскабливание слизистой канала шейки матки и/или широкую эксцизионную биопсию (конизацию шейки матки) для исключения опухолевого процесса, потенциально располагающегося вне зоны кольпоскопического обзора. Немаловажно наблюдение после операции через 6 и 12 месяцев с выполнением цитологического соскоба и ВПЧ-теста.
Следует отметить, что процедура хирургического иссечения патологических тканей на шейке матки увеличивает риск преждевременных родов. А сама по себе цервикальная интраэпителиальная неоплазия первой степени на течении беременности и родов никак не отражается и зачастую опасности не представляет. [12]
Средний возраст женщин, когда может потребоваться хирургическая коррекция цервикальной внутриэпителиальной неоплазии — около 30 лет. Хирургическое лечение нередко ассоциировано с неблагоприятным течением последующей беременности. Частота и тяжесть неблагоприятных осложнений возрастают с увеличением глубины иссекаемых тканей. [13]
Прогноз. Профилактика
При своевременном выявлении и лечении дисплазии шейки матки прогноз благоприятный. Основным фактором развития и прогрессирования дисплазии шейки матки является длительное инфицирование канцерогенными типами ВПЧ. Для предупреждения заражения ВПЧ существуют профилактические вакцины «Церварикс» (защита от 16, 18 типов ВПЧ), «Гардасил» (профилактика инфицирования 6, 11, 16, 18 типами вируса), в декабре 2014 года Управление по санитарному надзору за качеством пищевых продуктов и медикаментов одобрило использование вакцины «Гардасил9», защищающей от инфицирования 9 типами ВПЧ (6, 11, 16, 18, 31, 33, 45, 52, 58). Однако на российском рынке данный продукт ещё не доступен. «Церварикс» зарегистрирована для вакцинации женщин от 10 до 25 лет; «Гардасил» показана к применению детям и подросткам в возрасте от 9 до 15 лет и женщинам от 16 до 45 лет.
Дополнительными факторами риска прогрессирования ПВИ с формированием предраковой патологии являются:
Устранение и профилактика данных факторов способны снизить вероятность развития предраковой патологии шейки матки.
Рак шейки матки поражает преимущественно женщин репродуктивного возраста. Скрининг является важной стратегией вторичной профилактики. Длительный процесс канцерогенной трансформации от появления в организме вируса папилломы человека (ВПЧ) до инвазивного рака дает широкие возможности для выявления заболевания на стадии, когда лечение высокоэффективно. Подходящими скрининговыми тестами в мире признаны цитологическое исследование, визуальный осмотр после применения уксусной кислоты и тесты на выявление ВПЧ. Всемирная организация здравоохранения рекомендует проводить скрининг женщин по крайней мере один раз в жизни в возрасте от 30 до 49 лет. [14]
Согласно приказу Министерства здравоохранения РФ от 03.02.2015. N36ан “Об утверждении порядка проведения диспансеризации определенных групп взрослого населения”, осмотр со взятием мазка (соскоба) с поверхности шейки матки и цервикального канала на цитологическое исследование производится 1 раза в 3 года для женщин в возрасте от 21 года до 69 лет включительно.
Фолликулярная неоплазия щитовидной железы (лекция)
Полный текст:
Аннотация
Узловые образования щитовидной железы выявляются примерно у 4–7% лиц, проживающих в регионах с нормальной йодной обеспеченностью. В регионах йодного дефицита распространенность узлового зоба значительно выше, особенно у женщин старше 40 лет, у которых она может превышать 30%.
Ключевые слова
Для цитирования:
Трошина Е.А., Мазурина Н.В., Абесадзе И.А., Юшков П.В., Егорычева Е.К. Фолликулярная неоплазия щитовидной железы (лекция). Проблемы Эндокринологии. 2006;52(1):22-25. https://doi.org/10.14341/probl200652122-25
For citation:
Troshina E.A., Mazurina N.V., Abesadze I.A., Yushkov P.V., Yegorycheva Y.K. Follicular thyroid neoplasia (a lecture). Problems of Endocrinology. 2006;52(1):22-25. (In Russ.) https://doi.org/10.14341/probl200652122-25
Узловые формы зоба представляют собой весьма гетерогенную патологию щитовидной железы как с позиции морфологии, так и в плане клинического течения: речь может идти о солитарных или множественных коллоидных узлах либо об опухолевых образованиях на фоне различного функционального состояния щитовидной железы. Анализируя данные разных авторов, можно сделать заключение о том, что злокачественные опухоли встречаются примерно в 5% случаев всех узловых образований’щитовидной железы.
При обнаружении в щитовидной железе пальпируемых узловых образований одной из основных целей обследования является исключение рака щитовидной железы. Дифференциальный диагноз доброкачественных и злокачественных узловых образований требует проведения комплексного обследования, так как ни один из используемых на сегодняшний день методов не обладает 100% специфичностью и чувствительностью в отношении диагностики рака щитовидной железы.
Единственным методом морфологической диагностики узловых образований щитовидной железы является тонкоигольная аспирационная биопсия (ТАБ) с последующим цитологическим исследованием. ТАБ щитовидной железы позволяет поставить точный морфологический диагноз в 70—85% случаев. Морфологический материал, полученный при ТАБ, принято делить на 4 категории: доброкачественные изменения; злокачественные изменения; изменения, подозрительные на злокачественные; недостаточный для цитологического исследования материал.
Доброкачественные изменения включают в себя коллоидный зоб, тиреоидиты, кисты, нормальную ткань щитовидной железы. Злокачественные изменения обнаруживают в 4—5% случаев. К этой группе относят папиллярный рак (самая частая злокачественная опухоль щитовидной железы), медуллярный рак, лимфомы и метастазы опухолей другой локализации.
В группу изменений, подозрительных на злокачественные, или неопределенных изменений на цитологическом этапе включают фолликулярные и гюртлеклеточные опухоли щитовидной железы. Выделение этой группы является следствием ограниченных возможностей ТАБ в диагностике этих новообразований щитовидной железы. На основании цитологического исследования не представляется возможным отличить фолликулярную аденому от фолликулярного рака. Именно поэтому их объединяют термином “фолликулярная неоплазия”.
Фолликулярная неоплазия: определение, классификация, эпидемиология
Фолликулярная неоплазия — это группа новообразований, цитологическая картина которых характеризуется преобладанием в пунктате фолликулярных структур с полиморфизмом или без него.
Распространенность фолликулярной неоплазии по данным ТАБ составляет 10—15% среди всех узловых образований щитовидной железы. В подавляющем большинстве случаев речь идет о доброкачественных образованиях. Тем не менее примерно в 1 из 10—15 случаев фолликулярная неоплазия оказывается злокачественным образованием (высокодифференцированным фолликулярным раком).
Фолликулярные образования считаются доброкачественными, если отсутствует инвазия в сосуды и капсулу опухоли. Таким образом, гистологическое исследование является решающим в дифференциальной диагностике фолликулярных опухолей щитовидной железы.
Что же служит критерием постановки диагноза? Инвазия капсулы, инвазия в вены и рост за пределы капсулы — это диагностические критерии фолликулярного рака щитовидной железы. Критерием сосудистой инвазии является исключительно прорастание вен, потому что разрастание опухоли по капиллярам в веществе опухоли не имеет диагностического и прогностического значения.
Для оценки инвазивности роста опухоли требуется исследование нескольких срезов ее периферийных частей. Очевидно, что оценить инвазию сосудов или капсулы невозможно при цитологическом исследовании. Подобные проблемы появляются и при интраоперационной оценке замороженных срезов.
Фолликулярная аденома: морфология, тактика лечения, прогноз
Фолликулярная аденома определяется как доброкачественная инкапсулированная опухоль из клеток фолликулярного эпителия, чаще единой структуры, состоящая из мономорфных укрупненных тироцитов. Аденомы чаще всего являются солитарными, хотя возможны и первично-множественные опухоли.
Согласно гистологической классификации опухолей щитовидной железы (ВОЗ, 1988), терминология, используемая для отображения структуры фолликулярных аденом, включает в себя следующие варианты: нормофолликулярная, макрофол- ликулярная, микрофолликулярная (фетальная), трабекулярная и солидная (эмбриональная).
Микрофолликулярная аденома может иметь различные признаки. Клетки могут формировать хорошо дифференцированные фолликулы, схожие с нормальными фолликулами, или иметь трабекулярный характер с рудиментарными фолликулами или без них.
Изредка фолликулярная аденома содержит клетки Бишара, которые представляют собой цитологически атипичные клетки с огромным гипер- хромным ядром, иногда находят клетки с множественными ядрами. Эти изменения также доброкачественные.
Методом выбора оперативных вмешательств при фолликулярной аденоме являются резекция щитовидной железы или гемитиреоидэктомия. Прогноз благоприятный.
Фолликулярный рак: морфология, тактика лечения, прогноз
Фолликулярный рак составляет 2—5% всех опухолей щитовидной железы. Фолликулярная карцинома чаще представляет собой единичную опухоль щитовидной железы, более или менее инкапсулированную. Отмечают склонность фолликулярного рака к прорастанию кровеносных сосудов (но не лимфатических).
В зависимости от степени прорастания окружающих тканей выделяют опухоли с минимальной (инкапсулированные) или со значительной инвазией. Это подразделение имеет большое клиническое значение, так как прогноз хуже при значительной инвазии. В целом нет затруднения в подразделении двух гистологических типов.
Более 50% случаев всех фолликулярных опухолей составляют опухоли с минимальной инвазией. Макроскопически фолликулярный рак с минимальной инвазией неотличим от фолликулярной аденомы. Диагноз злокачественности базируется на наличии сосудистой инвазии и/или инвазии всей толщины капсулы. Часто необходимо исследование множества срезов с периферии опухоли для исключения или подтверждения инвазии. Цитологически опухоли с минимальной инвазией практически неотличимы от доброкачественных аденом и цитологическое исследование не в состоянии дифференцировать злокачественное повреждение от доброкачественного. Срочное гистологическое исследование замороженных срезов, даже из множества различных участков узла, также не всегда позволяет поставить правильный диагноз. В случаях со значительной инвазией видна инфильтрация ткани щитовидной железы, поэтому возникает меньше диагностических трудностей.
При микроскопическом исследовании степень дифференцировки опухоли может варьировать. Как минимально, так и значительно инвазивный фолликулярный рак морфологически вариабелен — от дифференцированных с хорошо сформированными фолликулами, содержащими коллоид, до плохо дифференцированных с солидным характером роста. Для определения прогноза важно принимать во внимание как характер инвазии, так и степень дифференцировки, так как близкой корреляции между этими двумя показателями нет.
Диссеминация фолликулярного рака происходит гематогенным путем, чаще всего опухоль метастазирует в кости, легкие, мозг и печень. Гематогенные метастазы часты при варианте с выраженной инвазией и редко встречаются при минимальной инвазии.
Методом лечения при фолликулярном раке является тиреоидэктомия с последующей радиойод- терапией. Пациентам, оперированным по поводу предположительно доброкачественных опухолей, оказавшихся при гистологическом исследовании фолликулярным раком (как правило, с минимальной инвазией), рекомендовано повторное оперативное вмешательство — тиреоидэктомия. Аргументами в пользу радикального оперативного вмешательства являются снижение риска рецидива; лучшая выживаемость при размерах опухоли более 1,5 см; возможность проведения радиоабляции |31 1 остаточной тиреоидной ткани; возможность использовать тиреоглобулин в качестве маркера рецидива заболевания.
Прогностические факторы при фолликулярном раке
Больные фолликулярным раком со значительным инвазивным ростом имеют менее благоприятный прогноз. У пациентов с инкапсулированными фолликулярными опухолями щитовидной железы отмечается лучшая выживаемость (10-летняя более 80%). Ряд исследователей оценивали клинические и морфологические факторы, ассоциированные с неблагоприятным исходом. К ним относятся пожилой возраст на момент постановки диагноза, мужской пол, рост за пределы щитовидной железы или метастазирование на момент постановки диагноза, продолженная инвазия в сосуды, солидная или трабекулярная структура, анеуплоидные популяции клеток. Факторы неблагоприятного прогноза представлены в таблице.
Выраженная сосудистая инвазия, без сомнения, является фактором неблагоприятного прогноза. Некоторые гистологические варианты фолликулярного рака, такие как гюртлеклеточный, также часто имеют худший прогноз. Такие опухоли, как правило, менее дифференцированы и демонстрируют низкую способность к захвату радиоактивного йода. Между степенью сосудистой инвазии и степенью дифференцировки опухоли не всегда прослеживается четкая корреляция, поэтому эти свойства опухоли должны учитываться независимо друг от друга.
Распространение опухоли за пределы капсулы щитовидной железы также является независимым фактором неблагоприятного прогноза. Прорастание опухоли за пределы железы наблюдается в 3— 5% случаев фолликулярного рака. Такие пациенты подвергаются большему риску рецидивов, развитию отдаленных метастазов и смерти, связанной с опухолевым процессом.
Факторы неблагоприятного прогноза при фолликулярном раке щитовидной железы (М. Schlumberger, F. Pacini, 1999)
Индивидуальные характеристики пациента
Характеристики опухоли
Большой размер опухоли
Распространение опухоли за пределы капсулы щитовидной железы
Наличие отдаленных метастазов
Метастазы в лимфатические узлы
Тактика лечения
Нерадикальная операция (резекция щитовидной железы)
После тиреоидэктомии не проведена радиойодтерапия
Повышение уровня тиреоглобулина через 3 мес после операции
Метастазы в регионарные лимфатические узлы при фолликулярном раке щитовидной железы наблюдаются в 15—20% случаев, т. е. гораздо реже, чем при папиллярном раке. Данные о прогностическом значении регионарных метастазов довольно противоречивы. При анализе результатов подобных исследований важно учитывать, что прогноз в каждом индивидуальном случае зависит не только от наличия метастазов, но и от их количества, размеров и инвазивности роста.
По мнению многих ведущих специалистов в области лечения рака щитовидной железы, наличие отдаленных метастазов на момент постановки диагноза определяет самый неблагоприятный прогноз при фолликулярном раке. Смертность, связанная с опухолевым процессом, варьирует в зависимости от длительности наблюдения и составляет приблизительно 70% в течение 15 лет.
Потеря дифференцировки опухолевыми клетками сопровождается снижением экспрессии специфических генов, таких как ген рецептора ТТГ, Na + / Г-симпортера, тиреоглобулина, тиреоидной пероксидазы. Снижение экспрессии этих генов означает снижение или даже потерю способности к захвату радиоактивного йода, что имеет принципиальное значение при лечении отдаленных метастазов.
Рецидивы рака щитовидной железы и развитие отдаленных метастазов могут рассматриваться как следствие поздней диагностики или агрессивного биологического поведения опухоли. К сожалению, еще одной причиной может быть неадекватное хирургическое вмешательство. Рецидив или метастазирование могут произойти в течение 5 лет после операции, хотя известны случаи метастазирования через много лет после хирургического вмешательства.
Многие специалисты признают, что радикальное хирургическое лечение является решающим фактором благоприятного исхода. Результаты многих исследований свидетельствуют о том, что проведение тиреоидэктомии по сравнению с резекцией щитовидной железы значительно снижает риск рецидива у всех пациентов и повышает выживаемость у пациентов с плохим прогнозом.
Радиойодтерапия с целью полной деструкции остатков тиреоидной ткани после хирургического вмешательства улучшает прогноз, снижая риск рецидива у пациентов с опухолями более 1,5 см и при распространении опухоли за пределы капсулы щитовидной железы. При небольшом размере опухоли, радикальном объеме хирургического вмешательства и отсутствии других неблагоприятных факторов прогноз благоприятный и лечение радиоактивным йодом не создает дополнительных преимуществ, хотя и должно быть проведено. В любом случае полная деструкция тиреоидных остатков повышает диагностическую значимость сканирования со 131 1 и исследования уровня сывороточного тиреоглобулина.
Современные возможности молекулярной диагностики при фолликулярной неоплазии
Достижения молекулярной диагностики делают возможным дополнительное исследование как цитологического, так и операционного материала, позволяющее в ряде случаев проводить дифференциальный диагноз между доброкачественными и злокачественными образованиями. Основные требования, которые предъявляются к молекулярным маркерам в клинической практике, могут быть сформулированы следующим образом.
В научной литературе описывается не менее 50 различных молекулярных маркеров, исследованных у пациентов с узловыми образованиями щитовидной железы. Однако только 4 из многочисленных маркеров (тиреоидная пероксидаза, теломераза, галектин-3 и RET/PTC) оказались полезными в клинической практике и продемонстрировали высокую чувствительность и специфичность при исследовании пунктатов, подозрительных на злокачественные; кроме того, эти маркеры могут определяться практически в любой морфологической лаборатории.
Таким образом, дифференциальная диагностика фолликулярных опухолей щитовидной железы остается одной из актуальных проблем современной эндокринологии и онкологии. Проведение иммуногистохимических исследований маркеров злокачественного роста в ткани щитовидной железы может позволить усовершенствовать дифференциальную диагностику фолликулярных образований щитовидной железы не только при гистологическом исследовании, но и на цитологическом этапе.